一個番茄細胞分裂素受體類激酶基因的生物信息學分析
李愛芹 李利斌 劉國明
摘要:利用生物信息學的方法從番茄的基因組中解析得到一個與擬南芥滲透脅迫相關的細胞分裂素受體類激酶HK1高度同源的基因,命名為LeHK1,并對它的序列結構、蛋白基序、啟動子區的順式元件和基因的遺傳進化進行了分析。 結果顯示,番茄基因LeHK1編碼的蛋白具有組氨酸蛋白激酶的結構特征,而且在進化上與擬南芥的滲透脅迫感受基因AtHK1分屬同一個類群。從基因順式反應元件分析來看,番茄基因LeHK1具有多個響應不同環境信號如熱、干旱、激素信號的順式元件,預示這個基因在環境響應和植物生長發育過程中具有重要功能。
關鍵詞:番茄; HK1; 基因和蛋白結構; 順式反應元件; 遺傳進化
中圖分類號:Q75文獻標識碼:ADOI編碼:10.3969/j.issn.1006-6500.2009.05.001
Bioinformatics of A Cytokinin Receptor Like Kinase Gene in Tomato(Lycopersicum esculentum L.)
LI Ai-qin1, LI Li-bin2, LIU Guo-ming3
(1. High and New Technology Center of Shandong Academy of Agricultural Sciences,Jinan, Shandong 250100, China; 2. Vegetable Research Institute, Shandong Academy of Agricultural Sciences, Jinan, Shandong250100, China; 3.Taitou Town Comprehensive Agricultural Servicce Station of Shouguang City, Shouguang , Shandong 262735,China)
Abstract:Through bioinformatic method and datamining, a tomato homolog of arabidopsis histidine kinase gene HK1 which encodes a cytokinin recepter like protein, was isolated and named LeHK1. The structure ofLeHK1 sequence and its putative coding protein, aslo its cis-elements in promoter regioin and phylogenetic relasionship with other plants HKs was analyzed. The results showed that LeHK1 possesed the character of histidine kinase, and it was clusteredin the same group with AtHK1. According to the result of cis-elements analysis,tomato HK1 has muptiple cis-elements responsive to different environmental factors such as heat, drought, and hormones. This suggests that LeHK1 may play key roles in response to stresses and development.
Key words: Lycopersicum esculentum; HK1; gene and protein strtuctre ; cis-element; phylogeny
組氨酸蛋白激酶家族在植物乙烯、細胞分裂素和光信號響應過程中具有重要功能,參與和調節植物生長發育和對環境因子響應的眾多過程。組氨酸蛋白激酶基因在模式植物擬南芥和水稻中得到了廣泛和深入的研究[1-12], 但是在西紅柿中的研究,尤其是對與細胞分裂素信號相關的組氨酸激酶基因的研究還很不充分。現有研究表明,細胞分裂素受體類蛋白在植物生長發育和逆境響應過程中具有極其重要的功能[1-3,5-15]。番茄作為世界上種植面積最大、也是我國最重要的蔬菜之一,在農業生產和人們的生活中具有不可替代的作用。因此,研究番茄細胞分裂素受體類蛋白基因對于改良番茄的抗逆性,以適應全球氣候變暖和水資源日益匱乏,以及由于各種人為原因造成的土壤鹽漬化等局面,力求生產更多的蔬菜,滿足人們的生活需求具有重要意義。擬南芥滲透脅迫感受基因AtHK1(細胞分裂素受體類蛋白基因)已被克隆并得到功能驗證[1,7],其直系同源基因在楊樹、長春花中都已得到克隆和研究[13,16], 但在西紅柿中還未見報道。因此,本研究擬利用擬南芥基因AtHK1的信息來解析番茄的同源基因序列。

1材料和方法
利用擬南芥的滲透脅迫感受基因AtHK1序列在Genbank中搜索相應的番茄基因組序列[17],根據內含子的邊界特征解析得到編碼區序列,利用編碼區和基因組序列進行結構展示[18],并對預測編碼的蛋白進行結構特征分析[19]和亞細胞定位預測[20]。根據基因組序列得到上游啟動子區的序列,并對啟動子序列中的順式反應元件進行預測分析[21]。遺傳進化分析利用MEGA4.1來進行,采用Bootstrap test-Neighbor Joining 方法,重復500次運算。
2結果與分析
2.1番茄LeHK1的序列和結構特征
本研究通過比較基因組學和生物信息學的方法從番茄基因組中得到一個與擬南芥HK1同源的基因組序列,命名為LeHK1。其預測編碼的蛋白與擬南芥HK1的序列一致性為60.81%。LeHK1基因組序列長為5 261 bp,編碼區為3 738 bp,預測編碼一個含有1 245個氨基酸殘基,分子量為138.86 kD的蛋白(表1)。這個基因位于番茄2號染色體的BAC克隆AC215474中,含有13個外顯子,其外顯子和內含子的結構如圖1所示。

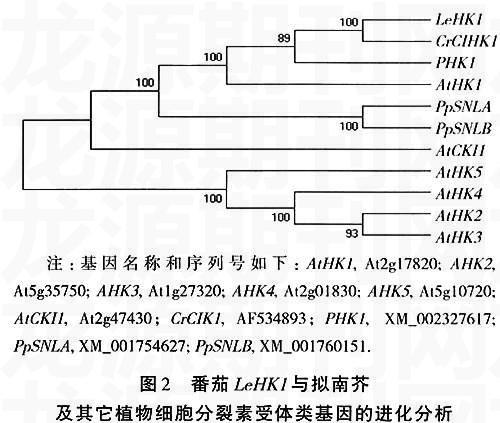
2.2 番茄LeHK1的進化分析
番茄LeHK1與擬南芥細胞分裂素受體相關的蛋白基因家族的進化分析表明(圖2),LeHK1與AtHK1的關系最近, 推測與AtHK1有類似的功能,在滲透脅迫反應過程中具有重要作用。另外,LeHK1類基因在苔蘚、楊樹、長春花中都已得到克隆,而且在進化上分為同一個類群。長春花的CIHK1基因受冷脅迫誘導[16],因此,推測LeHK1可能在冷脅迫響應中也具有某種功能。功能性失活和獲得研究表明,AtHK1能夠正向調節植物對干旱、鹽的響應和ABA的信號轉導[1,2,7]。基因芯片分析的結果顯示,突變體athk1中多個受逆境/ABA誘導表達的基因表達明顯下降,這包括AREB1、ANAC和DREB2A及其調控的下游基因[1]。這說明,AtHK1基因作用于AREB1、ANAC和DREB2A的上游,可以通過依賴和不依賴ABA的信號途徑正向調節逆境響應。另外,研究表明AtHK1在植物生長和種子成熟中也具有重要功能[1,7]。
2.3番茄LeHK1基因的順式反應元件
通過分析啟動子及其上游序列的順式反應元件可以預測基因的功能。因此,本研究在得到LeHK1的基因組序列以后,取起始密碼子上游2 000 bp的序列進行順式元件分析,結果見表2。在LeHK1起始密碼子上游2 000 bp的范圍內共有10類順式反應元件,包括赤霉素響應元件GARE和TATC-box,熱激響應元件HSE,能和Myb蛋白結合的干旱誘導的順式反應元件mybs,富含TC的逆境響應元件,晝夜節律響應元件,胚乳特異表達的順式元件Skn-1,與防衛反應有關的順式元件W-box和EIRE,還有Box-W1。這些結果表明,LeHK1基因可能不僅能夠響應某些激素、熱等非生物因子,而且與防衛反應和種子發育也有關系,值得深入探討。
2.4番茄LeHK1蛋白的結構預測
為了研究LeHK1的功能,在解析得到它的編碼序列后,對其預測編碼的蛋白進行了結構分析。結果顯示,LeHK1蛋白含有磷酸結合結構域、反應調節結構域、組氨酸激酶結構域、跨膜螺旋結構域和潛在的豆蔻酰化位點。這說明LeHK1蛋白具有組氨酸激酶的結構特征,而且有可能被豆蔻酰化。蛋白豆蔻酰化有利于與細胞膜的結合。亞細胞定位預測表明,LeHK1蛋白可能定位在細胞膜上,這與結構分析的結果相一致。
3討論
細胞分裂素受體類激酶在植物逆境響應和生長發育過程具有重要功能。本研究解析的番茄基因LeHK1編碼的蛋白具有組氨酸蛋白激酶的結構特征,而且在進化上與擬南芥的滲透脅迫感受基因HK1分屬同一個類群,二者蛋白序列一致性達60.81%,而且亞細胞定位預測的結果表明LeHK1蛋白可能定位在細胞膜上。從這些分析結果來看,番茄基因LeHK1應為細胞分裂素受體類激酶基因,可能與擬南芥的滲透脅迫感受基因AtHK1具有相同或者相似的功能。另外,從基因順式反應元件分析來看,番茄基因LeHK1 具有多個能響應不同環境信號如熱、干旱、晝夜節律、病原物侵染,以及激素信號如赤霉素等的順式反應元件,可對多種信號作出響應,預示這個基因在環境信號響應和植物生長發育過程中具有重要功能。至于番茄基因LeHK1對各種環境和激素信號的響應模式,在逆境響應和生長發育中的具體功能以及與細胞分裂素信號的關系需要深入探討。本研究為進一歩研究番茄LeHK1基因的功能奠定了基礎。
參考文獻:
[1] Tran L P, Urao T, Qin F, et al . Functional analysis of AHK1/ATHK1 and cytokinin receptor histidine kinases in response to abscisic acid, drought, and salt stress in Arabidopsis[J].PNAS ,2007, 104: 20623-20628.
[2] Urao T, Yakubov B, Satoh R, et al. A transmembrane hybrid-type histidine kinase in arabidopsis functions as an osmosensor[J].The Plant Cell, 1999(11): 1743-1754.
[3] Higuchi M, Pischke M S, Mǎhǒnen, et al. In planta functions of the Arabidopsis cytokinin receptor family[J].PNAS, 2004,101: 8821-8826.
[4] Hwang I, Chen H C, Sheen J. Two-component signal transduction pathways in Arabidopsis[J].Plant Physiol, 2002,129:500-515.
[5] Nishimura C, Ohashi Y,Sato S, et al. Genetic analysis of Arabidopsis histidine kinase genes encoding cytokinin receptors reveals their overlapping biological functions in the regulation of shoot and root growth in Arabidopsis thaliana[J].Plant Cell ,2004(16):1365-1377.
[6] Desikan R, Horàk J, Chaban C, et al. The histidine kinase ahk5 integrates endogenous and environmental signals in Arabidopsis guard cells[J].PLoS ONE, 2008, 3(6): 2491.
[7] Wohlbach D J, Quirino B F, Sussman M R. Analysis of the Arabidopsis histidine kinase athk1 reveals a connection between vegetative osmotic stress sensing and seed maturation[J].Plant Cell, 2008(20):1101-1117.
[8] Iwama A, Yamashino T, Tanaka Y, et al. AHK5 histidine kinase regulates root elongation through an ETR1-dependent abscisic acid and ethylene signaling pathway in Arabidopsis thaliana[J].Plant Cell Physiol, 2007,48(2):375-380.
[9] Pareek A, Singh A, Kumar M, et al. Whole-genome analysis of oryza sativa reveals similar architecture of two-component signaling machinery with arabidopsis[J].Plant Physiology, 2006,142(2):380-397.
[10] Jain M, Tyagi K, Khurana J P. Differential gene expression of rice two-component signaling elements during reproductive development and regulation by abiotic stress[J].Functional & Integrative Genomics, 2008, 8(2): 175-180.
[11]Pareek A,Singh A, Kumar M, et al. Whole-genome analysis of oryza sativa reveals similar architecture of two-component signaling machinery with Arabidopsis[J].Plant Physiology,2006,142(2): 380-397.
[12] Ito Y, Kurata N. Identification and characterization of cytokinin-signalling gene families in rice[J].Gene, 2006(382):57-65.
[13] Chefdor F, Bénédetti H, Dpierreux C, et al. Osmotic stress sensing in populus: Osmoponents identification of a phosphorelay system[J].FEBS Letters, 2005(580): 77-81.
[14] Gonzalez-Rizzo S, Crespi M, Frugier F. The medicago truncatula CRE1 cytokinin receptor regulates lateral root development and early symbiotic interaction with sinorhizobium meliloti[J].The Plant Cell, 2004(18): 2680-2693.
[15] Coba de la Pe a T, Cárcamo C B, Almonacid L, et al. A salt stress-responsive cytokinin receptor homologue isolated from Medicago sativa nodules[J].Planta, 2008, 227(4):769-779.
[16] Papon N, Clastre M, Andreu F, et al. Expression analysis in plant and cell suspensions of CrCKR1, a cDNAencoding a histidine kinase receptor homologue in Catharanthus roseus (L.) G Don[J]. J Exp Bot,2002, 53 (376):1989-1990.
[17] Tatusova T A, Madden T L. Blast 2 sequences, a new tool for comparing protein and nucleotide sequences[EB/OL]. http://blast.ncbi.nlm.nih.gov/Blast.cgi,1999-01-01.
[18] Guo A Y, Zhu Q H, Chen X, et al. GSDS: A gene structure display server. [EB/OL]. http://gsds.cbi.pku.edu.cn/,2007-08-01.
[19] Gribskov M, Fana F, Harper J, et al. Plants P: A functional genomics database for plant phosphorylation[EB/OL]. http://plantsp.genomics.purdue.edu/html/feature_scan.html, 2001-01-01.
[20] Horton P, Park K J, Obayashi T, et al. Wolf psort: Protein localization predictor[EB/OL]. http://wolfpsort.org/, 2007-12-01.
[21] Lescot M, Déhais P, Thijs G, et al. Plant CARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[EB/OL]. http://bioinformatics. psb.ugent.be/webtools/ plantcare/html/,2002-12-01.

