放化療抵抗的胰腺癌細胞中干細胞標志物的表達
杜志勇 魏翠鳳 田銳 江建新 王敏 秦仁義
·論著·
放化療抵抗的胰腺癌細胞中干細胞標志物的表達
杜志勇 魏翠鳳 田銳 江建新 王敏 秦仁義
目的觀察放化療抵抗的胰腺癌細胞的Bcl-2、survivin及干細胞標志物Oct-4、ABCG2蛋白表達的變化,探討這部分腫瘤細胞耐受放化療的原因。方法采用同步放化療干預人胰腺癌細胞系SW1990、BxPC3、pc3、jf305,獲得放化療抵抗的胰腺癌細胞,以不行放化療處理的細胞作為對照。采用Western blotting檢測它們的Bcl-2、survivin、Oct-4和ABCG2蛋白的表達變化。結果放化療抵抗的SW1990、BxPC3、pc3、jf305胰腺癌細胞Bcl-2蛋白表達量分別為0.7955±0.0326、0.5718±0.0212、0.6137±0.0382和0.8733±0.0461;survivin蛋白表達量分別為0.8207±0.0490、0.6973±0.0211、0.7967±0.0346和0.8013±0.0398;Oct-4蛋白表達量分別為0.8728±0.0177、0.7861±0.0139、0.4794±0.0932和0.4216±0.1043;ABCG2蛋白表達量分別為0.7810±0.1370、0.4957±0.1126、0.6102±0.1358和0.4670±0.1274。對照組相應細胞系的4種蛋白表達量分別為0.4723±0.018、0.2954±0.0103、0.3587±0.0201和0.2718±0.0136;0.4717±0.0274、0.3587±0.0113、0.3891±0.0147和0.3326±0.0124;0.6053±0.0142、0.4236±0.0086、0.2385±0.0671和0.1985±0.0582;0.3156±0.0582、0.2360±0.0423、0.2813±0.0512和0.1808±0.0370。放化療后胰腺癌細胞的4種蛋白表達量均顯著增加(P﹤0.05)。結論放化療抵抗的胰腺癌細胞中可能富含腫瘤干細胞。
胰腺腫瘤; 干細胞; 腫瘤細胞系; 抗藥性,腫瘤; 標志物
放化療主要是通過誘導凋亡來殺死腫瘤細胞,腫瘤細胞耐受凋亡則導致治療失敗。現在認為治療失敗最根本的原因是腫瘤干細胞的存在[1]。腫瘤干細胞通常高表達抗凋亡蛋白而低表達促凋亡蛋白,因此較普通腫瘤細胞更加耐受凋亡。一般而言,腫瘤細胞系中的干細胞含量通常較少。我們以前的實驗結果顯示[2],單獨給予極高濃度的化療藥物很難殺死大部分胰腺癌細胞,而放化療同步往往能獲得最佳效果。因此,本文采用同步放化療的辦法殺死大部分胰腺癌細胞,檢測殘存的小部分放化療抵抗的胰腺癌細胞中干細胞標志物Oct-4、ABCG2及凋亡相關蛋白Bcl-2和survivin的表達變化,探討胰腺癌細胞耐受放化療的原因。
材料和方法
一、放化療抵抗胰腺癌細胞的獲取
人胰腺癌細胞系SW1990、BxPC3、pc3、jf305為本實驗室保存,復蘇后用含10%胎牛血清的RPMI1640培養基常規培養。取指數生長期細胞,SW1990、BxPC3和jf305細胞加入健擇(法國禮來有限公司產品,0.2 g/支)終濃度為10-6mol/L的培養基,pc3細胞加入健擇終濃度為5×10-7mol/L的培養基,培養24 h后2Gy照射一次,以后持續用含藥培養基培養,每天觀察細胞生長情況,當瓶底貼壁細胞不再明顯減少時收集剩余細胞。以不行放化療處理的細胞作為對照。
二、Oct-4、ABCG2、Bcl-2和survivin蛋白檢測
收集上述各組1×107個細胞,充分洗滌,置于冰上加入100 μl冷裂解液(pH 8.0的50 mmol/L Tris-HCl、150 mmol/L NaCl、0.02% NaN3、0.1% NP-40)。離心后取上清,考馬斯亮藍法測定蛋白濃度。取100 μg蛋白質,常規行Western blotting。兔抗人Oct-4 IgG及鼠抗人ABCG2 IgG(abcam公司)1∶500稀釋;鼠抗人survivin IgG和鼠抗人Bcl-2 IgG(santa cruz公司)1∶200稀釋。化學發光法顯示條帶,壓片曝光。測定各條帶吸光值,以目的蛋白條帶和內參條帶的吸光值積分比值表示目的蛋白的相對表達量。
三、統計學處理
結 果
一、殘存胰腺癌細胞量
同步放化療導致細胞生長減慢,大部分細胞死亡。連續培養10~12 d后,細胞數量不再明顯減少,此時細胞還剩10%左右。
二、胰腺癌細胞Bcl-2、survivin蛋白表達
放化療抵抗的SW1990、BxPC3、pc3、jf305胰腺癌細胞Bcl-2蛋白表達量分別為0.7955±0.0326、0.5718±0.0212、0.6137±0.0382和0.8733±0.0461,較相應對照組0.4723±0.018、0.2954±0.0103、0.3587±0.0201和0.2718±0.0136的表達量均顯著增加(圖1,P﹤0.05)。
放化療抵抗的SW1990、BxPC3、pc3、jf305胰腺癌細胞survivin蛋白表達量分別為0.8207±0.0490、0.6973±0.0211、0.7967±0.0346和0.8013±0.0398,較相應對照組0.4717±0.0274、0.3587±0.0113、0.3891±0.0147和0.3326±0.0124的表達量也均顯著增加(圖1,P﹤0.05)。
三、胰腺癌細胞Oct-4、ABCG2蛋白表達
放化療抵抗的SW1990、BxPC3、pc3、jf305胰腺癌細胞Oct-4蛋白表達量分別為0.8728±0.0177、0.7861±0.0139、0.4794±0.0932和0.4216±0.1043,較相應對照組的0.6053±0.0142、0.4236±0.0086、0.2385±0.0671和0.1985±0.0582的表達量均顯著增加(圖1,P﹤0.05)。
放化療抵抗的SW1990、BxPC3、pc3、jf305胰腺癌細胞ABCG2蛋白表達量分別為0.7810±0.1370、0.4957±0.1126、0.6102±0.1358和0.4670±0.1274,較相應對照組的0.3156±0.0582、0.2360±0.0423、0.2813±0.0512和0.1808±0.0370的表達量也均顯著增加(圖1,P﹤0.05)。
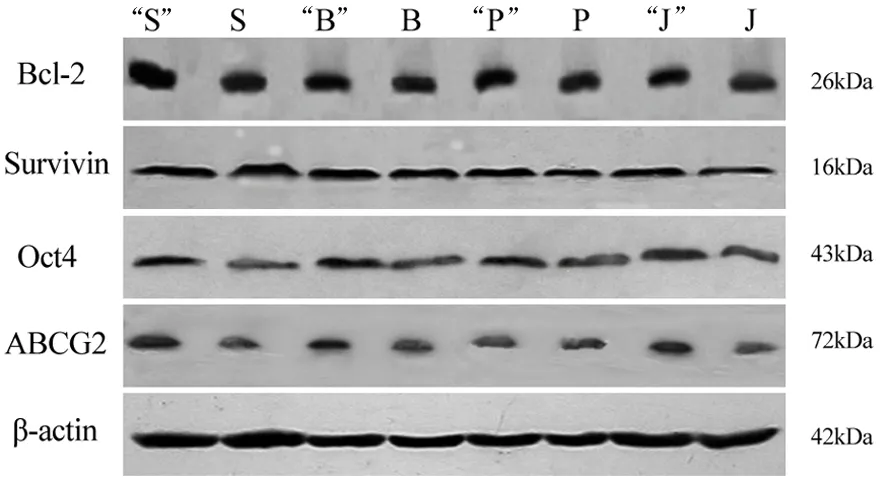
圖1SW1990(S)、BxPC(B)、pc3(P)和jf305(J)細胞的Oct-4、ABCG2、Bcl-2和survivin蛋白表達(加“”者為放化療抵抗組)
討 論
目前已經在血液系統腫瘤和多種實體腫瘤中發現了相應的腫瘤干細胞[1,3-4]。這些腫瘤干細胞和正常的干細胞一樣,通常處于G0期,高表達耐藥蛋白,并且具有強大的DNA修復能力和抗凋亡活性等[5],因此較常規的腫瘤細胞更能耐受凋亡,從而對放化療不敏感[3-4,6-8]。
腫瘤干細胞較普通腫瘤細胞更為耐受凋亡的主要原因是:⑴高表達Bcl-2等多種抗凋亡蛋白及survivin等多種凋亡抑制蛋白;⑵高表達包括ABCG2在內的多種耐藥蛋白。因此,腫瘤干細胞可能是腫瘤耐藥、復發轉移的重要原因[1,5]。此外,干細胞可通過Wnt/β-catenin信號途徑介導其放療抵抗[9]。本結果顯示,4株胰腺癌細胞經放化療處理后,殘存胰腺癌細胞Bcl-2、survivin和ABCG2蛋白表達均顯著增加,支持上述觀點。
采用放化療干預獲得放化療抵抗的腫瘤細胞,其可能富含腫瘤干細胞。ABCG2被認為是一個具有普遍意義的干細胞標志物[10],在干細胞低氧發育過程中發揮著重要的生理功能,在多種腫瘤干細胞高表達。Oct-4是另一個重要的干細胞標志物,對于維持干細胞的自我更新和多能性起著重要作用,并與腫瘤分化及惡性程度相關[11-12]。我們之前的研究和他人研究都已經證實胰腺癌細胞系表達干細胞標志物Oct-4和ABCG2[12-14]。Shah等[15]用濃度梯度遞增法得到健擇耐藥的胰腺癌細胞系,其CD24、CD44、ESA表達增加,而CD44+CD24+ESA+表型胰腺癌細胞(約占細胞總數的0.2%~0.8%)被認為是胰腺癌干細胞,這說明健擇耐藥的胰腺癌細胞中可能富含胰腺癌干細胞。Olempska等[14]認為,ABCG2和(或)CD133陽性的胰腺癌細胞可能是胰腺癌干細胞。本實驗結果顯示,放化療抵抗的胰腺癌細胞高表達Oct-4及ABCG2蛋白,也說明這部分殘存的胰腺癌細胞富含胰腺癌干細胞。
[1] Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance.Nat Rev Cancer,2005,5:275-284.
[2] Chang Q,Qin R,Huang T,et al.Effect of antisense hypoxia-inducible factor 1 alpha on progression,metastasis,and chemosensitivity of pancreatic cancer.Pancreas,2006,32:297-305.
[3] Liu G,Yuan X,Zeng Z,et al.Analysis of gene expression and chemoresistance of CD133+cancer stem cells in glioblastoma. Mol Cancer,2006,5:67.
[4] Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors.Cancer Res,2008,68:4311-4320.
[5] Lobo NA,Shimono Y,Qian D,et al.The biology of cancer stem cells.Annu Rev Cell Dev Biol,2007,23:675-699.
[6] Bao S,Wu Q,McLendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response.Nature,2006,444:756-760.
[7] Phillips TM,McBride WH,Pajonk F.The response of CD24(-/low)/CD44+breast cancer-initiating cells to radiation.J Natl Cancer Inst,2006,98:1777-1785.
[8] Eramo A,Ricci-Vitiani L,Zeuner A,et al.Chemotherapy resistance of glioblastoma stem cells.Cell Death Differ,2006,13:1238-1241.
[9] Woodward WA,Chen MS,Behbod F,et al.WNT/beta-catenin mediates radiation resistance of mouse mammary progenitor cells.Proc Natl Acad Sci USA,2007,104:618-623.
[10] Hadnagy A,Gaboury L,Beaulieu R,et al.SP analysis may be used to identify cancer stem cell populations.Exp Cell Res,2006,312:3701-3710.
[11] Gidekel S,Pizov G,Bergman Y,et al.Oct-3/4 is a dose-dependent oncogenic fate determinant.Cancer Cell,2003,4:361-370.
[12] Tai MH,Chang CC,Kiupel M,et al.Oct4 expression in adult human stem cells:evidence in support of the stem cell theory of carcinogenesis.Carcinogenesis,2005,26:495-502.
[13] 杜志勇,魏翠鳳,胡君,等.胚胎干細胞標志物Oct-4在胰腺癌的表達.胰腺病學,2007,7:357-359.
[14] Olempska M,Eisenach PA,Ammerpohl O,et al.Detection of tumor stem cell markers in pancreatic carcinoma cell lines.Hepatobiliary Pancreat Dis Int,2007,6:92-97.
[15] Shah AN,Summy JM,Zhang J,et al.Development and characterization of gemcitabine-resistant pancreatic tumor cells.Ann Surg Oncol,2007,14:3629-3637.
2009-01-06)
(本文編輯:屠振興)
Expressionofstemcellmarkersinpancreaticcancercellsresistanttochemoradiotherapy
DU Zhi-yong, WEI Cui-feng, TIAN Rui, JIANG Jian-xin, WANG Min, QIN Ren-yi.
Department of Pancreatic-Biliary Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
QINRen-yi,Emailryqin@tjh.tjmu.edu.cn
ObjectiveTo investigate the expression of Bcl-2, survivin and pancreatic cancer stem cells markers Oct-4 and ABCG2 in pancreatic cancer cells resistance to chemoradiotherapy, and explore its mechanism.MethodsConcurrent chemoradiotherapy was used to obtain pancreatic cancer cells resistant to chemoradiotherapy, the pancreatic cancer cells without chemoradiotherapy treatment were used as control. Western-blot was applied to detect the expression of Bcl-2, survivin, Oct-4, ABCG2.ResultsThe expression of Bcl-2 was 0.7955±0.0326, 0.5718±0.0212, 0.6137±0.0382 and 0.8733±0.0461, respectively; the expression of survivin protein was 0.8207±0.0490, 0.6973±0.0211, 0.7967±0.0346 and 0.8013±0.0398, respectively; the expression of Oct-4 protein was 0.8728±0.0177, 0.7861±0.0139, 0.4794±0.0932 and 0.4216±0.1043, respectively; the expression of ABCG2 protein was 0.7810±0.1370, 0.4957±0.1126, 0.6102±0.1358 and 0.4670±0.1274, respectively,in resistant pancreatic cancer cells of SW1990, BxPC3, pc3, jf305 cell line. The corresponding values in the control group were 0.4723±0.018,0.2954±0.0103, 0.3587±0.0201 and 0.2718±0.0136; 0.4717±0.0274, 0.3587±0.0113, 0.3891±0.0147 and 0.3326±0.0124; 0.6053±0.0142, 0.4236±0.0086, 0.2385±0.0671 and 0.1985±0.0582; 0.3156±0.0582, 0.2360±0.0423, 0.2813±0.0512 and 0.1808±0.a0370. The expression of all the four proteins significantly increased after chemoradiotherapy (Plt;0.05).ConclusionsPancreatic cancer cells resistant to chemoradiotherapy may contain cancer stem cells.
Pancreatic neoplasms; Stem cells; Tumor cell line; Drug resistance, neoplasm; Marker
10.3760/cma.j.issn.1674-1935.2009.05.011
國家自然科學基金(30471693)
430030 武漢,華中科技大學同濟醫學院附屬同濟醫院膽胰外科(杜志勇、田銳、江建新、王敏、秦仁義);湖北省荊門市第一人民醫院內分泌科(魏翠鳳);上海交通大學醫學院附屬瑞金醫院普外科(杜志勇)
秦仁義,Email:ryqin@tjh.tjmu.edu.cn

