原生質體融合技術選育弱后酸化乳酸菌菌株的研究
羅紅霞,陳志剛,黃彥芳,王芳,李春平,趙鋼
(1.北京農業職業學院 食品與生物工程系,北京 102442;2.新疆農業大學 食品科學學院,烏魯木齊 830052)
原生質體融合技術選育弱后酸化乳酸菌菌株的研究
羅紅霞1,陳志剛2,黃彥芳1,王芳1,李春平1,趙鋼1
(1.北京農業職業學院 食品與生物工程系,北京 102442;2.新疆農業大學 食品科學學院,烏魯木齊 830052)
對新疆地方乳酸菌Lactobacillus bulgaricus LN1#進行原生質體融合,應用均勻設計的方法得到L.bulgaricus LN1#的原生質體制備條件:溶菌酶質量濃度為15.00 g/L,酶解細胞壁的時間為60 min,酶解溫度為44℃。對原生質體進行滅活,致死率達到100%的條件:紫外線滅菌為120 s;高溫為53℃,60 min。應用青霉素對融合子進行篩選,最終得到37℃培養時產乳酸量與出發菌株相同,10℃貯藏時,產乳酸量明顯減少的目標菌株NO2#和NO3#。
乳酸桿菌;原生質融合;弱后酸化
0 引 言
乳酸菌發酵制備而成的酸乳,由于具有改善胃腸道功能、提高免疫能力、改善機體營養狀況等特殊的生理功能而越來越受到消費者的歡迎。但由于乳酸菌在正常發酵結束后,貯存、運輸、銷售直至食用前這一過程菌體仍會生長繁殖,使pH值繼續下降,出現消費者不可接受的過酸味及感官質量下降等后酸化現象[1]。因此,控制酸乳的后酸化,提高酸乳質量、延長保質期是目前急需解決的問題。
至今為止,誘變育種和細胞融合生物選育仍是世界各國行之有效的重要方法,以其在篩選優良菌株應用上的卓越成效而最受推崇。尤其發酵工業中的各種優良高產菌株絕大部分都是以誘變育種和生物選育方法獲得的。誘變育種和細胞融合生物選育除了能提高產量外,還可達到改善產品質量、擴大品種和簡化生產工藝等目的。
本研究以新疆牧民自制酸奶疙瘩中篩選的乳酸菌為出發菌株,采用細胞原生質融合技術對該乳酸菌菌株進行選育,選育在高溫條件下產酸較強、低溫條件下產酸較弱的菌株;以此菌株作為發酵劑,發酵得到的酸奶與對照組比較,后酸化時間延長了2-3 d。細胞原生質融合技術對新疆地方乳酸菌菌株的選育研究尚屬首次,該實驗參數和研究結果以期對未來新的乳酸菌菌株資源的開發利用提供有效地參考價值。
1 實 驗
1.1 材料與儀器設備
乳酸桿菌(Lactobacillus bulgaricus,LN1#),由本試驗室從新疆牧民自制酸奶中篩選、保藏,如圖1所示。
對照菌株:德氏乳桿菌保加利亞亞種(Lactobacillus bulgaricus,6032)標準菌株購于中國工業微生物菌種保藏中心,用作本試驗對照菌株。
紫外可見分光光度計(島津2450);酸度計(2003 Thermo Electron Corposition); 離心機 (Gppendorf-Centrifuge 5804R);醫用潔凈工作臺;生化培養箱;恒溫培養箱。一次性針頭濾器(PALL);數顯氣浴恒溫振蕩器;倒置顯微鏡。
培養基與溶液:脫脂乳培養基;MRS培養基;pH值為7.0的磷酸緩沖液;生理鹽水;高滲緩沖液;原生質體穩定液(PB);高滲再生培養基(固體/半固體);溶菌酶。
1.2 方法
1.2.1 溶液配置
原生質體穩定液(PB)[2]:0.02M HEPES,pH值為7.0,添加濃度為1 mmol/L的MgCl2,質量分數為0.5%的明膠,濃度為0.3 mol/L棉籽糖或濃度為0.5 mol/L的乳糖。
溶菌酶溶液:用原生質體穩定液(PB)配制成一定質量濃度的溶菌酶溶液,用一次性無菌濾器過濾除菌。
高滲再生培養基[3-4]:半固體固體MRS培養基(不含Tween80)中添加2.5%的明膠,濃度為20 mmol/L的MgCl2,濃度為0.5 mol/L的蔗糖,質量分數為0.5%小牛血清。
聚乙二醇(PEG)6000:用原生質體穩定液(PB)配制成35%的溶液,115℃滅菌20 min。
1.2.2 菌種活化
取菌種LN1#按質量分數3%接種于脫脂乳培養基中,42℃恒溫培養12 h。多次傳代直至達到要求的活力。
1.2.3 生長曲線的測定
對菌種進行單因素實驗,分別測定其最適生長溫度、最適接種量、最適初始pH值。于最佳條件下測定菌株的生長曲線[5]。
pH值-采用pH211型酸度計;酸奶酸度采用吉爾涅爾度表示[6];乳酸菌活菌數-采用高層瓊脂法[7];OD值的測量-采用紫外可見分光光度計測定,波長600 nm。
1.2.4 原生質體制備與再生
取對數生長期菌液10 mL,離心(3 000 r/min)并以原生質體穩定液(PB)洗滌兩次,用原生質體穩定液(PB)稀釋,轉入10 cm培養皿中,加入一定質量體積的溶菌酶溶液,處理一定時間,應用裂解法和倒置顯微鏡觀察(圖2)法測定原生質體形成率。
圖2 乳酸桿菌原生質體(未染色L:10×40)
分別取4 mL熱力滅活和紫外先滅活的原生質體混合,放置5 min后離心,重懸于8 mL質量分數35%的PEG6000溶液中。37℃水浴保溫2 min,離心,洗滌2次,重懸于8 mL原生質體穩定液中。取1 mL融合液稀釋后,取0.1 mL加入到半固體高滲再生培養基中,轉入滅菌培養皿中置37℃下培養直到長出菌落。
1.2.5 原生質制備條件的確定
根據單因素實驗結果設計正交試驗表1(如表1),通過均勻實驗確定來原生質體制備的最佳條件。
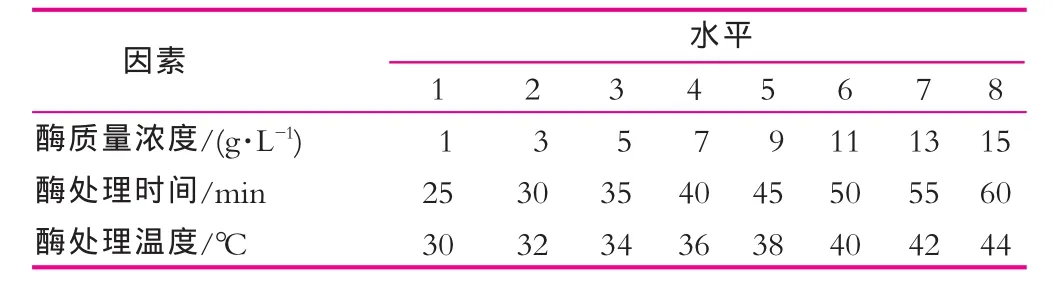
表1 原生質體制備條件均勻設計實驗水平因素
1.2.6 原生質體滅活
滅活原生質體的機理是:紫外線使菌株的DNA發生突變,熱的作用可使細胞內有功能蛋白、酶蛋白變性失活。
高溫滅活[8]:取上述制備兩菌株原生質體混合液1/3于5 mL離心管中,置于53℃水浴中保溫,不同時間取50 μL均勻分散于半固體高滲再生培養基中,37℃培養,7 d后觀察結果。
紫外線滅活[9]:另取2/3上述原生質體液于9.0 cm滅菌平板中,置15W紫外燈下,距離為30 cm并不時吸取50 μL均勻分散于半固體高滲再生培養基中,37℃培養,7 d后觀察結果。
2 結果與分析
2.1 菌株LN1#生長曲線測定
由圖1可知,菌株在37℃,3%接種量,初始pH值為6.6的條件下培養,經過一個較短的延遲期后,菌株即進入對數生長期,15 h時菌體濃度達到最高峰,之后進入穩定期,菌體OD值基本保持不變。
供誘變處理的細菌一般要求處于對數生長期,此時菌體生長狀態比較同步,容易變異,同時為了保證處理時具有一定的細胞濃度以增加可能變異的細胞總數,常選用對數生長中后期的細胞進行處理。因此,本研究選定誘變菌株培養時間為12 h。
2.2 原生質制備最佳條件的選擇
根據實驗水平,采用U8*(85)的均勻設計方案,實驗方案及結果如表2所示。
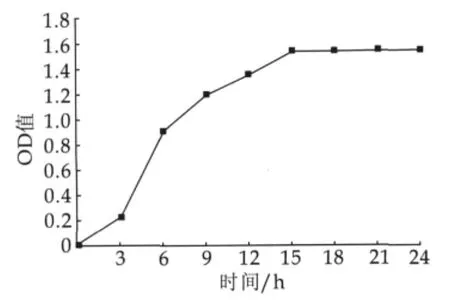
圖3 供試菌株LN1#生長曲線
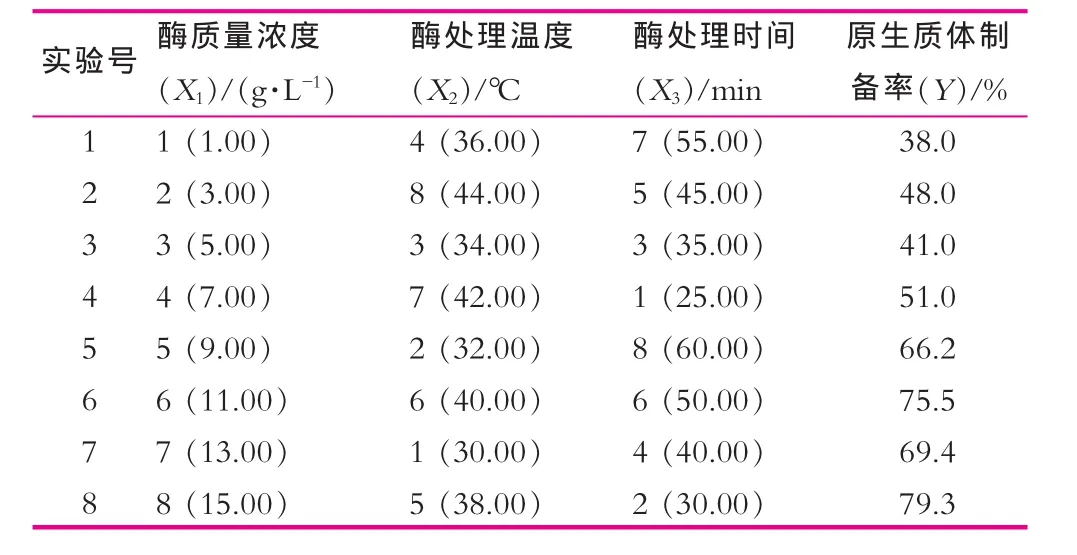
表2 均勻設計及實驗結果
利用Uniform Design Version 2.20軟件對表2實驗數據進行多元回歸分析 (回歸分析采用后退法,顯著性水平α=0.05),得到原生質體制備率與酶濃度、酶處理溫度、酶處理時間的多元一次回歸方程為
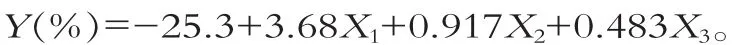
回歸方程顯著性變量分析如表3所示。

表3 回歸方程變量分析
分析各因素對回歸的貢獻率如表4所示。

表4 各因素對回歸的貢獻
方程偏回歸系數分別為B1=1.12,B2=0.280,B3=0.369,可見各因素對酶解率%的影響為:酶濃度>酶處理時間>酶處理溫度。
由回歸方程可知:X1,X2,X3的系數為正,表明試驗指標隨因素的增加而增加,所以,在確定優化方案時,各因素的取值應偏上限,即酶質量濃度取15.00 g/L,酶處理溫度取44℃;酶處理時間取60 min。將以上各值代入上述回歸方程,得到酶解率最大值為99.6%,這一結果好于表4中的9個實驗結果。對其進行驗證試驗,得到結果與計算結果相接近。因此得到原生質體制備最佳條件:酶質量濃度取15.00 g/L;酶處理溫度取44℃;酶處理時間取60 min。
菌株條件致死標記的選擇結果如表5和表6所示。

表5 UV對乳酸桿菌致死率的影響
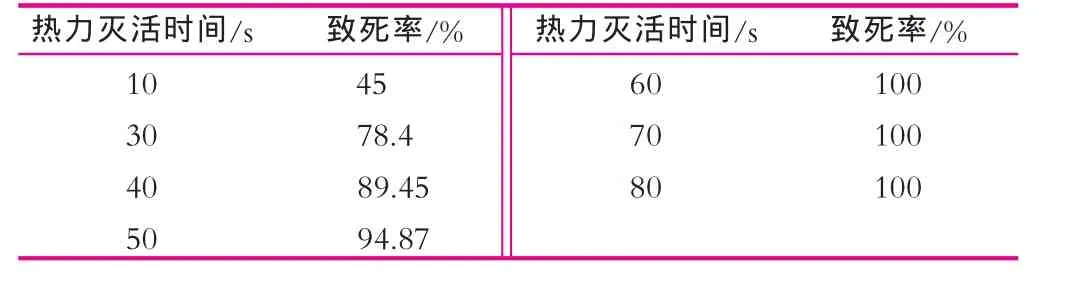
表6 溫度對乳酸桿菌致死率的影響致死率
2.3 原生質體融合效果
從原生質半固體再生培養基培養8 d后,將培養皿中長出的24個菌落用無菌牙簽挑出,分別接入接入MRS液體培養基中傳代培養。用24株菌株進行發酵產酸測定結果如圖4所示。
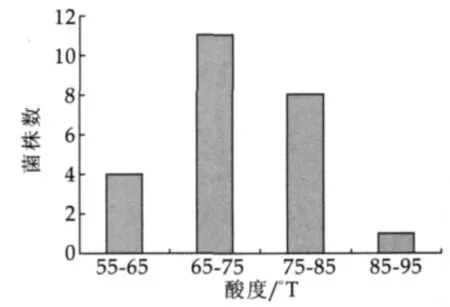
圖4 發酵6 h酸度測定結果
對發酵6 h酸度在75~85oT的8株菌株測定儲藏性能,篩選到2株儲藏性能好的菌株,目標菌株儲藏性能如圖5所示。
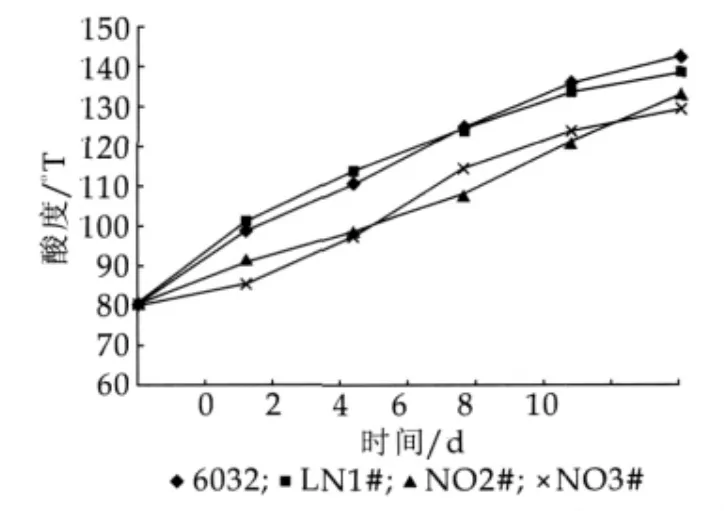
圖56032 ,LN1#,N02#,N03#發酵乳10℃期間滴定酸度變化
酸奶的正常酸度為80.00oT,根據實際生產和銷售以及消費者的接受程度,本研究以120.00oT作為后酸化的指標值。
由圖5可以看出,發酵脫脂乳在10℃貯藏時,隨貯藏時間的增加滴定酸度值都逐漸升高。試驗中菌株6032與LN1#到第5天時已經發生后酸化(滴定酸度>120oT),而菌株N02#與N03#在貯藏的第8天和第7天時發生后酸化。菌株N02#較LN1#的發酵脫脂乳在貯藏時間上延長了3 d,菌株N03#較LN1#的發酵脫脂乳在貯藏時間上延長了2 d。發酵結束后,由于發酵乳溫度由37℃未能立刻降到10℃,所以在儲藏第2 d時滴定酸度較儲藏初始時刻有較大升高,儲藏3 d后發酵乳溫度達到10℃,滴定酸度升高趨勢減慢,當發酵乳發生后酸化后由于自身產酸抑制乳酸菌的增殖,所以滴定酸度增長幅度較慢。
3 結 論
(1)對LN1#進行原生質融合,得到最佳參數:溶菌酶質量濃度為15.00 g/L,酶解細胞壁的時間為60 min,酶解溫度為44℃。
(2)得到目標菌株N02#與N03#,兩株菌在37℃培養時產乳酸量與出發菌株一樣,而在10℃貯藏時,產乳酸量明顯減少。
(3)用N02#與N03#發酵酸奶,測定酸奶在儲藏期間的產酸量,結果表明,菌株N02#發酵脫脂乳產生后酸化的時間較LN1#延長了3 d,菌株N03#發酵脫脂乳較LN1#在貯藏時間上延長了2 d,有效地控制了酸奶后酸化。
[1]OBERMAN H.Fermengted Milks[J].Micrs ferm foods,1985(1):167-195.
[2]LEE-WICKNER L J,CHASSY B M.Production and Regeneration of Lacto2 Bacill Us Caseiprotoplasts[J].Appl Environ Microbiol,1984,48(5):9942-10001.
[3]LYANG J,LEE WICKNEP,BRUCE M C.Production and Regeneration of Lactobacillus casei Protoplasts[J].Appl Environ Microbiol,1984,48:994-1000.
[4]YEEH Y,JO Y B,KWON O C.Protoplast Fusion between Lactobacillus casei and Lactobacillus acidophilus[J].Biotech Lett,1996,18:805-808.
[5]祖若夫,胡寶龍.微生物學實驗教程[M].上海:復旦大學出版社,1993:111-114.
[6]ADRIANUS J,ENGELEN,PETER H G,et al.Determination of Neutral Lactase Activity in Industrial Enzyme Preparations by a Colorimetric Enzymatic Method Collaborative Study[J].Joumal of AOAC International,1999,82(l):112-118.
[7]馬向前,周德慶.雙歧桿菌和乳酸菌的一種簡便快速計數法[J].微生物學報,1997,37(1):62-64.
[8]HOPWOOD D A,WRIGHT H M.Factors Affecting Recombinant Frequency in Protoplast Fusion of Streptomyces Coelicolor[J].J Gen Microbiol,1979,111:137-143.
[9]周東坡,張寶國.通過滅活原生質體融合選育啤酒酵母新菌株[J].微生物學報,1999,39(5):454-460.
Screening of the weak postacidification lactobacillus strains using protolast fusion technology
LUO Hong-xia1,CHEN Zhi-gang2,HUANG Yan-fang1,WANG Fang1,LI Chun-ping1,ZHAO Gang1
(1.Food&Bioengineering Department,Beijing Vocational College of Agriculture,Beijing 102442,China;
2.College of Food Science,Xinjiang Agriucltural Univisity,Urumqi 830052,China)
Protolast fusion technology was used in Lactobacillus bulgaricus LN1#from Xingjiang to obtain the weak postacidification strains.Optimum preparation condition for protolast of L.bulgaricus LN1#was achieved using uniform design experiment,being cytoderm was zymohydrolysed with lysozyme concentration of 15.00 mg/mL at 44℃for 60 min.The following 100%inactivation condition for protolast was attained with ultraviolet radiation for 120 s or high-temperature sterilizing at 53℃for 60 min.Penicillin was used to screen the weak postacidification strains.L.bulgaricus NO2#and NO3#were elected as target strain,which have the same lactic acid production capacity with LN1#at 37℃,but less lactic acid production than at LN1#10℃.
Lactobacillus;Protoplast fusion;weak postacidification.
Q93-335
A
1001-2230(2010)01-0008-04
2009-07-16
北京市教委科技支撐項目(KM200800005001)。
羅紅霞(1962-),女,教授,研究方向為畜產食品科學。

