電刺激小腦頂核對成年大鼠局灶腦缺血再灌注后腦內神經營養因子bFGF mRNA的影響
黃艷君 張中念 羅 勇
1)四川綿陽市第三人民醫院神經內科 綿陽 621000 2)重慶醫科大學附屬第一醫院神經內科 重慶 400016 3)重慶市神經病學重點實驗室 重慶 400016
腦血管病以其高發病率和高致殘率成為當前嚴重威脅人類健康的一類重要疾病,其中尤以缺血性腦血管病最為常見。研究表明電刺激小腦頂核(fastigial nucleus stimulation,FNS)可產生較為廣泛的神經保護作用。神經營養因子與中樞神經系統的恢復密切相關,對神經再生、神經元遷移、軸突的發芽、延長和成束以及神經環路的正確形成起著重要作用。本文觀察了局灶腦缺血再灌注大鼠腦內側腦室和海馬堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)mRNA的動態變化以及FNS后的影響,以初步探討FNS對受損腦組織功能重建的作用。
1 材料和方法
1.1 材料 選取健康雄性的Wistar大鼠180只,清潔級,8周齡,體質量250~300g,由重慶醫科大學實驗動物中心提供。大鼠術前12h禁食不禁水。主要試劑與儀器:針對大鼠bFGF靶基因的 mRNA序列的寡核甘酸探針:(1)5’-GGCTT CTTCC TGCGC ATCCA CCCCG ACGGC-3’;(2)5’-AGCAG AAGAG AGAGG AGTTG TGTCT ATCAA-3’;(3)5’-TGGAA TCTAA TAACT ACAAT ACTTA CCGGT-3’(探針由武漢博士德生物技術有限公司設計合成并用地高辛標記)。原位雜交試劑盒和原位雜交專用蓋玻片(武 漢 博 士 德);DEPC 和 Poly-L-Lysine (Sigma(USA));DAB顯色劑(北京中山);立體定位儀,SEN 3301型方波脈沖電子刺激器(日本光電公司);電動恒流泵(上海精科實業有限公司)。
1.2 方法 大鼠大腦中動脈局灶腦缺血再灌注模型制備:根據Longa等[1]報道的方法,參照羅勇等[2]的經驗,采用線栓法規范化制備右側大腦中動脈局灶腦缺血再灌注模型。模型成功標準:左側肢體疼痛回縮遲鈍或消失,提尾倒懸時左上肢向胸前屈曲,行走時向左側傾倒或向左轉圈;右側出現霍納(Honer’s)氏征。排除標準:神經學癥狀評分低于2分者,蛛網膜下腔出血者,HE染色無缺血病理改變者,未到觀察時相點便死亡者。凡因上述因素導致各實驗組動物數不足預定數量者采用隨機抽樣原則補齊。
分組及干預:雄性 Wistar大鼠隨機分為正常組(NC組)、假手術組(SC組)、模型組(I/R組)、小腦頂核假刺激組(I/RFs組)、小腦頂核刺激組(I/RF組),每組根據再灌注時間的不同又分為1d,3d,7d,14d,21d,28d6個時間點進行觀察(n=6)。均于缺血1h后行再灌注,并于再灌注后立即刺激左側小腦頂核1h。I/RF組大鼠給予電刺激小腦頂核:大鼠用3.5%水合氯醛腹腔注射(1mL/100g)麻醉,固定于立體定向儀上,參照Nakai[3]的方法,根據 Wistar大鼠腦立體定向圖譜,結合鼠的大小確定左側小腦頂核位置,將同心圓電極插入左側小腦頂核(病灶對側)進行刺激。I/RFs組操作同I/RF組,電極插入小腦頂核但不通電流刺激,只留針1h。
1.2.1 神經功能評分:參照Zea Longa 5分制評分標準[1],大鼠清醒后評分。所有動物于腦缺血再灌注后1h,6h,12 h,1d,3d,7d進行評定。固定、取材、切片:于腦缺血再灌注后1d,3d,7d,14d,21d,28d,經左心室常規灌注固定,開顱取腦,由前向后作冠狀切片,取經側腦室(包含室管膜下區)及海馬中心腦組織塊各1塊,行固定、脫水、浸蠟、包埋、石蠟切片(片厚4μm)。取材部位:側腦室(AP前囟-0.30至前囟-1.2mm),海馬(AP前囟-3.14至前囟-4.5mm)。
1.2.2 原位雜交檢測側腦室和海馬bFGF mRNA表達:按試劑盒說明進行。陰性對照用預雜交液代替雜交液,用正常羊血清代替地高辛抗體,其余步驟相同。1.2.3 圖像分析及統計學處理:切片在統一放大倍數(×200)下,隨機選擇10個非重疊視野,每只動物的每個部位隨機取5張非連續切片,應用重慶醫科大學電鏡室北航CM-2000B型生物醫學圖像分析系統,檢測陽性細胞的平均光密度值。
2 結果
2.1 側腦室區域 NC組側腦室室管膜及室管膜下區可見少量bFGF mRNA的陽性表達。局灶腦缺血/再灌注后1d,I/R組缺血側側腦室區域bFGF mRNA表達略有增加(P<0.05),3d時達一小高峰(P<0.01),且外側壁陽性細胞較內側壁多,在背外側有一些陽性細胞聚集,沿胼胝體下緣向缺血區方向延伸,由內向外細胞數逐漸減少,7d開始下降(P<0.01),28d時下降到略高于正常水平(P<0.05),I/RFS組與I/R組變化相似,比較差異無統計學意義(P>0.05)。局灶腦缺血/再灌注后再給予FNS,I/RF組1d時bFGF mRNA即明顯增加(P<0.01),3d時增加更明顯(P<0.01),7 d才達到高峰(P<0.01),且在外側壁,陽性細胞聚集形成長尾狀陽性細胞鏈,沿胼胝體下緣向缺血區方向延伸,而且由內向外細胞數逐漸減少,14d后緩慢下降,與I/R組和I/RFS組相比,差異有統計學意義(P<0.05)(表1)。
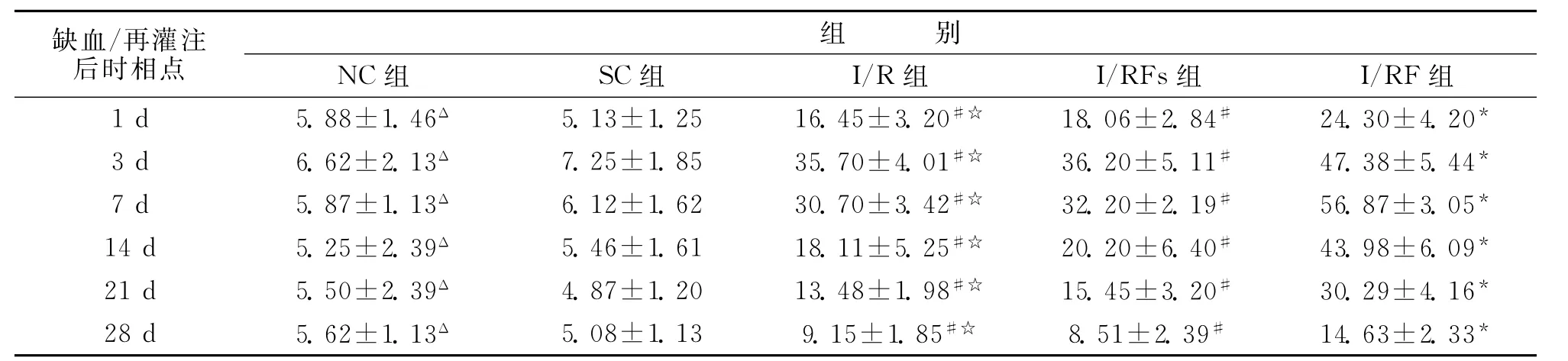
表1 各實驗組側腦室區bFGF mRNA的表達水平(光密度)
2.2 海馬區域 正常海馬區可見少量bFGF mRNA的陽性表達,主要位于海馬錐體細胞層、CA1、CA2區。局灶腦缺血/再灌注后,I/R組缺血側海馬可見bFGF mRNA的強陽性表達,1d時開始增加(P<0.05),3d即達一小高峰(P<0.01),7d開始下降,21d時明顯下降,28d時降到正常水平(P<0.05),與NC組和SC組對應時間點比較,差異有顯著性(P<0.05),I/RFS組與I/R組變化相似,比較無差異(P>0.05)。局灶腦缺血/再灌注后再給予FNS,缺血側海馬bFGFmRNA的表達更加強烈,1d時明顯增加(P<0.01),3 d后bFGFmRNA繼續升高(P<0.01),到7d時才達高峰(P<0.01),峰值更高,14d時緩慢下降(P<0.01)。I/RF組與I/R組和I/RFS組相比,bFGF mRNA的表達在各對應時相點都有增加,差異有顯著性(P<0.05)(表2)。
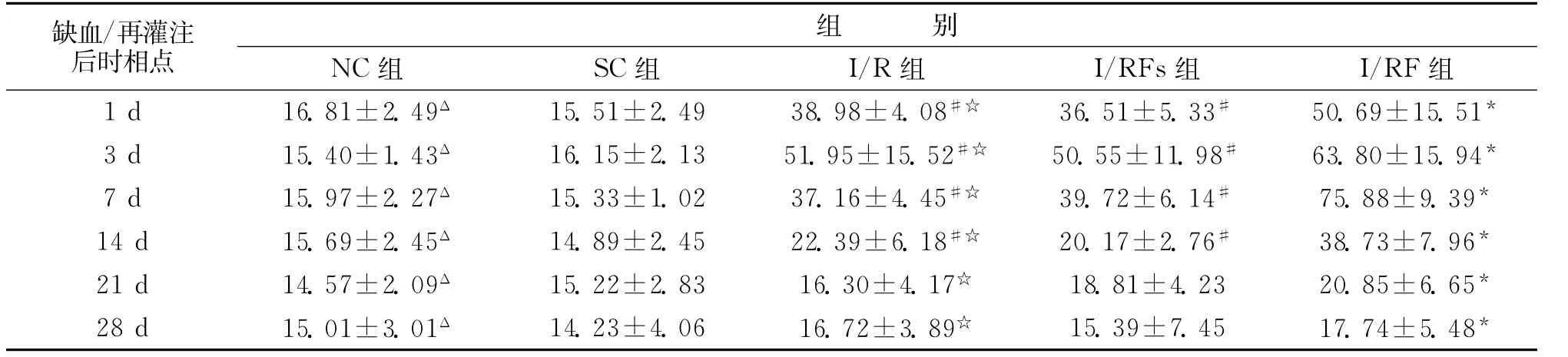
表2 各實驗組海馬區bFGF mRNA的表達水平(光密度)
3 討論
神經營養因子是神經系統重要的生物活性因子,對神經系統的正常分化、發育、成熟、維持功能和存活、損傷修復等均具有重要的生物學作用。bFGF是FGF基因家族中主要成員之一。它是一種具有強烈促增殖效應的多肽因子,也是內皮細胞的有絲分裂原和血管再生因子,在神經系統的分化、發育和成熟過程中具有重要作用[4-5]。
正常情況下,腦內僅有少量bFGF表達,當腦受到各種損害時,即可誘導bFGF表達增加。近年來腦缺血再灌注動物模型研究表明,腦缺血再灌注可引起內源性bFGF mRNA表達增加,并對神經細胞具有保護、修復作用和抗細胞凋亡作用。本實驗觀察到,正常側腦室室管膜及室管膜下、海馬錐體細胞層、CA1、CA2區可見少量bFGF mRNA的陽性表達,局灶腦缺血/再灌注后1d,I/R組缺血側側腦室區域bFGF mRNA表達略有增加,3d時達一小高峰,且外側壁陽性細胞較內側壁多,在背外側有一些陽性細胞聚集,沿胼胝體下緣向缺血區方向延伸,由內向外細胞數逐漸減少,7d開始下降;在海馬區域,局灶腦缺血/再灌注后,I/R組缺血側海馬可見bFGF mRNA的強陽性表達,1d時開始增加,3d即達一小高峰,7d開始下降。國外研究顯示,缺血6h后即出現bFGF基因表達增高,于24h達到最高峰,1周左右降至對照組水平,2周后又呈現逐漸升高趨勢。與我們的結果不完全一致,可能與動物種類、動物模型等的不同選擇有關[6-7]。Hsu[8]等指出,腦缺血可能通過刺激即早基因,如cfos、c-jun等基因表達,進而從轉錄水平上誘導包括 NGF、BDNF在內的神經營養因子等晚期效應器基因表達。
近年來研究發現,FNS可產生較為廣泛、持久的神經保護作用。FNS后大腦皮質局部腦血流的增加可達對照組的300%,而不伴腦組織糖代謝率的改變[9];預先FNS 1h,可使腦梗死體積縮小約50%,產生的腦保護作用可持續10d以上;其縮小腦梗死體積的效果是特異性的,刺激其他腦區則不能減輕腦缺血損害[10]。本實驗觀察到局灶腦缺血/再灌注后再給予FNS,I/RF組1d時bFGF mRNA即明顯增加,3d時增加更明顯,7d才達到高峰,且在外側壁,陽性細胞聚集形成長尾狀陽性細胞鏈,沿胼胝體下緣向缺血區方向延伸,而且由內向外細胞數逐漸減少;而在缺血側海馬,局灶腦缺血/再灌注后再給予FNS,bFGFmRNA的表達更加強烈,到7d時才達高峰,峰值更高,14d時緩慢下降。I/RF組與I/R組和I/RFS組相比,bFGF mRNA的表達在各對應時相點都有增加,提示FNS后側腦室和海馬bFGFmRNA的反應強烈。研究發現,FNS1h可抑制線粒體釋放細胞色素C,減輕Ca2+超載,可促進同側梗塞皮質表達解偶聯蛋白UCP4及 UCP4mRNA,從而維持缺血后線粒體的功能[11-14]。國內基礎研究發現,FNS可促進腦缺血后毛細血管新生和神經組織的結構重建;增加腦血供[15-16]。bFGF是一種具有多種生物活性的神經營養因子,其與相關聯的受體結合導致廣泛的細胞反應,包括細胞增殖和分化、血管形成和抑制凋亡等[17]。研究表明,腦缺血后神經營養因子可在一定時間內表達上調,而神經營養因子又是神經干細胞增殖、遷移、分化、網絡化的重要因素。FNS可能通過以上途徑抑制了腦缺血過程中神經細胞凋亡,有利于細胞存活,改善了神經功能,但其確切的分子機制有待進一步研究。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]Luo Yong,Dong Weiwei.An experimental study on focal cerebral ischemia/reperfusion model in Wistar rats with suture method[J].Journal of Chongqing Medical University,2002,27(1):1-4.
[3]Nakai M,Iadecola C,Ruggiero DA,et al.Electrical stimulation of cerebellar fastigial nucleus increases cerebral cortical blood flow without change in local metabolism:evidence for an intrinsic system in brain for primary vasodi-lation[J].Brain Res,1983,260(1):35-49.
[4]Eckenstein FP.Fibroblast growth factors in the nervous sys-tem[J].J Neurobiol,1994,25(11):1 467-1 480.
[5]Powell PP,Finklestein SP,Dionne CA,et al.Temporal,differential and regional expression of mRNA for basic fibroblast growth factor in the developing and adult rat brain[J].Brain Res Mol Brain Res,1991,11(1):71-77.
[6]Speliotes EK,Caday CG,Do T,et al.Increased expression of basic fibroblast growth factor(bFGF)following focal cerebral infarction in the rat[J].Brain Res Mol Brain Res,1996,39(1/2):31-42.
[7]Endoh M,Pulsinelli WA,Wagner JA.Transient global ischemia induces dynamic changes in the expression of bFGF and the FGF receptor[J].Brain Res Mol Brain Res,1994,22(1/4):76-88.
[8]Hsu CY,An G,Liu JS,et al.expression of immediate early gene and growth factor mRNAs in a focal cerebral ischemic modal in the rat[J].Stroke,1993,24(SuppleⅠ):78.
[9]Reis DJ,Berger SB,Underwood MD,et al.Electrical stimulation of cerebellar fastigial nucleus reduces ischemic infarction elicited by middle cerebral artery occlusion in rat[J].J Cereb Blood Flow Metab,1991,11(5):810-818.
[10]Reis DG,Golanov EV,Galea E,et al.Central neurogenic neuroprotection:central neural systems that protect the brain from hypoxia and ischemia[J].Ann NY Acad Sci,1997,835(1):168-186.
[11]Golanov EV,Liu F,Reis DJ.Stimulation of cerebellum protects hippocampal neurons from global ischemia[J].Neuroreport,1998,9(5):819-824.
[12]Zhou P,Qian L,Glickstein SB,et al.Electrical stimulation of cerebellar fastigial nucleus protects rat brain,in vitro,from staurosporine-induced apoptosis[J].J Neurochem,2001,79(2):328-338.
[13]Zhou P,Qian L,Zhou T,et al.Mitochondria are involved in the neurogenic neuroprotection conferred by stimulation of cerebellar fastigial nucleus[J].J Neurochem,2005,95(1):221-229.
[14]Shant J,Shiflett JM,Chen B,et al.Neuroprotective stimulation of the cerebellar fastigial nucleus modifies expression of uncoupling protein 4[J].Stroke,2005,36(2):433-434.
[15]石正洪,董為偉 .電刺激小腦頂核促腦缺血后毛細血管新生的實驗研究[J].中風與神經疾病雜志,2003,20(3):250-252.
[16]代瑞廷,曹艷霞,張杏紅,等 .電刺激小腦頂核對急性腦梗死患者血漿CGRP的影響[J].中風與神經疾病雜志,2002,19(5):293-293.
[17]Jin-qiao S,Bin S,Wen-hao Z.Basic fibroblast growth factor stimulates the proliferation and differentiation of neural stem cells in neonatal rats after ischemic brain injury[J].Brain Dev,2009,31(5):331-340.

