克羅卡林對急性腦缺血再灌注大鼠的腦保護作用
馮 濤 婁季宇 白宏英 楊霄鵬 曾志磊 王金蘭
鄭州大學第二附屬醫院神經內科 鄭州 450014
腦缺血再灌注后損傷是引起缺血性腦血管病(ischemic cerebrovascular disease,ICVD)腦功能損害的重要原因。已知很多因素參與再灌注后損傷的過程,其中炎癥反應促進了繼發性腦損傷。小膠質細胞(microglia,MG)是腦內的主要免疫效應細胞,生理狀況下它對維持腦內環境穩態起重要作用,當腦內發生病理損害時迅速激活產生大量神經毒性因子,加速神經元的死亡。K-ATP通道開放劑Cromakalin以細胞內的ATP/ADP水平為門控因素、非電壓依賴性的特殊鉀離子通道,廣泛存在中樞神經系統內。它的激活是機體缺血缺氧狀態下的自我保護機制,可以對抗損害因子對機體的傷害,若早期用開放劑打開這類通道,可以減輕腦缺血缺氧對神經元的損害。
本研究旨在利用大鼠MCAO模型,觀察大鼠急性腦缺血再灌注后海馬區CA1區OX42、iNOS的表達情況,神經元特異性尼氏染色法檢測神經元數目及Cromakalin干預后的變化,為K-ATP通道開放劑盡早應用于臨床治療ICVD提供理論依據。
1 材料與方法
1.1 材料、試劑及儀器SD大鼠由鄭州大學實驗動物中心提供。圖像采集:德國Lecia顯微照像系統。Cromakalin,Sigma美國。分析系統:上海山富科學儀器有限公司,Biosens Digital Imaging。System v1.6。OX42、iNOS抗體:北京中杉生物工程公司。
1.2 方法
1.2.1 動物分組:72只雄性SD大鼠,體質量(220±30)g隨機分為3組:A組為假手術組,B組為單純缺血再灌注組,C組為克羅卡林干預組,每組24只分6h、24h、72h、7d時間點,每個時間點各6只。
1.2.2 動物模型制備:應用改良Zea Longa線栓法制備大鼠MCAO模型。大鼠蘇醒后參照Zea Longa 5分制標準[1]進行神經行為學評分,1~3分動物入選。
1.2.3 動物處理:C組在MCAO后2h給予Cromakalin 0.4mg/(kg·d),2mL腹腔注射,B組在MCAO后2 h給予生理鹽水2 m L腹腔注射,A組除了不插入線栓其他同B組。達各時間點后,用10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,用生理鹽水和4%多聚甲醛進行心臟灌注固定,取腦,制作腦部冠狀石蠟切片(厚度4μm)。采用免疫組化染色(SP法),檢測CA1區OX42、iNOS的表達情況。各組取7d時間點進行海馬CA1區神經元尼氏染色,每組取6張切片,在400倍視野下計數神經元。
1.3 統計學方法實驗的數據采用均數±標準差(±s)表示,應用SPSS10.0統計軟件對實驗數據進行統計分析,多組均數間的比較采用單因素方差分析(one-way,ANOVA),均數間的兩兩比較采用LSD檢驗,以α=0.05作為顯著性檢驗水準。
2 結果
2.1 海馬CA1區OX42的表達情況A組、B組、C組各時間點海馬CA1區OX42均有表達,A組4個時間點OX42變化不明顯,B、C兩組OX426h開始表達,24 h明顯增多,72h達高峰,7d仍有表達,明顯高于A組各時間點(P<0.05),C組時間點表達均少于B組(P<0.05)。結果見表1。
表1 各時間點海馬CA1區OX-42的平均積分光密度的變化±s)
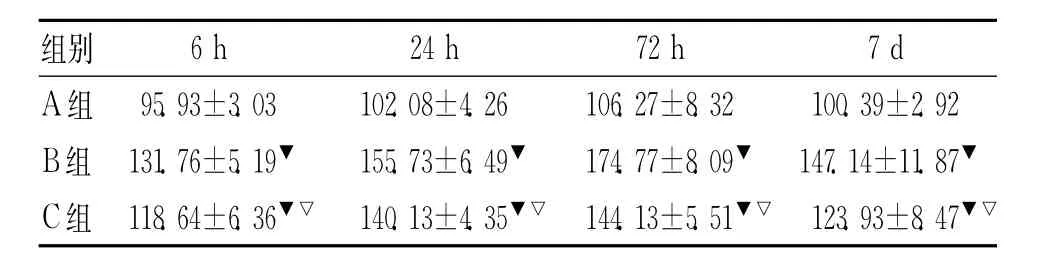
表1 各時間點海馬CA1區OX-42的平均積分光密度的變化±s)
注:▼與 A組相比,P<0.01;▽與B組相比,P<0.01
組別6 h 24 h 72 h 7 d A組 95.93±3.03 102.08±4.26 106.27±8.32 100.39±2.92 B組 131.76±5.19▼ 155.73±6.49▼ 174.77±8.09▼147.14±11.87▼C組 118.64±6.36▼▽140.13±4.35▼▽144.13±5.51▼▽123.93±8.47▼▽
2.2 海馬CA1區iNOS表達情況A組、B組、C組各時間點海馬CA1區iNOS均有表達,A組4個時間點iNOS變化不明顯,B、C兩組6 h開始表達,24 h明顯增多。72 h達高峰,7 d仍有表達,明顯高于A組各時間點(P<0.05)。C組各時間點表達均少于B組(P<0.05)。結果見表2。
表2 各時間點海馬CA1區iNOS的平均積分光密度的變化±s)

表2 各時間點海馬CA1區iNOS的平均積分光密度的變化±s)
注:▼與A組相比,P<0.01;▽與B組相比,P<0.01
組別6 h 24 h 72 h 7 d A組 93.52±4.16 100.24±6.84 103.38±4.88 98.50±3.72 B組 127.47±3.77▼ 161.97±8.29▼170.86±10.21▼ 146.66±5.97▼C組 115.05±8.27▼▽133.64±7.59▼▽142.43±4.82▼▽121.60±5.97▼▽
2.3 海馬CA1區神經元變化情況A組神經元(60.66±6.62)個,B組神經元(11.50±3.08)個,即在大鼠缺血再灌注7d時,海馬CA1區神經元的死亡數目是原有數目的81.1%,存活數目是原有數目的18.9%。C組神經元(29.33±4.88)個,即在大鼠缺血再灌注7d時,海馬CA1區神經元存活數目是原有數目的48.4%,即保護了29.5%的神經元免于死亡。三組之間差異有明顯統計學意義(P<0.05),結果見表3。
表3 神經元尼氏染色±s,個/400倍視野)

表3 神經元尼氏染色±s,個/400倍視野)
注:▼與A組相比,P<0.01;▽與B組比,P<0.01
組別 n 神經元數目A組6 60.66±6.62 B組 6 11.50±3.08▼C組 6 29.33±4.88▼▽
3 討論
近些年來隨著影像學在神經科的廣泛應用,特別是頭顱MRI及DWI在臨床的廣泛應用,急性腦梗死后2h內即可在影像學上發現缺血病灶,為臨床上早期溶栓治療提供了可靠的依據,腦缺血再灌注損傷也是不能避免[2]。再灌注損傷涉及到多個病理生理環節,其中炎癥反應促進了繼發性腦損,是缺血再灌注損傷的重要原因之一。在哺乳動物中,海馬CA1區神經元是腦部缺血容易損傷的區域之一,所以海馬CA1是研究者經常選擇觀測腦部病理變化的區域之一。
MG在顱內分布比較廣泛,是顱內的主要免疫效應細胞,大約占膠質細胞的5%~20%[3]。在生理狀態下對神經元有營養、支持、保護等重要作用,對顱內環境有免疫監視和宿主防御的作用。同時MG對顱內的內環境改變及其敏感,特別是感染和創傷時迅速被激活,形態上由靜息時的分支狀到活化的阿米巴樣,細胞胞體增大,并產生大量的神經毒性因子,對神經元產生毒性作用,加重對腦部的損害。因此抑制MG的過度激活,具有腦保護作用。另激活的MG是iNOS的主要來源。iNOS是人體內一種重要的合酶,在生理條件下并不表達,只在病理情況下如腦缺血再灌注損傷時,iNOS可以出現在炎性細胞、神經元、神經膠質細胞及微血管內皮細胞中,一旦誘導合成,就持續大量產生一氧化氮(NO)。NO是一種化學性質活潑的自由基,兼有細胞毒性作用,過量持續的表達是腦缺血再灌注損傷的一個重要因素,因此iNOS是腦缺血再灌注損傷產生過量NO的基礎。
K-ATP通道是1983年Noma[4]首先發現存在于豚鼠心肌細胞膜上,現已經證明它也廣泛存在中樞神經系統中,同樣也存在小膠質細胞上。在正常生理狀態下腦內的K-ATP通道處于關閉狀態,當機體出現缺血缺氧、炎癥反應等時,KATP通道開放,鉀離子大量外流,細胞出現超極化狀態,神經元的興奮性降低,調節鈣離子的平衡,穩定線粒體膜電位,抑制凋亡等,是機體的一種重要自我保護機制。本實驗觀察應用K-ATP通道開放劑Cromakalin干預大鼠腦缺血再灌注后不同時間點OX42、iNOS表達的變化,發現應用Cromakalin干預后,OX42、iNOS的表達明顯低于腦缺血再灌注組,海馬CA1區神經元存活數目Cromakalin干預組明顯多于非干預組。說明K-ATP通道開放劑Cromakalin可通過抑制小膠質細胞的過度激活、iNOS的過度表達,保護腦缺血大鼠海馬CA1區神經元遲發性死亡等方面保護神經元,從而起到腦保護的作用。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(l):84-91.
[2]李建章,主編.神經科醫師手冊[M].北京:人民衛生出版社,2010:161-183.
[3]彭玲梅,黃泳.小膠質細胞在阿爾茨海默病炎性反應中的雙重作用[J].醫學綜述,2009,15(19):2 889-2 890.
[4]Noma A.ATP-regulated K+channels in cardiac muscle[J].Natuer,1983,305(5930):147-148.

