鰻弧菌W-1金屬蛋白酶基因真核表達載體的構建及其在動物細胞中的表達
鰻弧菌(Vibrioanguillarum)是危害魚類的主要的條件性病原菌之一,在世界各地流行,也是我國海水養殖魚類的重要病原菌,給水產養殖業造成了較大的危害[1,2]。鰻弧菌的致病性與許多毒力因子有關,除了由65 kb質粒pJM1編碼的鐵吸收系統[3,4]、細胞外溶血毒素[5,6]、脂多糖[7]、細菌鞭毛蛋白[8,9]等毒力因子外,胞外蛋白酶也被認為是鰻弧菌與其它許多細菌病原的毒力因子[10~16]。Milton等[14]首先從鰻弧菌 NB10中克隆了金屬蛋白酶基因,編碼 611個氨基酸殘基組成的多肽鏈,完整蛋白的分子量為 66.7 kDa。
陳吉祥等[15]從山東沿海養魚場發病魚分離的致病性鰻弧菌 W-1的胞外產物中分離純化了一種金屬蛋白酶,并在原核細胞中克隆、表達了該酶的基因——empA基因[17],同時對其活性中心的氨基酸殘基進行了定點突變[18]。序列分析結果發現,其序列同源性較高,活性位點氨基酸序列與其它病原弧菌有較大的相似度,不同血清型的鰻弧菌其活性中心的氨基酸殘基相同;活性實驗結果表明,突變的金屬蛋白酶喪失其蛋白水解活性和細胞毒性,但仍具有較強的免疫原性,因此是一個頗具潛力的鰻弧菌疫苗候選抗原蛋白。
作者在此利用分子生物學技術將突變的鰻弧菌W-1金屬蛋白酶基因m-empA7克隆入真核表達載體中,使其在真核細胞中得到表達,為進一步研究該疫苗在動物實驗中的免疫效果以及研制鰻弧菌金屬蛋白酶基因疫苗奠定基礎。
1 實驗
1.1 材料
質粒pET24d(+)/m-empA7、兔抗鰻弧菌W-1金屬蛋白酶抗體,自制;pCDNA3.1(+)、Trizol Reagent,Invitrogen公司;大腸桿菌JM109、真核細胞系CHO和HEK293T,中國海洋大學海洋生命學院;ExTaq DNA聚合酶、T4 DNA連接酶、dNTP、IPTG、各種限制性內切酶、Wide Range DNA Ladder Marker、DNA凝膠回收純化試劑盒,大連寶生物工程有限公司;辣根過氧化物酶標記的山羊抗兔IgG,武漢博士德公司;除內毒素質粒小量提取試劑盒,北京天根生物工程有限公司;磷酸鈣法質粒轉染試劑盒,碧云天生物工程有限公司;逆轉錄試劑盒,Promega公司;MEM、DMEM細胞培養基、D-Hank′s平衡液、胎牛血清和胰蛋白酶,Gibco公司;其它試劑均為國產生化試劑或分析純試劑。
1.2 方法
1.2.1 重組真核表達載體的構建及鑒定
根據已突變的鰻弧菌W-1金屬蛋白酶基因m-empA7的堿基序列[18]及真核表達載體pCDNA3.1(+)多克隆位點的序列,設計一對特異性引物(VP61:5′-CGGGATCCATGAAAAAAGTACAACGTCAA-ATG-3′,VP62:5′-CCGCTCGAGTTAATCCAGTC-TTAACGTTACACC-3′)。以pET24d(+)/m-empA7突變質粒為模板,以VP61和VP62為引物,PCR擴增得到5′和3′端分別帶有BamHI和XhoI酶切位點的突變的金屬蛋白酶基因m-empA7。PCR產物和真核表達載體pCDNA3.1(+)分別用XhoI和BamHI雙酶切,回收純化后加T4 DNA連接酶于16℃連接16 h,氯化鈣法轉化E.coliJM109,挑取Amp抗性的單菌落鑒定,篩選陽性克隆,得到的重組真核表達質粒命名為pCDNA3.1(+)/m-empA7。酶切、連接、轉化以及陽性重組子的篩選和鑒定均按《分子克隆實驗指南》進行。
1.2.2 真核細胞轉染
除內毒素質粒DNA的提取方法按照Promega公司的除內毒素質粒提取試劑盒說明書進行,用紫外分光光度計法測定質粒DNA濃度和純度。細胞轉染的方法按照碧云天生物工程有限公司的磷酸鈣法細胞轉染試劑盒說明書進行。轉染前24 h,通過胰酶消化收集細胞,用完全培養基(含抗生素)將細胞平鋪于6孔板上,于含5% CO2的37℃培養箱中孵育20~24 h(細胞匯合度在70%~80%為宜)。轉染前30 min,吸去細胞培養液,加入2 mL新鮮的不含抗生素的完全培養基。取2 μg待轉染的質粒,加入到100 μL CaCl2溶液中,混勻。均勻滴加DNA-CaCl2-BBS的混合物到整個6孔板內,輕輕旋轉以混勻。在含3%CO2的37℃培養箱中培養24 h。然后輕輕晃動培養板數次以充分懸浮一些磷酸鈣沉淀。吸去含磷酸鈣沉淀的培養液,加入2 mL新鮮的完全培養基繼續培養。在轉染約36 h后檢測轉染基因的表達。
1.2.3 RT-PCR檢測轉染細胞中m-empA7基因的轉錄
細胞轉染36 h后收集細胞,按Trizol Reagent說明書提取細胞中總RNA,用逆轉錄試劑盒以提取的RNA為模板,反轉錄合成cDNA第一鏈。根據突變的金屬蛋白酶基因m-empA7的序列,在Genbank中進行序列同源比對,選擇保守區段的第1485~1731核苷酸序列,設計一對特異性引物(VP51:5′-CCTTTAACCAAGTGGGCGTA-3′,VP52:5′-CGATTTGTAAGGGCGACAAT-3′),擴增目標產物為248 bp。以該引物進行反轉錄聚合酶鏈反應(Reverse transcription PCR, RT-PCR)檢測m-empA7基因的轉錄水平。PCR反應條件為:94℃預變性5 min;94℃變性1 min,52℃退火1 min,72℃延伸1 min,30個循環;72℃延伸10 min。PCR反應產物用1%瓊脂糖凝膠電泳檢測。
1.2.4 Western-blot檢測轉染細胞中m-empA7基因的表達產物
細胞轉染36 h后收獲6孔組織培養板中的細胞,分別加入上樣緩沖溶液,煮沸10 min,用10% SDS-PAGE進行電泳。然后用半干法將蛋白轉印到NC膜上,用含5%脫脂奶的PBST(含0.05% Tween20 1×PBS)4℃封閉過夜。以兔抗EmpA蛋白的多克隆抗體[17]作為一抗,以辣根過氧化物酶標記的山羊抗兔IgG作為二抗,利用DAB進行顯色,檢測轉染細胞中m-empA7基因的表達產物。
2 結果與討論
2.1 重組真核表達質粒pCDNA3.1(+)/m-empA7的構建及鑒定
突變的鰻弧菌W-1金屬蛋白酶基因m-empA7經過PCR擴增后,得到了約1.8 kb的片段(圖1),PCR產物經酶切后插入到pCDNA3.1(+)中,構建了重組真核表達質粒pCDNA3.1(+)/m-empA7,經XhoI和BamHI雙酶切后凝膠電泳,在1836 bp處有一目的條帶出現(圖2)。

M. DL2000 DNA Marker 1,2. m-empA7 Gene amplified by PCR
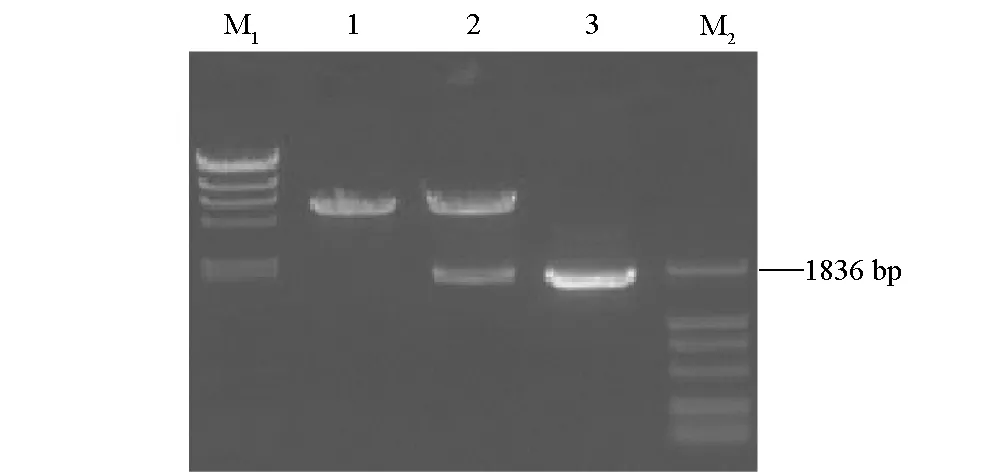
M1. λ-HindⅢ digest 1. pCDNA3.1(+) 2. pCDNA3.1(+)/m-empA7 3. m-empA7 Gene amplified by PCR M2. DL2000 DNA Marker
經酶切鑒定的陽性重組質粒由大連寶生物工程有限公司進行克隆片段的DNA序列測定,測序結果用http://www.ebi.ac.uk/clustalw/軟件與m-empA7的核酸序列進行比對,結果證實它們的序列完全一致。
2.2 轉染細胞中m-empA7基因的轉錄
采用磷酸鈣法將重組質粒pCDNA3.1(+)/m-empA7轉染至CHO和HEK293T細胞中,同時以轉染空質粒pCDNA3.1(+)的細胞作空白對照、以未轉染質粒的正常細胞作陰性對照,在細胞轉染36 h后,提取總RNA進行RT-PCR檢測,結果如圖3所示。

M. 100 bp DNA Ladder marker 1. CHO Transfected with pCDNA3.1(+) 2. CHO Untransfected 3. CHO Transfected with pCDNA3.1(+)/m-empA7 4. HEK293T Transfected with pCDNA3.1(+) 5. HEK293T Untransfected 6. HEK293T Transfected with pCDNA3.1(+)/m-empA7
由圖3可看出,在重組質粒轉染的CHO細胞和HEK293T細胞中都擴增出了一條約248 bp的小目的片斷,說明m-empA7基因的mRNA在真核細胞中得到了轉錄。而轉染空質粒pCDNA3.1(+)和未轉染質粒的對照細胞中均未擴增得到目的片斷。
2.3 轉染細胞中m-empA7基因的表達
以轉染空質粒pCDNA3.1(+)的細胞作空白對照、以未轉染質粒的正常細胞作陰性對照,在細胞轉染36 h后,收集細胞并裂解進行Western-blot檢測,結果如圖4所示。
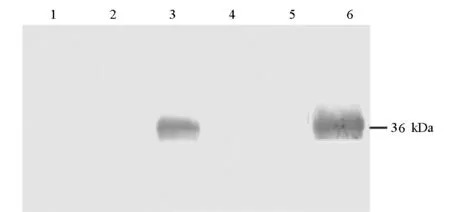
1. CHO Transfected with pCDNA3.1(+) 2.CHO Untransfected 3. CHO Transfected with pCDNA3.1(+)/m-empA7 4. HEK293T Transfected with pCDNA3.1(+) 5.HEK293T Untransfected 6. HEK293T Transfected with pCDNA3.1(+)/m-empA7
由圖4可看出,在重組質粒轉染的CHO細胞和HEK293T細胞中都檢測到了一條分子量約36 kDa的特異性免疫反應帶,比由m-empA7堿基序列推測的蛋白質分子量(66.7 kDa)小得多,這與在原核細胞中表達的情況相一致[17,18],說明目的基因能夠在細胞內正確轉錄、翻譯、表達,并可與抗EmpA蛋白的抗體特異性結合。而轉染空質粒pCDNA3.1(+)和未轉染質粒的對照細胞中未見有免疫反應帶。
2.4 討論
DNA 疫苗是編碼免疫原或與免疫原相關的真核表達質粒DNA(或RNA),它可經一定途徑進入動物體內,被動物宿主細胞攝取后轉錄和翻譯表達出抗原蛋白,此抗原蛋白能夠刺激機體產生非特異性和特異性兩種免疫應答反應,從而起到免疫保護作用。早期DNA疫苗的研究主要是以哺乳動物為模型,魚類DNA 疫苗的研究起步較晚。據統計,每年大約有10%的養殖魚類死于傳染性疾病,而大規模的爆發性疾病會引起更嚴重的損失[19]。因此,開展魚類DNA疫苗的研究是非常必要的。1991年,Hansen等[20]首先報道了外源基因能夠在鯉魚肌肉組織中表達。1996 年,Anderson等[21]第一次報告了帶有IHNV糖蛋白基因的質粒能夠在虹鱒中表達,并且能夠保護IHNV病毒對受免疫魚的感染。隨后的一些實驗也證明,在多種魚體內,外源基因不僅能夠高效、持久地表達,而且能夠引起宿主魚類對外源蛋白的免疫應答。這些為構建魚類DNA 疫苗提供了基礎。
病原菌的致病性是由一些可遺傳的毒力因子所決定,其中胞外蛋白酶被認為是許多病原菌的一個重要毒力因子[10~16]。 不同弧菌胞外蛋白酶氨基酸序列保守性很高,且都具有活性位點,通過各自不同的方式發揮作用,致使受感染動物發病或死亡,但同時這些毒素又是良好的抗原,能誘發機體產生強烈的免疫反應,因此常作為首選的疫苗抗原,在DNA疫苗中有較好的應用。
作者所在研究組從鰻弧菌W-1中分離得到高活性的蛋白酶,通過對其理化性質及末端氨基酸序列分析發現,該蛋白酶是一種金屬蛋白酶,由611個氨基酸殘基組成,完整蛋白的分子量為66.7 kDa[15]。對來源于不同養殖環境致病菌的蛋白酶基因進行克隆和序列分析發現,其序列同源性較高,通過對比發現酶的可能活性位點氨基酸序列與其它病原弧菌有較大的相似度,不同血清型的鰻弧菌其活力中心的氨基酸殘基相同,但有關酶活性位點特定氨基酸殘基在維持酶活力和對細胞的毒性作用等方面,仍缺乏深入研究。
研究組在原核細胞中克隆、表達了鰻弧菌W-1金屬蛋白酶基因empA基因,并對其活性中心的氨基酸殘基進行了定點突變。活性實驗結果表明,將empA基因活性中心的Glu347突變為Lys后,表達的突變蛋白m-EmpA7完全喪失了其蛋白水解活性和細胞毒性,但仍保持了其良好的免疫原性[18],因此,可將沒有蛋白水解活性和細胞毒性的突變蛋白作為首選的疫苗抗原在真核細胞中表達,并在此基礎上進行魚類鰻弧菌病DNA疫苗的研制。
3 結論
利用分子生物學技術,在已克隆的突變的鰻弧菌W-1金屬蛋白酶基因m-empA7的基礎上,成功構建了鰻弧菌突變金屬蛋白酶m-EmpA7的真核表達質粒pCDNA3.1(+)/m-empA7,轉染細胞后經 RT-PCR和Western-blot檢測表明,m-empA7基因能夠在真核細胞中轉錄和表達,而且表達的目的蛋白可與抗EmpA蛋白的抗體特異性結合,具有抗原性,因此,可考慮將pCDNA3.1(+)/m-empA7作為基因候選疫苗用于后續的動物實驗研究。這為進一步研究鰻弧菌金屬蛋白酶基因疫苗在魚類弧菌病害防治中的作用奠定了一定的基礎。
參考文獻:
[1] Egidius E. Vibriosis: Pathogenicity and pathology. A review[J]. Aquaculture, 1987, 67: 15-18.
[2] Austin B,Austin D A.Bacterial Fish Pathogens:Diseases of Farmed and Wild Fish[M]. London, United Kingdom:Springer, 1999.
[3] Crosa J H. A plasmid associated with virulence in the marine fish pathogenVibrioanguillarumspecifies an iron-sequestering system[J].Nature, 1980, 284(5756): 566-568.
[4] Actis L A, Tolmasky M E, Farrell D H, et al. Genetic and molecular characterization of essential components of theVibrioanguillarumplasmid-mediated iron-transport system[J]. J Biol Chem,1988, 263(6): 2853-2860.
[5] Munn C B. Hemolysin production byVibrioanguillarum[J].FEMS Microbiol Lett, 1978,3(5): 265-268.
[6] Munn C B. Production and Properties of a Hemolytic Toxin byVibrioanguillarum. Fish Diseases[M]. Berlin: Third copraq session, Springer-Verlag, 1980: 69-74.
[7] Boesen H T, Pedersen K, Larsen J L, et al. Vibrio anguillarum resistance to rainbow trout (Oncorhynchusmykiss) serum: Role ofO-antigen structure of lipopolysaccharide[J]. Infect Immun, 1999, 67(1): 294-301.
[8] Singer J T, Schmidt K A, Reno P W. Polypeptides p40, pOM2, and pAngR are required for iron uptake and for virulence of the marine fish pathogenVibrioanguillarum[J]. Bacteriology, 1991, 173(3): 1347-1352.
[9] Norqvist A, Wolf-Watz H. Characterization of a novel chromosomal virulence locus involved in expression of a major surface flagellar sheath antigen of the fish pathogenVibrioanguillarum[J]. Infect Immun, 1993, 61(6): 2434-2444.
[10] Inamura H, Nakai T, Muroga K. An extracellular protease produced byVibrioanguillarum[J]. Bull Jpn Soc Sci Fish, 1985,51(12): 1915-1920.
[11] Kanemori Y, Nakai T,Muroga K. The role of extracellular protease produced byVibrioanguillarum[J].Fish Pathology, 1987, 22(3): 153-158.
[12] Norqvist A, Norrman B, Wolf-Watz H. Identification and characterization of a zinc metalloprotease associated with invasion by the fish pathogenVibrioanguillarum[J]. Infect Immun, 1990,58(11): 3731-3736.
[13] Farrell D H, Crosa J H. Purification and characterization of a secreted protease from the pathogenic marine bacteriumVibrioanguillarum[J]. Biochem, 1991, 30(14): 3422-3436.
[14] Milton D L, Norqvist A, Wolf-Watz H. Cloning of a metalloprotease gene involved in the virulence mechanism ofVibrioanguillarum[J]. J Bacteriol, 1992, 174(22): 7235-7244.
[15] 陳吉祥,劉霜,李筠,等.一種致病性鰻弧菌胞外蛋白酶的分離純化及性質[J].中國水產科學,2002,9(4):318-322.
[16] Denkin S M, Nelson D R. Regulation ofVibrioanguillarumempAmetalloprotease expression and its role in virulence[J]. Appl Environ Microbiol, 2004, 70(7): 4193-4204.
[17] Yang Hui,Chen Jixiang, Yang Guanpin, et al. Characterization and pathogenicity of the zinc metalloprotease EmpA ofVibrioanguillarumexpressed inEscherichiacoli[J]. Current Microbiology, 2007,54(3):244-248.
[18] Yang Hui,Chen Jixiang,Yang Guanpin, et al. Mutational analysis of the zinc metalloprotease EmpA ofVibrioanguillarum[J]. FEMS Microbiology Letters, 2007, 267(1): 56-63.
[19] Heppell J,Davis H L. Application of DNA vaccine technology to aquaculture[J].Adv Drug Delivery Rev, 2000, 43(1): 29-43.
[20] Hansen E, Fernandes K, Goldspink G, et al. Strong expression of foreign genes following direct injection into fish muscle[J]. FEBS Lett, 1991, 290(1-2): 73-76.
[21] Anderson E D, Mourich D V, Fahrenkrug S C,et al. Genetic immunization of rainbow trout (Oncorhynchusmykiss) against infectious hematopoietic necrosis virus[J]. Mol Marine Biol Biotechnol, 2000, 5(2): 114-122.

