高產油脂酵母的篩選及發酵條件的研究
,李元,王常, ,, ,2,3
(1.湖北工業大學生物工程學院,湖北 武漢 430068;2.湖北工業大學發酵工程省部共建教育部重點實驗室,湖北 武漢 430068;3.湖北工業大學湖北省工業微生物重點實驗室,湖北 武漢 430068)
油脂按來源可分為動物油脂、植物油脂和微生物油脂。隨著耕地的減少和人口的增加,動植物油脂越來越不能滿足生產和發展的需求。微生物油脂由于得天獨厚的優勢條件(生產不受場地、季節等因素的影響),已引起各國研究者的關注。微生物油脂主要指由多不飽和脂肪酸(Polyunsaturated fatty acids,PUFAs)組成的甘油三酯。PUFAs具有很多生理功能,廣泛用于食品、保健、醫藥、化工等領域。其工業化的最佳途徑是發酵法[1]。
作者通過蘇丹黑染色初篩及搖瓶發酵復篩,從6種酵母菌中篩選出油脂高產菌株,并對其發酵條件進行了優化。
1 實驗
1.1 菌種
漢遜氏酵母(Hansenula)、啤酒酵母(S.cerevisiae)、假絲酵母(Candidaoleophila)、產酯酵母(Saccharomyceteesterproduced)、葡萄酒酵母(S.ellipsoideus)、路哥酵母(Saccharomycodesludwigiilog),自行保存。
1.2 培養基
斜面培養基(g·L-1):葡萄糖20,酵母膏10,蛋白胨20,瓊脂20,pH值自然。
種子培養基(g·L-1):葡萄糖20,酵母膏5,蛋白胨6,pH值4.0。
發酵培養基(g·L-1):葡萄糖40,酵母膏4, MgSO4·7H2O 5, KNO39,(NH4)2SO46, NH4H2PO43, pH值5.5。
1.3 接種和發酵
從斜面取一環接種于50 mL(250 mL的三角瓶)種子液中,于28℃、120 r·min-1搖床培養1 d。然后取5 mL種子液接種于45 mL發酵培養基中,28℃、120 r·min-1搖床培養4 d。
1.4 菌種篩選及發酵條件優化
1.4.1 菌種初篩
采用蘇丹黑染色法[2]進行初篩。用0.5%的蘇丹黑對漢遜氏酵母、啤酒酵母、假絲酵母、產酯酵母、葡萄酒酵母、路哥酵母染色,用二甲苯洗去多余染色液,番紅復染后鏡檢。顯微鏡下菌絲體呈粉紅色,油脂顆粒呈藍黑色。通過觀察不同酵母菌中油脂顆粒的大小及多少,選出油脂產量較多的兩種菌進行發酵復篩。
1.4.2 發酵復篩
取初篩得到的菌株發酵,測出各自的細胞量和油脂含量[1],算出油脂產量,確定油脂產量最高的菌種進行發酵條件優化。
1.4.3 發酵條件優化
以細胞量和油脂含量[3]為指標,對初始pH值、溫度等培養條件和碳、氮源進行優化。
1.5 分析方法
1.5.1 生長曲線的繪制
取活化后斜面菌種一環,接種于50 mL液體種子培養基中,28℃培養24 h,取5 mL液體轉移到45 mL液體種子培養基中,每隔一定時間取樣,在600 nm處測定光密度值,以發酵周期為橫坐標、OD600值為縱坐標,繪制菌體生長曲線。
1.5.2 細胞量的測定
取一定體積(V)的發酵液于恒重的離心管(m1)中,在3000 r·min-1下離心10 min,棄上清,沉淀用蒸餾水清洗2次,在3000 r·min-1下離心10 min,棄上清,于80℃烘干至恒重后取出,干燥器中自然冷卻至室溫后稱量(m2)。細胞量(g·L-1)依下式計算:
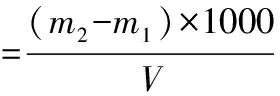
1.5.3 菌體油脂含量的測定
(1)采用索氏提取法[1]。將一定量的干細胞用濾紙包裹放入提取管中,以石油醚為溶劑回流,細胞內油脂隨石油醚進入平底燒瓶中,回流6~8 h后,回收石油醚并蒸干平底燒瓶,于電熱鼓風干燥箱中烘干稱量,計算平底燒瓶提取前后質量差值,可準確測得細胞油脂含量。
(2)采用蘇丹黑比色法[3]。取一定體積的發酵液離心洗滌,用0.3%蘇丹黑對細胞染色,用乙醇洗去多余染色液,并將細胞溶于同體積去離子水中,以未染色的細胞為參比,在OD580下測吸光度值,胞內油脂含量越高吸光度值越大,據此可快速直觀地比較同種菌株不同條件下產油脂情況。吸光度值和油脂含量關系見圖1。
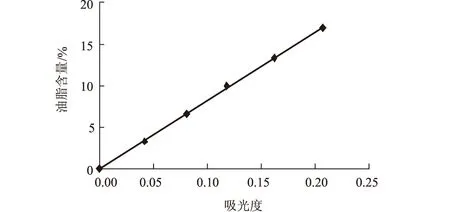
圖1 油脂含量與吸光度值關系
2 結果與討論
2.1 菌種初篩
用蘇丹黑染色法[2]對6種酵母染色、鏡檢,顯微鏡照片見圖2。
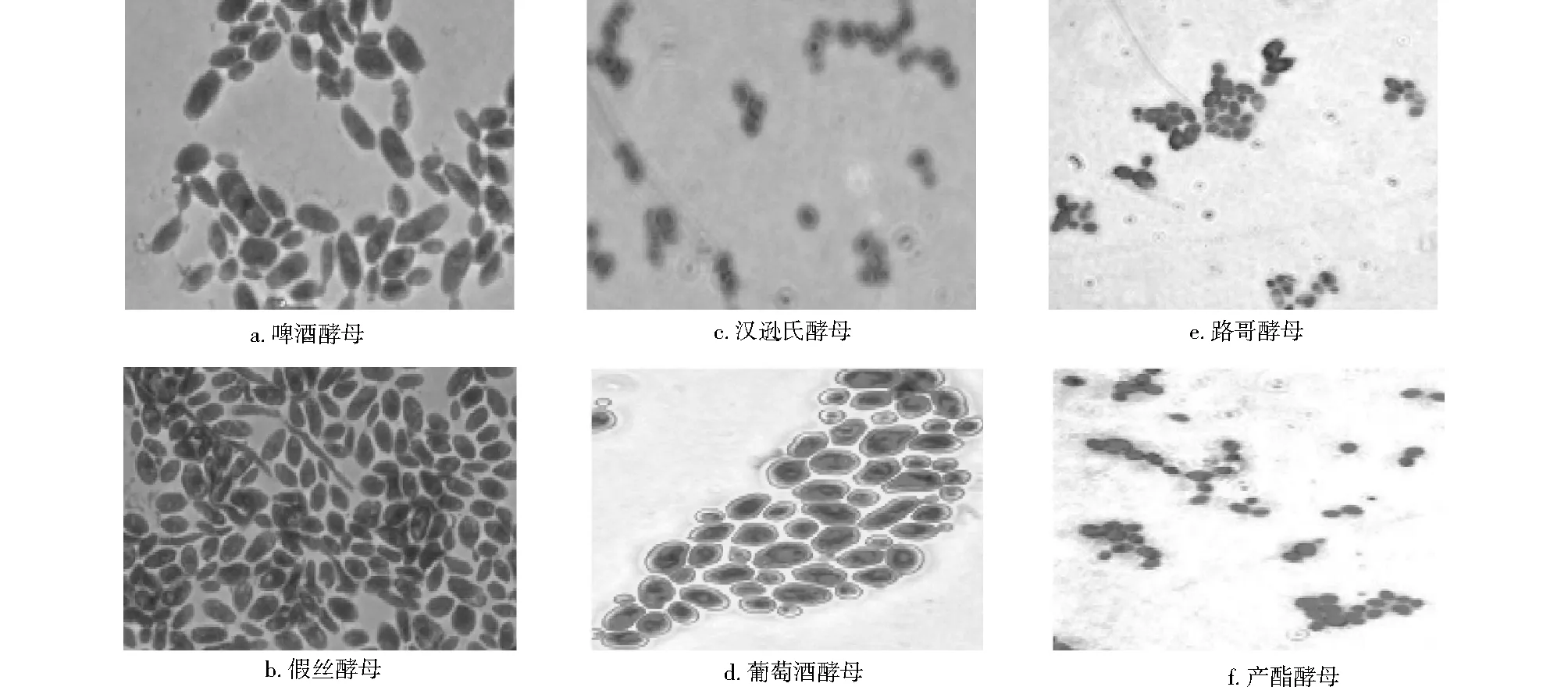
圖2 6株蘇丹黑染色酵母的顯微鏡照片
由圖2可見,假絲酵母和啤酒酵母油脂顆粒較大,均呈油滴狀。因此,選取假絲酵母和啤酒酵母進行發酵復篩。
2.2 發酵復篩
2.2.1 假絲酵母和啤酒酵母的生長曲線(圖3)
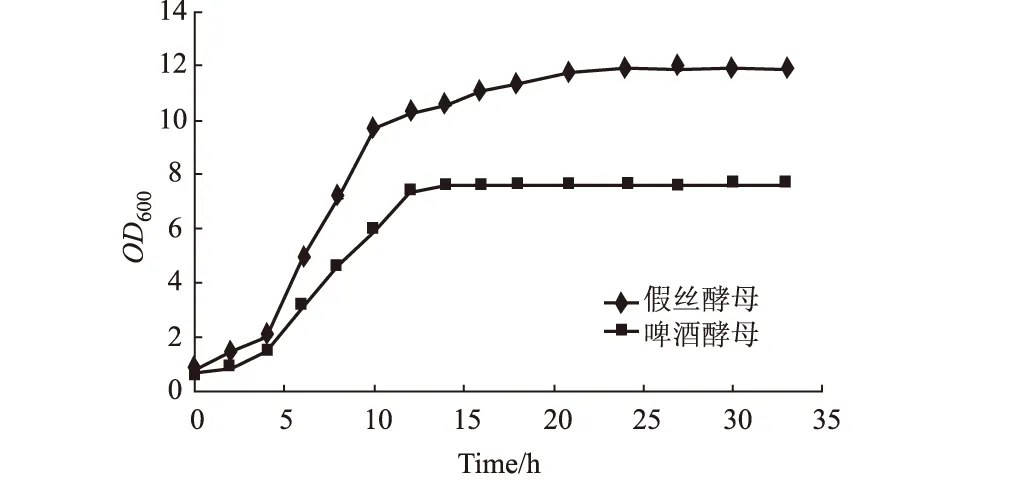
圖3 假絲酵母和啤酒酵母的生長曲線
由圖3可見,假絲酵母在第6 h進入對數生長期,第20 h進入了穩定期;啤酒酵母在第6 h進入對數生長期,第12 h進入了穩定期。達到穩定期后假絲酵母的OD600比啤酒酵母高出很多。這說明同體積的發酵液假絲酵母能收獲更多的細胞。
2.2.2 假絲酵母和啤酒酵母的細胞量和油脂含量
以相同的接種量(10%)對假絲酵母和啤酒酵母發酵培養4 d,測細胞量和油脂含量,計算油脂產量,結果見表1。

表1 假絲酵母和啤酒酵母細胞量和油脂產量
由表1可見,假絲酵母細胞量、油脂含量、油脂產量分別是啤酒酵母的1.64倍、1.14倍和1.87倍,故確定假絲酵母為油脂高產菌種進行發酵條件優化。
2.3 發酵條件優化
2.3.1 培養溫度對假絲酵母細胞量和油脂含量的影響(圖4)
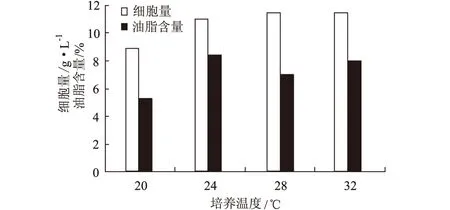
圖4 培養溫度對假絲酵母細胞量和油脂含量的影響
由圖4可見,細胞量在20~28℃范圍內,隨著培養溫度的上升而增加,而在28~32℃不再增加;油脂含量隨培養溫度的升高先上升后下降,24℃時油脂含量最高。這說明細胞生長和油脂合成的最適培養溫度不同,為使最終油脂產量達到最大,可采用控溫法來調節整個發酵過程,即發酵前期控制溫度在28℃,待細胞量維持穩定后適當降低溫度以促進油脂的合成。
2.3.2 初始pH值對假絲酵母細胞量和油脂含量的影響(圖5)

圖5 初始pH值對假絲酵母細胞量和油脂含量的影響
由圖5可見,在選取的初始pH值范圍內,細胞量和油脂含量均先上升后下降,并均于初始pH值為6.0時達到最大,因此選擇假絲酵母生長和油脂合成的初始pH值為6.0。
2.3.3 發酵周期對假絲酵母細胞量和油脂含量的影響(圖6)
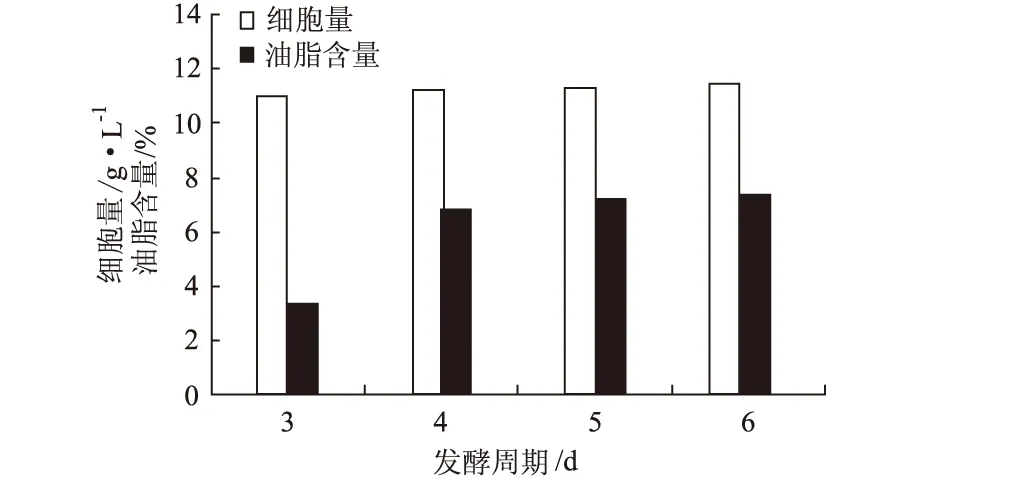
圖6 發酵周期對假絲酵母細胞量和油脂含量的影響
由圖6可見,細胞量和油脂含量均隨著發酵周期的延長而增加,但發酵超過4 d以后,細胞量和油脂含量的增長非常有限。考慮經濟因素,選擇發酵周期為4 d。
2.3.4 接種量對假絲酵母細胞量和油脂含量的影響(圖7)
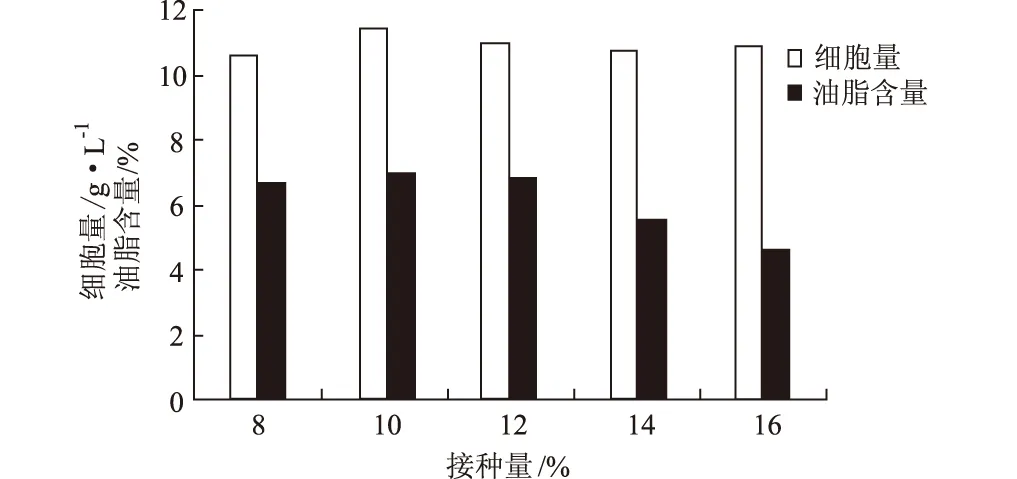
圖7 接種量對假絲酵母細胞量和油脂含量的影響
由圖7可見,細胞量和油脂含量均隨著接種量的增加先上升后下降,并都在接種量為10%時達到最大。因此,選擇接種量為10%。
2.3.5 轉速對假絲酵母細胞量和油脂含量的影響(圖8)
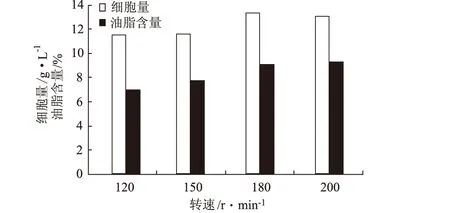
圖8 轉速對假絲酵母細胞量和油脂含量的影響
由圖8可見,轉速從120 r·min-1提高到180 r·min-1,細胞量和油脂含量相應上升;轉速超過180 r·min-1后,細胞量和油脂含量均趨于穩定。因此,選擇轉速為180 r·min-1。
2.4 碳、氮源選擇
2.4.1 碳源對假絲酵母細胞量和油脂含量的影響
分別選擇葡萄糖、乳糖、蔗糖、麥芽糖為碳源,添加量均為4%,其它成分不變,搖瓶發酵4 d,測細胞量和油脂含量,結果見圖9。
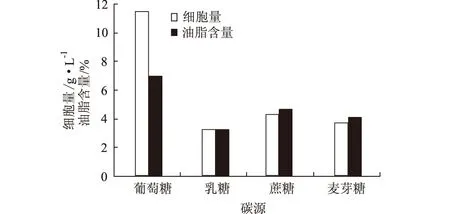
圖9 碳源對假絲酵母細胞量和油脂含量的影響
由圖9可見,以葡萄糖為碳源時,細胞量和油脂含量都達到最大,即葡萄糖最有利于細胞生長和油脂合成,是最佳碳源。
2.4.2 氮源對假絲酵母細胞量和油脂含量的影響
氮源主要用于構成菌體細胞物質(氨基酸、蛋白質、核酸等)和含氮代謝物[4]。分別選取蛋白胨、酵母膏、硝酸鉀、磷酸二氫銨、硫酸銨為氮源,添加量均為0.4%,其它成分不變,搖瓶發酵4 d,測細胞量和油脂含量,結果見圖10。
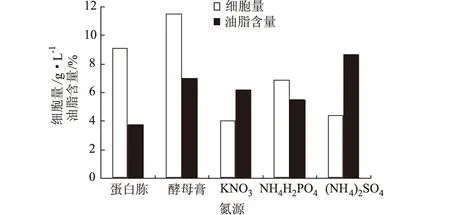
圖10 氮源對假絲酵母細胞量和油脂含量的影響
由圖10可知,酵母膏是菌體生長最佳氮源,硫酸銨有利于油脂合成,因此,選定酵母膏為氮源,并添加適量硫酸銨促進油脂合成。
2.5 驗證實驗
采用優化前、后的碳、氮源和培養條件進行發酵實驗,結果見表2。
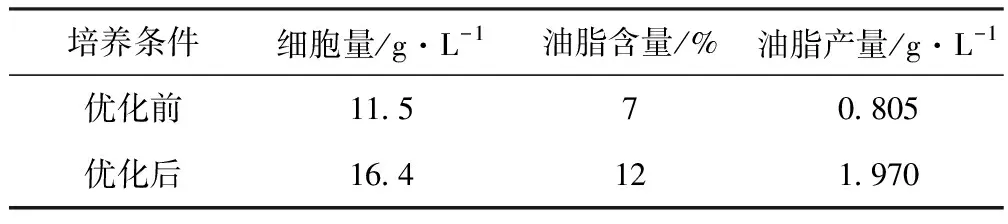
表2 優化前后發酵結果
由表2可見,發酵條件優化后,假絲酵母的細胞量、油脂含量、油脂產量分別是優化前的142%、171%、245%。
3 結論
對6種酵母菌進行初篩和復篩,選出假絲酵母為油脂高產菌株,確定其最適培養條件為:初始pH值6.0,轉速180 r·min-1,接種量10%,發酵周期4 d,培養溫度采用兩階段法即發酵前期溫度控制在28℃,待細胞量維持穩定后適當降低溫度以促進油脂的合成;最佳碳源為葡萄糖,最佳氮源為酵母膏,并添加適量硫酸銨促進油脂合成。優化后假絲酵母的細胞量、油脂含量、油脂產量分別是優化前的142%、171%、245%。
參考文獻:
[1] 何東平,陳濤.微生物油脂學[M].北京:化學工業出版社,2006:228.
[2] 杜連祥,路福平.微生物學實驗技術[M].北京:中國輕工業出版社,2005:107.
[3] Thakur M S,Prapulla S G,Karanth N G.Estimation of intracellular lipids by the measurement of absorbance of yeast cells stained with Sudan Black B[J].Enzyme Microb Technol,1989,11(4):252-254.
[4] 俞俊棠,唐孝宣.生物工藝學[M].上海:華東理工大學出版社,2002:101.

