微生物及酶固定二氧化碳的研究進展
溫室效應是指人類向大氣中排放CO2等氣體阻礙了地球的熱量擴散到外層空間,從而使氣溫升高的現象。溫室效應會導致高緯度地區降雨量增加、高山積雪融化、兩極冰山融化、海平面上升,已成為影響地球生態環境的重要原因。溫室效應氣體有CO2、氯氟代烷、CH4等30多種,其中CO2影響最大。據聯合國氣候變化專門委員會(IPCC)分析[1],全世界約10%~15%的廢氣來自于煤燃燒排放的CO2,每年約200億 t,溫室效應將導致地球的平均溫度上升1.5~4.5℃。除減少排放外,還原和固定CO2也將有助于減輕溫室效應。CO2的固定和利用方法主要有物理法、化學法和生物法。物理法和化學法雖然可以制得新的有用化合物,但會產生一些副產物,而且消耗能量,對環境造成二次污染。生物法固定CO2是通過植物或微生物的循環途徑將CO2轉化成化學物質或其自身生長的營養物質。固定CO2的生物主要是植物和自養微生物。綠色植物的葉綠體中有一個特有的酶促機構,催化CO2轉變成還原性的有機化合物,這個過程為CO2的固定過程。但是地球上還有植物不能生長的特殊環境,自養微生物固定CO2的優勢便顯現出來。從整個生物圈的物質、能量流來看,自養微生物可以利用可見光作為主要能源驅動CO2的固定。使用特定的酶可更加直接快速地實現CO2的固定。作者在此介紹了近年來微生物和酶固定CO2的研究進展。
1 微生物固定CO2的研究進展
1.1 固定CO2的微生物種類
自養微生物利用光能或無機物氧化時產生的化學能同化CO2,構成細胞物質。固定CO2的自養微生物較多[2],一般有兩類:光能自養型和化能自養型微生物,如表1所示。
表1 固定CO2的微生物種類
Tab.1Microbialtypesofcarbondioxideimmobilization
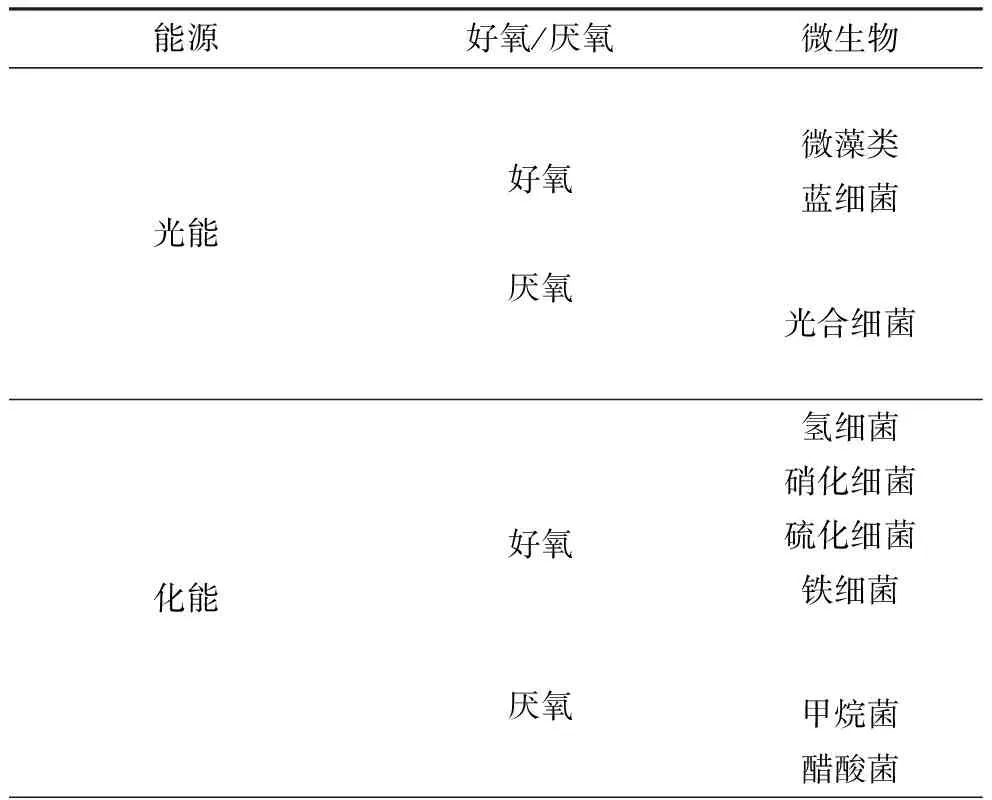
能源好氧/厭氧微生物光能好氧厭氧微藻類藍細菌光合細菌化能好氧厭氧氫細菌硝化細菌硫化細菌鐵細菌甲烷菌醋酸菌
光能自養型微生物包括微藻類、藍細菌和光合細菌,含有葉綠素,以光為能源、CO2為碳源合成菌體物質或代謝產物;化能自養型微生物以CO2為碳源,能源主要有H2、H2S、NH4+、NO2-、Fe2+等。微藻(包括藍細菌)和氫細菌具有生長速度快、適應性強等特點。國內外現已大規模生產的微藻主要有:柵列藻(Scenedesmus)、小球藻(Chlorella)、鹽藻(Dunaliella)和螺旋藻(Spirulina)等。Ishizaki等[3]利用產堿桿菌以CO2為碳源在限氧條件閉路循環發酵系統中培養60 h,其菌體濃度高于60 g·L-1、PHB達36 g·L-1。化能自養菌中固定CO2生長速度最快的是氫細菌,已發現的氫細菌有18個屬,近40個種。Nishihara[4]篩選的中溫氫細菌在固定CO2時還分別積累大量的胞外多糖和胞內糖原型多糖。
1.2 微生物固定CO2
微藻類具有光合速率快、繁殖快、環境適應性強、固定效率高等優點,常與其它工程技術結合用于固定CO2。de Morais等[1]將螺旋藻中的Spirulinasp.和斜生柵藻S.obliquus培養在恒溫30℃的三級連續管狀光生物反應器中,觀察CO2的固定狀況和這兩種微生物對CO2的耐受力。結果發現,螺旋藻Spirulinasp.的最大比生長速率和最高產率分別為0.44 d-1和0.22 g·L-1·d-1;最高CO2固定率在CO2體積分數為6%時是53.29%,在CO2體積分數為12%時為45.61%。斜生柵藻S.obliquus的最高CO2固定率在CO2體積分數為6%時為28.08%,在CO2體積分數為12%時為13.56%。
Hanagata等[5]培養的Chlorella在CO2體積分數為10%時,產率為0.15 g·L-1·d-1,在CO2體積分數為40%時,產率為0.18 g·L-1·d-1。Sung等[6]培養的Chlorella菌株KR-1在不同體積分數CO2下有不同的產率,CO2體積分數為10%時產率為1.1 g·L-1·d-1;CO2體積分數為30%時產率為0.8 g·L-1·d-1;CO2體積分數為50%時產率為0.6 g·L-1·d-1,CO2體積分數為70%時產率為0.1 g·L-1·d-1。有的菌株在CO2環境中可以加速生長,Chang等[7]培養的Chlorella菌株NTU-H15和NTU-H25在通入5%CO2時細胞生長速度加快,最高產率達到0.31 g·L-1·d-1。
隨著基因工程的發展,固定CO2細菌和基因工程有了契合點。杜翠紅[8]以沼澤紅假單胞菌為受體菌株,以卡爾文循環中的關鍵酶核酮糖-1,5-二磷酸羧化酶/氧化酶(RubisCO)的基因為目的基因,借助沼澤紅假單胞菌/大腸桿菌穿梭載體,將目的基因轉入受體菌株中,構建了一株固定CO2的基因工程菌。
研究人員在研究CO2還原產物的同時,發現CO2被固定后的某些產物還可以作為中間物質維持還原反應的循環進行。Ishizaki等[9]和Tanaka[10]利用AlcaligeneseutrophusATCC 17697T固定CO2生產聚-3-羥基丁酸酯。辛嘉英[11]利用甲基彎菌IMV3011催化CO2生物轉化生成甲醇,在細胞懸浮液中充入CO2反應一段時間后,在反應液中檢測到甲醇。還發現細胞內貯存的聚-β-羥基丁酸分解后能夠產生還原當量,通過改變培養基中氮和銅的起始濃度對PHB積累量進行調節,可提高甲基彎菌IMV3011還原CO2生成甲醇的能力。
有研究人員進行了自養固定CO2細菌的研究。Berg等[12]發現古細菌屬硫化葉菌目的自養型細菌Metallosphaerasedula可以利用乙酰輔酶A或丙酰輔酶A羧化酶固定CO2。Ramos-Vera等[13]報道了兩種新的自養型細菌固定CO2的循環。硫化葉菌目利用3-羥基丙酸鹽/4-羥基丁酸鹽循環,以乙酰輔酶A/輔酶A羧化酶作為催化酶。Ignicoccus hospitalis(除硫球菌目)利用二甲酸亞乙基酯/4-羥基丁酸鹽循環,以丙酮酸合酶和磷酸烯醇丙酮酸羧激酶作為催化酶固定CO2。在這兩個循環中,乙酰輔酶A和兩個無機碳通過不同的途徑被轉化成琥珀酰-輔酶A,而從琥珀酰-輔酶A到乙酰輔酶A的再生途徑是相同的,該循環是嚴格厭氧環境。
近年來,電化學的研究引起了人們的關注。Cao等[14]在MFC中利用生物陰極,用溶解的CO2作為電子受體,利用外加電源提供0.242 V的電勢(相對于SHE)。經過一個月的調整最終得到1 mA的穩定電流,每1 mol e-還原(0.28 ±0.02) mol重碳酸鹽,這是首次利用陰極和微生物間直接電子轉移固定CO2。
2 酶法固定CO2的研究進展
微生物法固定CO2實質上是微生物中的某些酶在生物體內一系列的催化反應。早在1984年就有人提出酶法還原CO2,即以酶為催化劑通過一連串酶促反應,將CO2轉化為有用物質。目前研究還原CO2較多的是多酶體系,包括三種脫氫酶:甲酸脫氫酶(FDH)、甲醛脫氫酶(FADH)、甲醇脫氫酶(MDH),這三種酶分別可以將甲酸、甲醛、甲醇氧化成CO2。多酶系統固定CO2是向該系統中供給逆反應進行方向的物質,使得CO2被還原。
Parkinson等[15]于1984年提出了酶固定CO2的途徑,以甲酸脫氫酶作催化劑將CO2還原為甲酸。Susumu等[16]以甲酸脫氫酶為催化劑,以甲基紫精或PQQ作為電子傳遞體,以飽和CO2磷酸緩沖溶液(pH=7)為電解液,在-0.7~-0.9 V(相比于SCE飽和甘汞電極)電極電勢下將溶解的CO2轉化成甲酸鹽,轉化率高達90%,甲酸脫氫酶在暗處的酶活力較為持久。在以甲醇脫氫酶為催化劑、以甲基紫精為電子傳遞體、以甲酸鈉飽和磷酸鹽溶液為電解液、電極電勢為-0.7~-0.9 V(相比于SCE飽和甘汞電極)的條件下,酶濃度低時生成甲醛;酶濃度高時,甲醛積累到一定程度生成甲醇;當PQQ代替甲基紫精作為電子中間體時只產生甲醇。在以上結果的基礎上,以甲酸脫氫酶和甲醇脫氫酶共同作為催化劑,以PQQ作為電子中間體可將CO2還原成為甲醇。
生物體內的酶催化化學反應是連續的,前一種酶的作用產物往往是后一種酶的作用底物。Obert等[17]采用多酶體系將CO2還原成甲醇。CO2先在甲酸脫氫酶作用下還原為甲酸鹽,然后在甲醛脫氫酶作用下還原為甲醛,最后在甲醇脫氫酶作用下還原為甲醇,每一步脫氫酶反應的最終電子供體都為還原性NADH。
天然酶穩定性差、易失活、不能重復使用,為了保證多酶體系作用連續有效,用溶膠-凝膠多孔納米材料將多酶體系包埋起來。結果表明,同多酶體系直接在溶液中還原CO2相比,包埋于多孔溶膠-凝膠中的多酶體系還原CO2為甲醇的產率明顯提高。
姜忠義等[18]采用改進的溶膠-凝膠法固定多酶體系,以NADH為電子供體,在低溫低壓條件下將CO2還原成甲醇,通過改變反應物配比、催化劑用量及其它反應條件,摸索出較適宜的凝膠化條件為:37℃、pH=7.0,在此條件下甲醇產率達92.4%。過程如下:
上述反應體系需加入昂貴的NADH電子供體,且不能連續反應。
崔俊儒等[19]發現含多酶體系的甲烷氧化細菌在溫和條件下經過一系列反應能夠將CO2還原成甲醇,CO2還原而成的甲醇在細胞外得以積累。在反應體系中加入甲烷作為底物時,產生的還原能量推動反應連續穩定進行。
為優化反應條件,Sun等[20]將三種脫氫酶通過溫和的仿生礦化過程包埋于二氧化鈦粒子體系中,用于還原CO2成甲醇。包埋后的多酶體系在NADH作為電子供體的條件下依次將CO2還原為甲酸、甲醛、甲醇。和開放型反應系統相比,包埋后的多酶體系將CO2還原為甲醇的產率有了很大的提高。
Reda等[21]以甲基紫精為電子中間體,在嚴格厭氧環境中將甲酸脫氫酶吸附到電極表面用于電化學還原CO2生成甲酸鹽。甲酸脫氫酶電催化在熱力學上是可逆的,且只需要很低的過電壓,此反應發生在溫和條件下,甲酸鹽是唯一產物。
上述研究都是使用多酶體系來模擬生物體的光合作用而還原CO2,反應無需光照,且不添加光催化劑或光敏劑。在酶固定轉化CO2的研究中,還有使用光敏劑對CO2進行光催化還原的報道。如Willner等[22]在上述體系中添加了光敏劑釕,利用酶ICDH和電子傳輸介質MV2+成功進行了CO2的光化學固定及還原。
3 展望
微生物及酶固定CO2的研究取得了一些進展,目前有望實現大規模工業生產的是微藻類和氫細菌。微藻類在自身繁殖菌體時,可將CO2轉化為生物柴油等液體燃料或者利用CO2生產有用物質,如:類脂和蛋白質等;氫細菌在固定CO2的同時還能積累大量胞內糖原。通過相應的酶作用可以將CO2還原為蘋果酸和異檸檬酸、甲烷、甲醇、乙醇等。微生物固定CO2仍有一些瓶頸問題,如細胞生長速度慢、密度低,可用的菌種資源有限,催化氧化過程需要還原性輔酶參與。酶法固定CO2存在酶種類少、途徑單一、轉化效率低等缺點。微生物和酶固定CO2的機理也較復雜,還需要不斷的探索。
微生物和酶固定CO2今后的研究方向主要是:(1) 開發光生物反應器以滿足微藻類生長所需的光強,實現CO2在溫和條件下轉化為有機碳;(2) 通過基因工程構建固定CO2的高效菌株;(3) 進一步研究微生物和酶固定CO2的機理,為CO2固定研究提供理論支持;(4)開發新的高效分離技術以分離還原產物;(5)同其它還原CO2的方式(如光催化和電化學還原等)結合,用于合成各種化學品及高分子材料。
參考文獻:
[1] de Morais Michele Greque,Costa Jorge Alberto Vieira.Biofixation of carbon dioxide bySpirulinasp.andScenedesmusobliquuscultivated in a three-stage serial tubular photobioreactor [J].Journal of Biotechnology,2007,12(9):439-445.
[2] Hiroyuki H.Effective lactic acid production by two-stage extractive fermentation[J].Ferment Bioeng,1995,79(6):589-593.
[3] Ishizaki A,Tanaka K.Batch culture ofAlcaligeneseutrophus
ATCC 17697T using recycled gas closed circuit culture system[J].Ferment Bioeng,1990,69(3):170-174.
[4] Nishihara H.Production and properties of glycogen in the marine obligate chemolithoautotroph,Hydrogenovibriomarinus[J].Ferment Bioeng,1993,75(6):414-416.
[5] Hanagata N,Takeuchi T,Fukuju Y,et al.Tolerance of microalgae to high CO2and high temperature[J].Phytochemistry,1992,31(10):3345-3348.
[6] Sung K D,Lee J S,Shin C S,et al.CO2fixation byChlorellasp.KR-1 and its cultural characteristics[J].Biores Technol,1999,68(3):269-273.
[7] Chang E H,Yang S S.Some characteristics of microalgae isolated in Taiwan for biofixation of carbon dioxide[J].Bot Bull Acad Sin,2003,44(1):43-52.
[8] 杜翠紅.沼澤紅假單胞菌RubisCO基因的克隆與表達及其固定二氧化碳特性的研究[D].大連:大連理工大學,2003.
[9] Ishizaki A,Taga N,Takeshita,et al.Microbial production of biodegradable plastics from carbon dioxide and agricultural waste material[J].Ferment Bioeng,1991,71(4):254-257.
[10] Tanaka K.Production of poly-d-3-hydroxybutyric acid from carbon dioxide by a two-stage culture method employingAlcaligeneseutrophusATCC 17697T[J].Ferment Bioeng,1994,77(4):425-427.
[11] 辛嘉英.甲基彎菌IMV3011細胞生物催化二氧化碳制甲醇[J].分子催化,2008,22(4):356-361.
[12] Berg Ivan A,Kockelkorn Daniel,Buckel Wolfgang,et al.A
3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway inArchaea[J].Science,2007,318(5857):1782-1786.
[13] Ramos-Vera W H,Berg I A,Fuchs G.Autotrophic carbon dioxide assimilation in thermoproteales revisited[J].Journal of Bacteriology,2009,191(13):4286-4297.
[14] Cao Xiaoxin,Huang Xia,Liang Peng,et al.A completely anoxic microbial fuel cell using a photo-biocathode for cathodic carbon dioxide reduction[J].Energy Environ Sci,2009,2(5):498-501.
[15] Parkinson B A,Weaver Paul F.Photoelectrochemical pumping of enzymatic CO2reduction[J].Nature,1984,309:148-149.
[16] Susumu Kuwabata,Tsuda Ryo,Yoneyama Hiroshi.Electrochemical conversion of carbon dioxide to methanol with the assistance of formate dehydrogenase and methanol dehydrogenase as biocatalysts[J]. J Am Chem Soc,1994,116(12):5437-5443.
[17] Obert Robyn,Dave Bakul C.Enzymatic conversion of carbon dioxide to methanol:Enhanced methanol production in silica sol-gel matrices[J].J Am Chem Soc,1999,121(51):12192-12193.
[18] 姜忠義,吳洪,許松偉,等.溶膠-凝膠固定化多酶催化二氧化碳轉化為甲醇反應初探[J].催化學報,2002,23(2):162-164.
[19] 崔俊儒,辛嘉英,牛建中,等.甲烷氧化細菌催化二氧化碳生物合成甲醇的研究[J].分子催化,2004,18(3):214-218.
[20] Sun Qianyun,Jiang Yanjun,Jiang Zhongyi,et al.Green and efficient conversion of CO2to methanol by biomimetic coimmobilization of three dehydrogenases in protamine-templated titania[J].Ind Eng Chem Res,2009,48(9):4210-4215.
[21] Reda Torsten,Plugge Caroline M,Abram Nerilie J,et al.Reversible interconversion of carbon dioxide and formate by an electroactive enzyme[J].PNAS,2008,105(31):10654-10658.
[22] Willner I,Mandler D,Rinklin A.Photoreduction of CO2to CH4in aqueous solutions using visible light[J].J AM Chem Soc,1998,108:8100-8101.

