大鼠LPS吸入性肺損傷模型制備的研究
嚴偉民 姜 虹 陳萬濤
大鼠LPS吸入性肺損傷模型制備的研究
嚴偉民 姜 虹 陳萬濤
目的建立一種誤吸所致的肺損傷的動物模型,為進一步研究急性吸入性肺損傷的病理生理和臨床治療方法提供穩定的模型基礎。方法48只成年雄性SD大鼠,隨機分為生理鹽水對照組(NS組)和實驗組(LPS組),每組24只。利用喉鏡暴露聲門,實驗組大鼠氣管內滴注Lipopolysaccharide(LPS)1 mL/kg(0.5 mg/mL)制模,NS組大鼠氣管內滴注1 mL/kg生理鹽水。注藥后1 h、6 h、12 h、24 h為觀察時間點,每時間點各取材大鼠6只,行動脈血氣分析、肺組織濕/干重比(W/D)分析,以及光鏡觀察肺組織病理改變。結果LPS組表現為持續性低氧血癥,各時間點動脈血二氧化碳分壓(PaCO2)下降,W/D比值和肺組織病理半定量評分升高,與NS組比較有顯著性差異(P<0.05)。光鏡下LPS組見肺間質滲出、水腫、大量炎癥細胞浸潤及紅細胞外滲等,達到ALI診斷標準。結論1 mL/kg的LPS作為致炎劑,采用喉鏡暴露聲門滴注可成功建立大鼠吸入性肺損傷模型,為進一步研究吸入性肺損傷的病變機制及治療方法提供了理想的條件。
吸入性肺損傷炎癥脂多糖模型
吸入性肺損傷是指氣道內誤吸入各種炎性刺激物,如強酸、胃返流物、異物等,引起的肺部臨床病理綜合征。全球因癌癥、缺血性心臟病、腦血管疾病等原因[1-2]造成誤吸、吸入性肺炎、急性肺損傷(Acute Lung Injury,ALI),乃至急性呼吸窘迫綜合征(Acute Respiratory Distress Syndrome,ARDS)的病例近年呈上升趨勢,使得呼吸系統疾病在所有死亡原因中占第3位,嚴重的ALI、ARDS的病死率達50%~60%。因此,如何防治誤吸所致的吸入性肺損傷已成為臨床上亟需解決的問題。內毒素是革蘭氏陰性細菌細胞壁外膜上的脂多糖(LPS)成分,可作為抗原激活機體的免疫應答,激活白細胞,誘使TNF-α、IL-1β、IL-6等炎癥因子的釋放[3],近年來成為研究急性肺損傷的理想致傷劑。以往的Lipopolysaccharide(LPS)致急性肺損傷動物模型大多是LPS靜脈或腹腔注射導致的繼發性肺損傷模型,這與氣道直接吸入LPS所致的原發性肺損傷在早期肺病理表現、疾病進程,甚至臨床治療策略上都存在很大的差異[4-5]。本實驗采用大鼠LPS氣管內直接滴注的方法,模擬急性吸入性肺損傷的病理生理,以期改良模型制備方法,為進一步研究ALI的臨床治療奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物
健康雄性SD大鼠48只(中國科學院上海實驗動物中心),體重200~250 g,標準化飼養。
1.1.2 主要試劑和儀器
Lipopolysaccharide(LPS)(Sigma公司,美國);大鼠專用喉鏡(上海交通大學醫學院附屬醫學院動物實驗室提供);光學顯微鏡(OLYMPUS,日本);全自動血氣分析儀(Raduometer,ABL 800 FLEX,美國)。切片機(LEICA公司,德國)。
1.2 方法
1.2.1 實驗分組
48只健康雄性SD大鼠,按SPF級標準化飼養3天。將動物隨機分為兩組:生理鹽水對照組(NS組)和實驗組(LPS組),每組24只。兩組分別氣管內滴入NS或LPS,滴注后1 h、6 h、12 h、24 h為觀察時間點,各時間點每組取材6只。
1.2.2 大鼠LPS吸入致急性肺損傷模型的制備
所有大鼠腹腔注射10%水合氯醛350 mg/kg麻醉,固定于操作臺,使大鼠頭高尾低位60°仰臥,予細繩圈套固定大鼠門牙,并用一棉簽壓住大鼠舌腹,上提張嘴,置入喉鏡,依助輔助放大鏡可見大鼠會厭及聲門,在聲門張大時,小心置入彎曲的7號鈍頭鋼針,鋼針頂端探至聲門下約3 mm處,實驗組緩慢滴注LPS 1 mL/kg(用0.9%NS配制LPS 0.5 mg/mL),對照組氣管內滴注1 mL/kg生理鹽水。滴注完畢后立即退出鋼針,將動物直立并左右翻轉3次,使藥物盡量均勻分布于兩肺。
1.2.3 標本采集
取材前用10%水合氯醛350 mg/kg腹腔注射麻醉,肝素化注射器抽取大鼠腹主動脈血0.3 mL,測定動脈血氣。
右支氣管結扎后切取大鼠右肺上葉組織,0.9%生理鹽水沖洗后稱重備用。
于大鼠右心室置入18 G口徑鈍頭鋼針,并在左心耳剪一約2 mm的小切口,同時向右心室快速灌注生理鹽水250 mL,沖洗肺血管床20 min,待外觀潔白透亮后,用2%多聚甲醛繼續灌注20 min,取右肺下葉組織4%多聚甲醛固定24 h,常規脫水、包埋。
1.2.4 觀察指標
1.2.4.1 動脈血氣分析
Raduometer ABL 800 FLEX型血氣分析儀測定動脈血氧分壓(Pressure of oxygen in arterial blood,PaO2)和二氧化碳分壓(Pressure of carbon dioxide in arterial blood,PaCO2),并計算PaO2與吸入氣中氧濃度分數(Fraction of Inspire O2,FiO2)的比值,即氧合指數(Value of oxygenation index)。
1.2.4.2 肺組織濕/干重比(W/D)測定
大鼠右肺上葉組織,以濾紙沾干表面水分,置于一干燥潔凈的玻璃試管中,經電子天平精確稱重后,置80℃恒溫烤箱內烘干24 h后再稱重,計算前后兩者的比值,即為肺濕/干重比(W/D)。
1.2.4.3 肺組織病理形態學檢查
光鏡下觀察肺組織病理學改變,按照Mikawa等[6]的方法進行肺組織病理半定量評分。評分標準:對肺泡充血、出血、肺泡腔或血管壁中性粒細胞浸潤或聚集、肺泡壁增厚和(或)透明膜形成等4項指標,分別依病變輕重評為0~4分(0分指無病變或非常輕微病變;1分為輕度病變;2分為中度病變;3分為重度病變;4分為極重度病變),總分16分。4項評定分數總和為肺損傷的總評分。
1.3 統計學分析
應用SPSS 16.0統計軟件分析數據,數據以均數±標準差(x±s)表示。NS對照組與LPS實驗組比較采用t檢驗,多個組間比較采用單因素方差分析,P<0.05表示有顯著性差異。
2 結果
2.1 動脈血氣分析
2.1.1 動脈血氧分壓(PaO2)分析
NS組各時間點PaO2無明顯差異(P>0.05)。LPS組PaO2較NS組各時間點顯著下降(P<0.05),6 h時最低,PaO2值60.2±4.7 mmHg(1 mmHg=0.133 kPa),明顯低于1 h時點(P<0.05),此后逐步回升,24 h時的PaO2高于6 h、12 h時(P<0.05)(表1)。

表1 NS組和LPS組大鼠動脈血氧分壓(mmHg)的比較(x±s,n=6)
2.1.2 氧合指數(Value of oxygenation index)分析
各組大鼠實驗過程中均自由呼吸,設空氣中氧濃度為21%,氧合指數=動脈血氧分壓/吸入氧濃度,計算得到各組氧合指數數值。
NS組各時間點氧合指數無明顯差異(P>0.05)。LPS組大鼠氧合指數較NS組各相應時間點顯著下降(P<0.05),其中6 h時降至最低,氧合指數為286.7±22.3,明顯低于1 h時(P<0.05),此后逐步回升,24 h時的氧合指數高于6 h和12 h時(P<0.05)(表2)。

表2 NS組和LPS組大鼠氧合指數的比較(x±s,n=6)
2.1.3 動脈血二氧化碳分析
NS組各時間點PaCO2未見明顯差異(P>0.05)。LPS組1 h時PaCO2即降至最低(30.6±4.2 mmHg),此后逐步回升,24 h時的PaCO2高于其他時間點,但仍低于NS組(P<0.05)(表3)。

表3 NS組和LPS組大鼠動脈血二氧化碳分壓(mmHg)的比較(x±s,n=6)
2.2 W/D比值測定
NS組大鼠各時間點W/D比值沒有顯著性差異(P>0.05)。LPS組大鼠W/D比值較NS組相應時間點顯著升高(P<0.05),其中6 h時升至最高,達6.33±0.69,此后逐步回落,LPS組各時間點比較無明顯差異(P>0.05)(表4)。
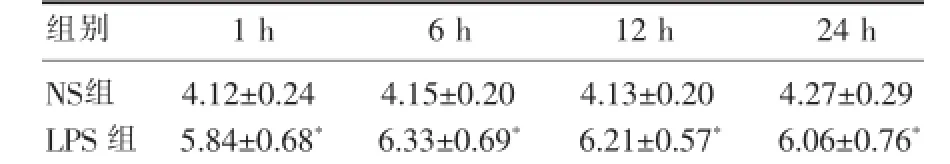
表4 NS組和LPS組大鼠肺組織濕/干重比(W/D)的比較(x±s,n=6)
2.3 肺組織病理形態學觀察
2.3.1 光鏡觀察
光鏡下,NS組大鼠肺泡結構清晰完整,肺泡隔均勻一致,壁薄光滑,肺泡腔中無滲出液或滲出的白細胞,肺間質少量炎細胞浸潤。LPS組1 h時,大鼠肺泡腔及肺間質滲出、水腫、紅細胞外滲,可見部分肺泡、間隔破壞及肺組織結構的毀損,中性粒細胞浸潤;6 h時,肺組織結構毀損、肺間質大量中性粒細胞浸潤及紅細胞大量外滲,可見血管內皮細胞增生;12 h時,肺間質內大量淋巴細胞浸潤;24 h時,紅細胞外滲明顯減少,肺間質內依然以較多淋巴細胞浸潤為主(圖1)。
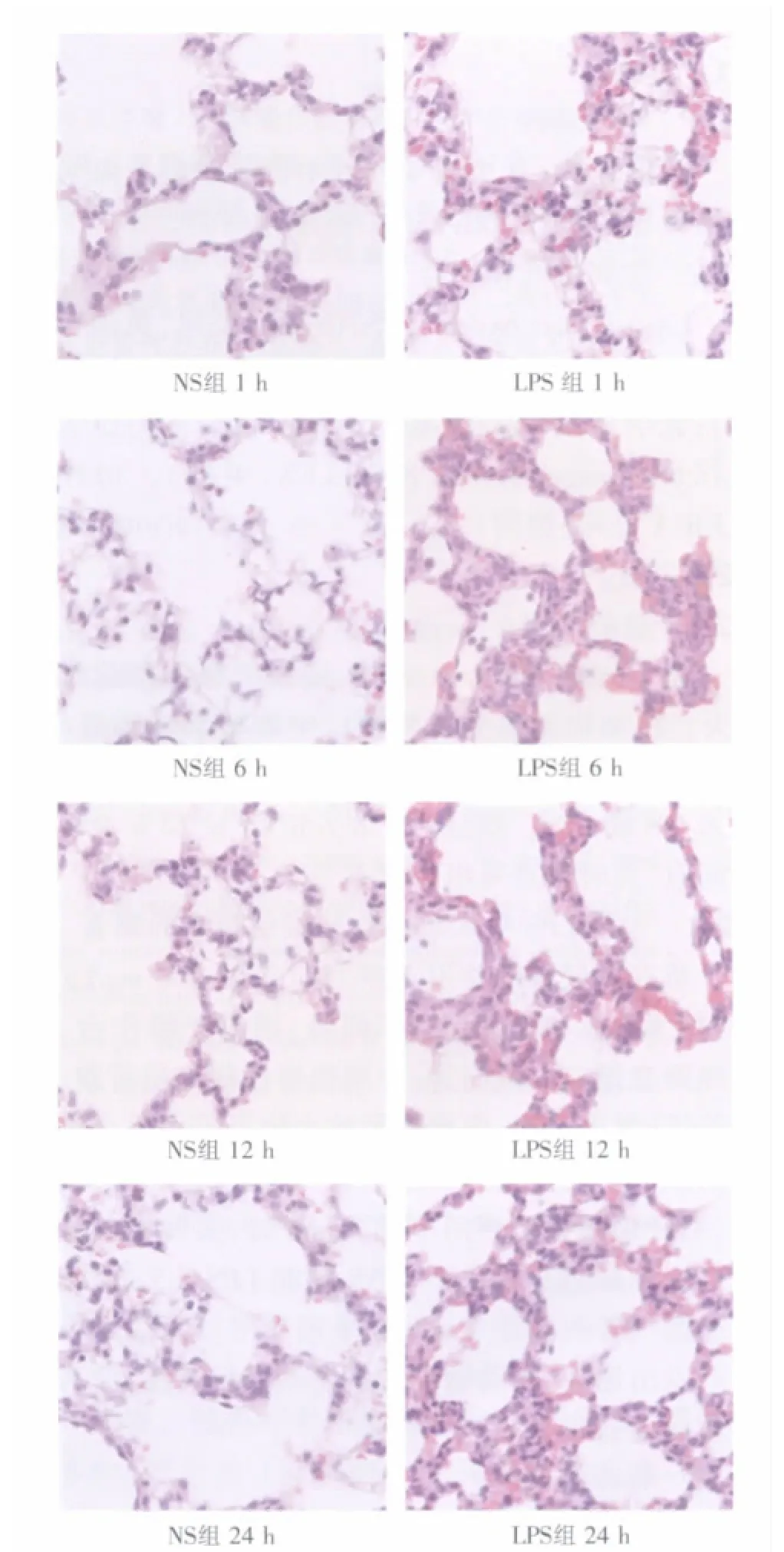
圖1 兩組大鼠致炎后的肺組織病理形態(HE,400×)
2.3.2 肺組織病理半定量評分
比較顯示,NS組各時間點肺組織病理半定量評分沒有顯著性差異(P>0.05)。LPS組肺組織病理半定量評分較NS組相應時間點顯著升高(P<0.05),其中6 h時升至最高,達13.17±0.75,此后逐步回落,LPS組1 h時大鼠肺組織病理半定量評分低于6h、12 h、24 h時(P<0.05)(表5)。

表5 NS組和LPS組大鼠病理半定量評分的比較(x±s,n=6)
3 討論
急性吸入性肺損傷以肺毛細血管床損傷、低氧血癥以及肺順應性減低為特點,是由中性粒細胞、肺泡上皮細胞、單核巨噬細胞以及淋巴細胞等介導的肺過度炎癥反應,是目前危重癥醫學領域的治療難點之一。動物模型的建立對吸入性肺損傷的發病機制、病理生理改變、診斷和治療等方面的研究具有重要意義。
盡管LPS致ALI/ARDS模型,如膿毒癥肺損傷模型已相當成熟,但是通常都是采用靜脈或腹腔注射途徑制備的,所造成的動物肺損傷是全身炎癥反應在肺部的表現,也稱為繼發性肺損傷[7-8]。與這種肺外因素導致的繼發性肺損傷不同,我們所研究的吸入性肺損傷,是致病因子對肺組織的直接損傷,LPS直接作用于肺組織,破壞肺泡引起出血、肺水腫,使壞死組織、炎癥細胞堆積,促使肺泡巨噬細胞和炎癥反應鏈的激活,導致肺內炎癥反應[9],因而肺組織結構損傷更明顯,屬于原發性肺損傷。采用LPS氣管內直接滴注的方式制備模型,符合臨床上誤吸等原因所致ALI/ARDS的病理生理。
目前,國內外對大鼠LPS氣管內滴注法的報道不多,相關文獻中介紹的LPS的配制濃度和致傷劑量差異較大。一般來說,在達到致傷“閾值”之后,LPS劑量越大,ALI程度就越重,并加速了ALI進展至ARDS,使實驗大鼠的存活期縮短,導致實驗觀察窗變小。理想的動物模型應該能觀察到疾病完整的病理生理,以及干預措施下疾病的轉歸,以達到為臨床上設計防治措施的要求。因此,一個“合適”的致傷劑量是整個模型設計的關鍵。通過預實驗我們發現,LPS氣管內滴注法致大鼠急性肺損傷的致傷“閾值”大致為LPS 0.5mg/kg。利用1 mL/kg(濃度0.5 mg/mL)的LPS作為致傷劑,實驗結果顯示,實驗組大鼠致傷后1 h,PaO2即降至70 mmHg,致傷后6~12 h持續在60 mmHg左右,直至24 h后,PaO2才有所回升,但仍明顯低于對照組,符合ALI的持續性低氧血癥表現。參照1992年歐美聯席會議ALI和ARDS診斷標準[10]:ALI診斷標準為氧合指數≤300 mmHg,ARDS診斷標準為氧合指數≤200 mmHg,致傷后6 h、12 h時的氧合指數分別為286.7±22.3和297.2±17.3,達到了ALI的診斷標準,但未達到ARDS診斷標準,且在致傷12 h后氧合指數開始回升,至24 h時達到328.6±22.1,這符合我們建立一個肺損傷程度較輕、可提供較長觀察周期的吸入性ALI的實驗預期。我們還觀察到,實驗組大鼠致傷后呼吸頻率加快,通氣過度,因而PaCO2明顯下降,這與人類ALI早期的臨床表現相似。ALI早期最基本的病理生理改變就是肺血管內皮細胞及肺泡上皮細胞屏障對液體、蛋白通透性的增加,進而導致肺泡水腫。肺組織濕/干重比是反映肺組織水腫程度的良好指標。在我們的實驗中,LPS組大鼠致傷后1 h,肺組織濕/干重比即明顯上升,說明了LPS組大鼠致傷后早期即出現了肺泡毛細血管內皮細胞損傷,通透性增加,進一步表明我們的ALI模型是成功的。另外,我們配制的LPS也未引起大鼠即刻淹溺死亡。
光鏡下觀察肺組織病理形態,我們發現,LPS組大鼠肺組織出現肺間質滲出、水腫、紅細胞滲出及大量炎癥細胞在肺間質內積聚等表現,各時間點肺組織病理半定量評分變化與氧合指數的變化相一致,致傷后6~12 h評分最低。LPS致傷后1 h,以肺間質滲出、水腫和紅細胞滲出為主,屬于典型的ALI的早期病變;致傷后6 h,肺間質可見大量中性粒細胞浸潤;致傷后12~24 h,紅細胞外滲減少,肺間質內淋巴細胞浸潤為主。淋巴細胞是晚期炎癥細胞,結合同期PaO2、PaCO2、W/D比值的變化,我們推斷此時大鼠肺部炎癥開始得到控制。
在模型制備上,我們摒棄了以往常用的大鼠頸部氣管切開或氣管穿刺注射法。該方法雖然操作方便,成功率高,效果肯定,但本身是一種創傷性操作,頸部切口的大小、組織損傷的程度、手術時的無菌程度及術后感染,都會影響大鼠體內炎癥細胞的釋放和炎癥因子的表達,增加了非實驗因素對實驗結果的影響。我們利用大鼠喉鏡暴露聲門,利用注射針通過聲門滴注LPS的方法,效果肯定。最重要的是,此方法下,大鼠無額外的創傷,可以有效減少非實驗因素導致的誤差。此外,相比大鼠頸部氣管切開穿刺法,我們的方法對大鼠氣管的刺激更小,不易導致氣管痙攣。本方法操作時應注意以下幾點:①大鼠必須固定于傾斜的支架上,頭高尾低,以保證LPS注入時不外流;②麻醉深度要合適,過淺的麻醉不利于暴露聲門;③大鼠口腔空間狹小,可用一小號血管鉗將鼠舌拉出口腔;④注射針需特制,彎曲的注射針能方便探到聲門,而且針頭必須磨鈍,不然容易刺透氣管壁而使LPS注射到氣管外,我們采用的是彎曲的7號鈍頭鋼針。
本研究選用1 mL/kg(濃度0.5 mg/mL)LPS作為致傷劑,利用喉鏡暴露聲門進行滴注,成功建立了大鼠吸入性肺損傷模型。本方法無額外創傷,損傷較輕,易于觀察吸入性肺損傷病理生理發展,為進一步研究吸入性肺損傷的病變機制及干預治療奠定了基礎。
[1]Smith Hammond CA,Goldstein LB,Zajac DJ,et al.Assessment of aspiration risk in stroke patients with quantification of volutary cough[J].Neurology,2001,56:502-506.
[2]Nishino T.Physiological and pathophy siological implications of upper airway reflex in humans[J].Japan J Physicl,2000,50:13-14.
[3]Kalyanaraman M,Heidemann SM,Sarnaik AP.Macrophage inflammatory protein-2 predicts acute lung injury in endotoxemia [J].J Investig Med,1998,46(6):275-278.
[4]Rocco PR,Pelosi P.Pulmonary and extrapulmonary acute respiratory distress syndrome:myth or reality[J].Curr Opin Crit Care,2008, 14(1):50-55.
[5]Johnson JL,Hirsch CS.Aspiration pneumonia.Recognizing and managing a potentially growing disorder[J].Postgrad Med,2003, 113(3):99-102.
[6]Mikawa K,Nishina K,Tokao Y,et al.ONO-1714,a nitric oxide synthase inhibitor,attenuates endotoxin-induced acute lung injury in rabbits[J].Anesth Analg,2003,97:1751-1755.
[7]Li CS,Gui PC,He XH.Experssion of intercellular adhesion molecule in lung tissues of experimental acute lung injury and the affect of rhubarb on it[J].Chin Med Sci J,2000,15(2):93-97.
[8]Gao J,Zeng BX,Zhou LJ,et al.Protective effects of early treatment with propofol on endotoxin-induced acute lung injury in rats[J]. Br J Anaesth,2004,92(2):277-279.
[9]Martin TR.Direct lung injury by bacteria:clarifying the tools of the trade[J].Crit Care Med,2004,32(11):2360-2361.
[10]Bernard GR,Artigas A,Brtigham KL,et al.Report of the American European consensus conference on ARDS:definitions,mechanisms, relevant outcomes and clinical trial coordination[J].Intensive Care Med,1994,20(3):225.
Study on Lipopolysaccharide(LPS)-Induced Aspiration Lung injury in Rats
YAN Weimin1,JIANG Hong1,CHEN Wantao2.
1 Department of Anesthesiology;2 Department of Oral and Maxillofacial.Shanghai Ninth People′s Hospital, Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:CHEN Wantao.
ObjectiveTo establish a rat model of aspiration lung injury(ALI)caused by airway lipopolysaccharide(LPS) inhalation,and to provide an experimental basis for its pathophysiological and clinical therapy.MethodsForty-eight adult male Sprague-Dawley(SD)rats were randomly divided into 2 groups(n=24):negative control group(NC group)and experimental group(LPS group).The rats were made aspiration lung injury(ALI)model by intratracheal instillation of 1 mL/kg (0.5 mg/mL)LPS group and 0.9%NS(1 mL/kg)in NS group.The rats were randomly assigned to four subgroups(n=6)to be sacrificed at 1,6,12,and 24 hours after intratracheal injection.Other observation parameters included arterial blood gas,W/D ratio of lung tissue,and pathological changes of the lung under light microscopy.ResultsUnlike NS group,the rats in LPS group presented sustained hypoxemia,reduced pressure of carbon dioxide in arterial blood(PaCO2)at the four time-points, increase in W/D ratio and oxygenation index in all the subgroups(P<0.05),and obvious interstitial changes suggested ALI such as exudation,edema,infiltration by lots of inflammatory cells,and leakage of red blood cells.ConclusionA rat model of ALI could be established by intratracheal instillation of LPS via laryngoscopy,which is very useful for further research on pathology and intervention therapy.
Aspiration lung injury;Inflammation;Lipopolysaccharides;Model
R971+.2
A
1673-0364(2010)02-0096-05
2009年11月30日;
2010年3月2日)
10.3969/j.issn.1673-0364.2010.02.010
200011上海市上海交通大學醫學院附屬第九人民醫院麻醉科(嚴偉民,姜虹);口腔頜面外科(陳萬濤)。
陳萬濤。

