二穗短柄草幼胚再生體系及農桿菌介導轉化的初步研究
吳雪莉,劉金星,Klaus K Nielsen,楊志民*,高彩霞,*
(1.南京農業大學園藝學院,江蘇 南京210095;2.中國科學院遺傳與發育生物學研究所,植物細胞與染色體工程國家重點實驗室,北京100101;3.Research Division,DLF-TRIFOLIUM A/S,丹麥466060)
二穗短柄草(Brachypodiumdistachyon)是溫帶一年生禾本科早熟禾亞科短柄草屬植物。原產于非洲北部、歐洲南部和亞洲中部,包含約10個亞種[1],它與大多數的禾草親緣關系很近,與小麥(Triticumaestivum)、大麥(Hordeumvulgare)、燕麥(Avenasativa)等糧食作物的親緣關系比水稻更近[2-4]。水稻作為禾草最基本的模式植物[5,6],其生長周期長,對生長環境要求高,尤其是在高產基因實驗方面要求更高,此外,它屬于稻亞科,與早熟禾亞科之間的親緣關系較遠,因而并不是理想的禾草模式植物。而二穗短柄草在很多方面與擬南芥(Arabidopsisthaliana)有共同特點,擁有模式植物必備的物理特性和生物學特性[7-15]:基因組小、染色體少、DNA重復序列少、植株較矮、生長周期短、自花授粉等。與小麥族植物一樣具有二倍體、四倍體和六倍體,且不需要嚴格的生長條件和栽培措施,可以作為一種新型的禾草模式植物。目前,人們已經開始對二穗短柄草進行多方面的研究,從而更全面地確認它作為模式植物的必然性。
遺傳轉化體系的建立是模式植物作為有效工具的關鍵,開展關于二穗短柄草遺傳轉化方面的研究具有重要意義。近幾年來,短柄草越來越引起國內外分子生物學研究者的重視,對其植物學特性、細胞遺傳學特性、分子生物學特性、基因組學發掘、組織培養和遺傳轉化性能等進行了研究,但目前國內尚未見有關二穗短柄草遺傳轉化方面的研究報道。本試驗以國際短柄草協會正在構建遺傳連鎖圖的二穗短柄草BD21和BD21-3品系及植株健壯、生長迅速的BDR018品系的幼胚為材料,研究了幼胚大小對胚性愈傷組織誘導及再生的影響,并探討了愈傷組織年齡及浸染過程中的不同處理對農桿菌介導的BDR018遺傳轉化效率的影響,對建立高效穩定的二穗短柄草離體再生和遺傳轉化體系具有重要意義。
1 材料與方法
1.1 植物材料
2008年5月選取國際短柄草協會正在構建遺傳連鎖圖的二穗短柄草BD21和BD21-3品系及植株健壯、生長迅速的BDR018品系的幼胚為材料,每個處理設3個重復,取抽穗2周左右的幼嫩籽粒,用1.5%的次氯酸鈉消毒15~20 min,無菌水沖洗5~6次,于超凈工作臺內剝取幼胚,置于誘導培養基上,26~28℃、黑暗條件下誘導胚性愈傷組織,5 d左右拔除幼芽。愈傷組織每2周在相同培養基上繼代1次。
1.2 農桿菌菌株和質粒
本研究采用根癌農桿菌菌株AGL1,質粒載體PDM805如圖1[內含bar基因(膦絲菌素乙酰轉移酶基因)和gus報告基因(β-葡萄糖醛酸糖苷酶基因)]由丹麥DLF公司提供。
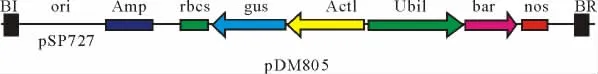
圖1 質粒p DM805結構示意圖Fig.1 Map of plasmid pDM805
1.3 幼胚離體培養基
MS基本培養基:MS大量元素+MS微量元素+MS鐵鹽+MS有機成分+MS維生素。
誘導培養基(MS2.5):MS基本培養基+2,4-二氯苯氧乙酸(2,4-D)(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+CuSO4(0.6 mg/L)+蔗糖30 g/L+結冷膠(Gelrite)3.75 g/L。
選擇誘導培養基(MS2.5-5B-Cefo200):MS基本培養基+2,4-D(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+Cu-SO4(0.6 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L+雙丙氨磷(Bialaphos)(5 mg/L)+頭孢噻肟(Cefotaxime)(400 mg/L)。
再生培養基(M1G):MS基本培養基+激動素 Kinetin(0.2 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L。
選擇再生培養基(M1G-5B-Cefo200):MS基本培養基+Kinetin(0.2 mg/L)+蔗糖30 g/L+Gelrite 3.75 g/L+Bialaphos(5 mg/L)+Cefotaxime(400 mg/L)。
壯苗培養基:1/2 MS基本培養基+蔗糖30 g/L+Gelrite 3.75 g/L。上述所有培養基均調p H值至5.8,121℃高壓蒸汽滅菌20 min。
1.4 幼胚愈傷組織的遺傳轉化
從-80℃冰箱中取出含有質粒p DM805的農桿菌AGL1[9]菌液200μL(保存于15%甘油中,農桿菌與甘油1∶1混合),接種于20~25 m L含有50 mg/L利福平以及20 mg/L四環素的YEP(酵母菌)液體培養基中,28℃,200 r/min振蕩培養12~18 h。當培養至OD600值為0.6~1.0后,將培養物于4 300 r/min離心10 min,收集菌體。用 MS 2.5液體培養基[MS基本培養基+2,4-D(2.5 mg/L)+水解酪蛋白(0.5 mg/L)+CuSO4(0.6 mg/L)+蔗糖30 g/L,p H 值5.8]洗滌2次后重新懸浮,調至OD600值為0.6~1.0。
選擇顏色鮮黃,生長旺盛,結構密實的BDR018胚性愈傷組織(顆粒大小為1~2 mm),于農桿菌菌液中浸染15~20 min,吸去菌液,并用滅菌濾紙吸干愈傷組織表面的菌液,轉移到蓋有濾紙的誘導培養基上,26~28℃,暗培養48~72 h后,將共培養的愈傷組織用含有頭孢霉素(Cefotaxime,200 mg/L)的無菌水漂洗2~3次,每次1 min左右,將愈傷組織上的水分吸干,置于空培養皿中12~24 h,MS2.5液體培養基漂洗1次后轉移到選擇誘導培養基上,26~28℃,暗培養2~3周。
1.5 轉化體的篩選與抗性植株再生
轉化2~3周后,將愈傷組織繼代到新的選擇誘導培養基上,于光照培養箱(25℃,16 h光照,8 h黑暗)培養。每2周繼代1次。2次繼代后,將抗性愈傷組織轉移到選擇再生培養基上培養。待抗性再生綠苗長至3~4 cm時,轉移至壯苗培養基內,待抗性再生苗具有較健壯的根后,轉入花盆中,于溫室內種植。
1.6 GUS基因化學組織檢測
將抗性再生植株葉片浸于X-Gluc溶液[含乙二胺四乙酸(EDTA)10 mmol/L、磷酸緩沖液100 mmol/L、亞鐵氰化鉀0.5 mmol/L、高鐵氰化鉀0.5 mmol/L、20%(V/V)甲醇和0.1%X-Gluc(W/V)]中,37℃下保溫數小時,96%乙醇脫色,觀察藍色反應。
1.7 轉化植株的PCR(聚合酶鏈反應)鑒定
取抗性再生植株和未轉化植株葉片,用十六烷基三甲基溴化銨(CTAB)法[10]微量提取植物DNA。本試驗擴增bar基因片斷的引物為 MS126(5′-GGATCTACCATGAGCCCAGA-3′)和 MS127(5′-TGCCTCCAGGGACTTCAG-3′)。PCR所用Taq酶、d NTP等購于Ampliqon公司,引物由Invitrogen公司合成。PCR擴增外源目的基因的大小約為357 bp。
1.8 數據統計
成愈率(%)=愈傷組織數/接種幼胚數×100%。再生率(%)=再生綠苗數/愈傷組織數×100%。白化率(%)=再生白化苗數/愈傷組織數×100%。
2 結果與分析
2.1 幼胚大小對胚性愈傷組織誘導的影響
根據幼胚(胚軸方向)長度將其分成3類即:Ⅰ類:幼胚長度小于0.5 mm(圖2A);Ⅱ類:幼胚長度介于0.5~1.0 mm之間 (圖2B);Ⅲ類:幼胚長度大于1.0 mm(圖2C)。2周后,統計幼胚的成愈率(表1)。
Ⅰ類幼胚,透明,胚的形狀稍不明顯。誘導過程中,出芽率極低,生長速度慢,胚性愈傷組織顏色鮮黃,顆粒致密緊實。Ⅱ類幼胚,半透明,胚的形狀明顯,出芽率較低,胚性愈傷組織顏色鮮黃,顆粒致密緊實,生長速度快于Ⅰ類,少量愈傷組織略帶水浸狀。Ⅲ類幼胚,不透明,近乳黃色,與成熟胚相似,出芽率高,生長速度快,但水浸狀愈傷組織較多。
二穗短柄草3個品系 BD21,BDR21-3,BDR018的成愈率與幼胚大小有關(表1)。Ⅰ類幼胚成愈率最低,Ⅱ類幼胚成愈率最高,Ⅲ類幼胚成愈率介于Ⅰ類幼胚和Ⅱ類幼胚之間。相同幼胚大小,不同品系的幼胚成愈率也不同。Ⅰ類幼胚中BDR018的成愈率最低,僅13.8%。Ⅱ類幼胚中BD21的成愈率最高,達87.8%,BDR21-3和BDR018的成愈率分別為85.6%和72.9%。Ⅲ類幼胚中BD21的成愈率最高,各品系成愈率均在50%左右。由此可見,長度介于0.5~1.0 mm之間的Ⅱ類幼胚,成愈率最高且愈傷組織顆粒致密,結構緊實,顏色鮮黃,生長速度較快,適合用于農桿菌轉化受體的愈傷組織誘導培養。
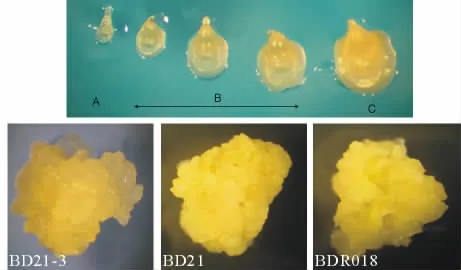
圖2 幼胚大小和愈傷組織Fig.2 Size of immature embryo and embryonic calluses of
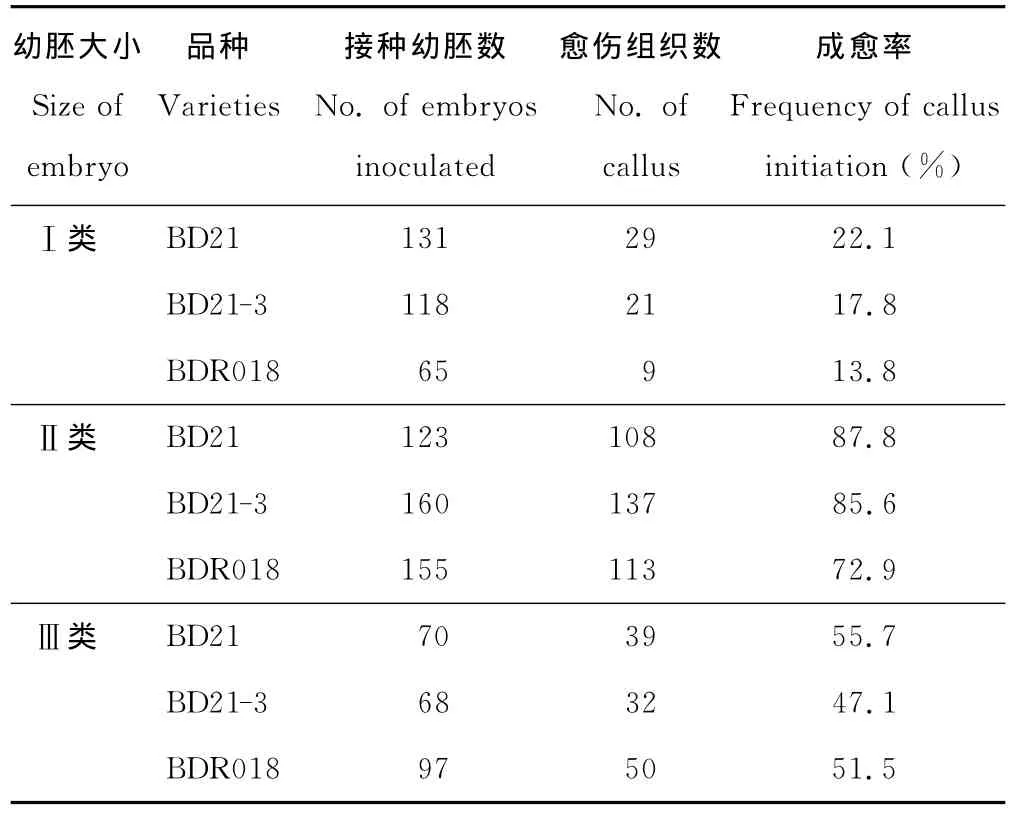
表1 幼胚大小對二穗短柄草幼胚成愈率的影響Table 1 Effect of embryo size on frequency of calli initiation in three B.distachyon accessions
2.2 愈傷組織年齡對愈傷組織分化的影響
將誘導出的胚性愈傷組織,按照不同年齡,接種在再生培養基上(M1G)于光照培養箱(25℃,16 h光照,8 h黑暗)進行分化培養。3周后統計再生率和白化率(圖3)。
隨愈傷組織年齡的增加,BDR018,BD21,BD21-3愈傷組織的再生率下降,白化率上升。愈傷組織年齡為5周時再生率最高,分別為100%,100%和85.3%(圖3)。21周時再生率最低,分別為14.7%,30.3%和17.6%。5周時各品系的白化率最低。其中BDR018和BD21的白化苗和非再生愈傷組織從8周開始出現,而BD21-3從5周開始已有非再生現象產生。BDR018和BD21的胚性愈傷組織在5~8周范圍內具有高的再生率和低的白化率,BDR018的再生率較其他2個品系最高。BDR018、BD21和BD21-3的再生率大于60%的愈傷組織,年齡分別為18,15,11周。綜合上述BDR018的胚性愈傷組織的成愈率及分化再生率均較高,且可作為遺傳轉化受體材料的愈傷組織年齡范圍最寬。以下遺傳轉化試驗均以BDR018胚性愈傷作為轉化受體。
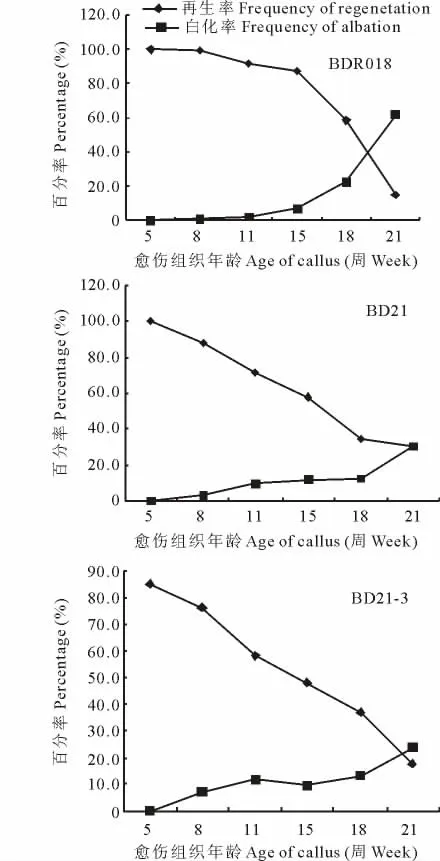
圖3 愈傷年齡對愈傷組織分化的影響Fig.3 Effect of different age of callus on differentiation in three B.distachyon accessions
2.3 愈傷組織年齡對轉化的影響
以5,8,11,15,18,21周的BDR018胚性愈傷組織為受體材料,菌體由MS2.5液體培養基重新懸浮,菌液中加入0.01%的Silwet L-77,混合均勻,浸染愈傷組織15~20 min進行遺傳轉化,統計轉化率(轉化率=抗性再生植株數/愈傷組織數)。結果表明(表2),愈傷組織年齡為5~8周時轉化率較高,平均轉化率為39.6%和37.4%。隨著愈傷組織年齡的增加,轉化率明顯降低。21周時轉化率最低僅2.8%。不同年齡愈傷組織的平均轉化率為21.4%。
2.4 真空處理和Silwet L-77處理對轉化的影響
以5周的BDR018愈傷組織為受體材料進行遺傳轉化,比較了不同處理對轉化率的影響。Ⅰ處理為對照,菌體在MS2.5液體培養基中重新懸浮后直接浸染愈傷組織;Ⅱ處理在菌體由MS2.5液體培養基重新懸浮后,在菌液中加入0.01%的Silwet L-77,混合均勻浸染愈傷組織。Ⅲ處理的菌液與Ⅰ對照處理相同,愈傷組織于空培養皿中,加入菌液浸染30 min,其間將培養皿放入基因槍真空室中進行真空處理,真空室內壓力保持50 m bar,處理時間為5 min。
結果表明(表3),真空處理和0.01%的Silwet L-77處理均可顯著提高轉化率。真空處理和0.01%Silwet L-77處理的平均轉化率分別為39.6%和41.0%,顯著高于對照的平均轉化率14.1%,真空處理和0.01%的Silwet L-77處理的轉化率相近。
2.5 GUS檢測結果
待抗性植株移至溫室后,取植株新鮮葉片進行gus基因化學組織檢測,葉片GUS染色結果從無色到深藍色表現不一致(圖4),無色的葉片說明GUS基因未在植物中表達,淺藍色和深藍色葉片說明GUS基因已經在植物中得到穩定表達。
2.6 轉基因植株的PCR檢測
隨機選取12株轉基因抗性植株和2株非轉基因對照植物進行PCR檢測。結果表明,除了非轉基因對照植物以外,所有的轉基因植株均擴增出了357 bp的bar基因DNA片斷(圖5),證明bar基因已整合進二穗短柄草基因組中。
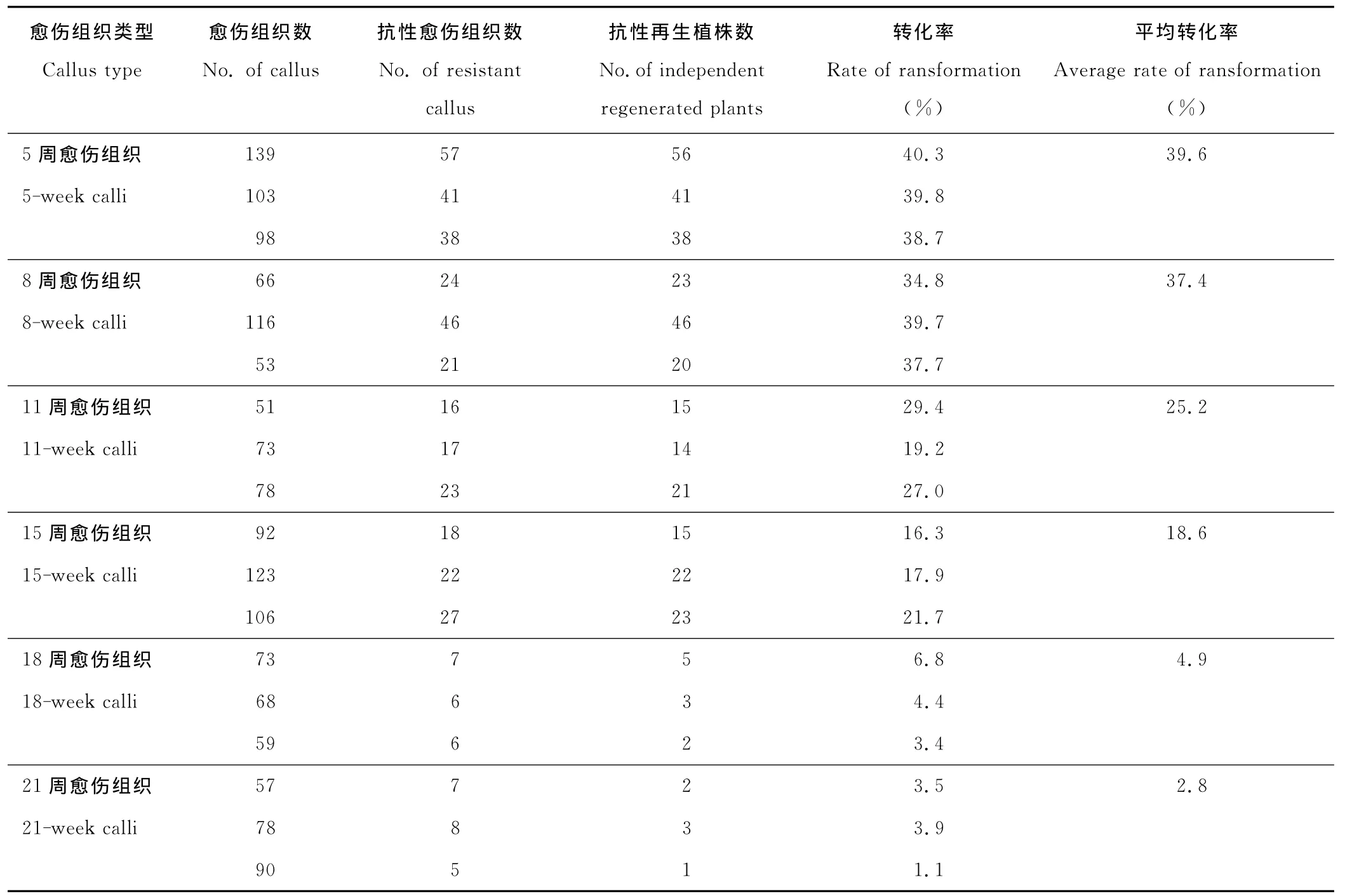
表2 愈傷組織年齡對轉化率的影響Table 2 Effect of different age of calli on the efficiency of transformation
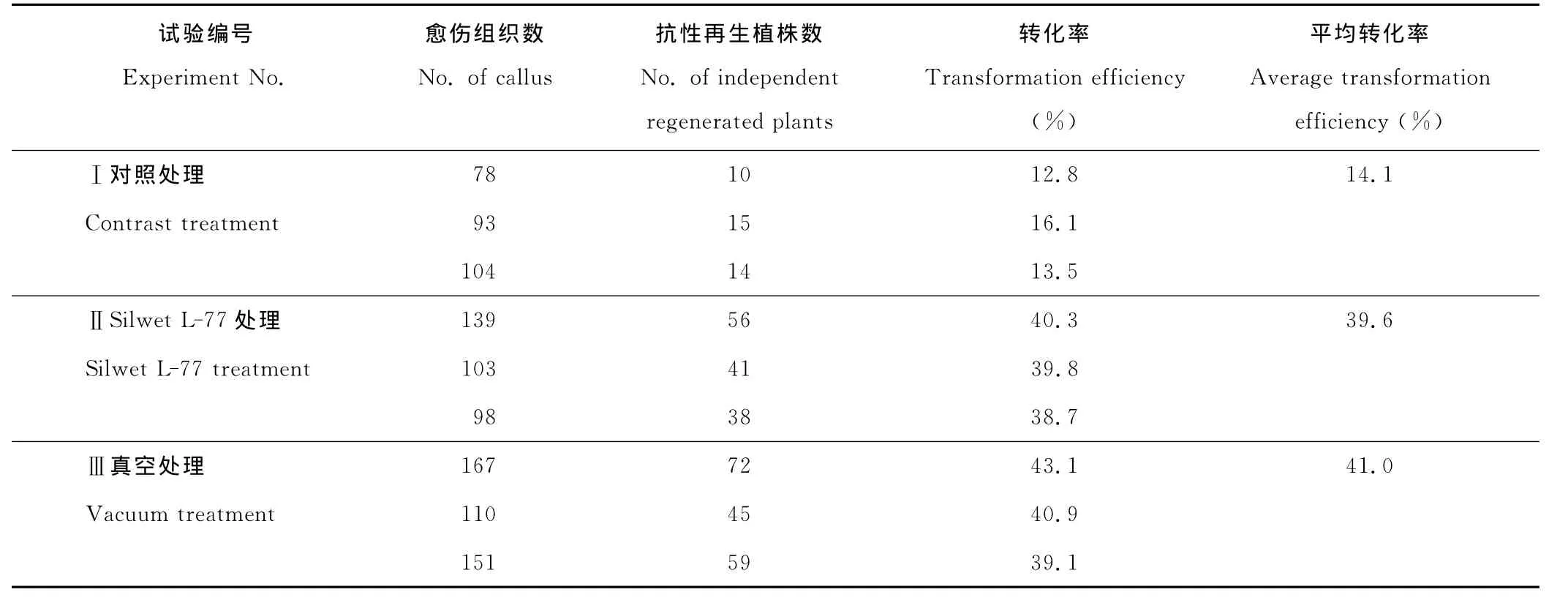
表3 真空處理和0.01%Silwet L-77處理對轉化率的影響Table 3 Effect of vacuum infiltration or 0.01%Silwet L-77 on the efficiency of transformation
3 討論
高頻的離體再生系統及穩定的外植體來源是轉化受體系統必備的條件,也是影響遺傳轉化效率提高的重要因素。在禾谷類轉基因研究中,雖然成熟胚取材和操作方便,生理狀態一致,是組織培養和遺傳轉化理想的外植體,但幼胚再生能力較高,在成熟胚高頻率再生體系尚未建立的情況下,幼胚培養具有重要作用。研究表明幼胚大小介于0.5~1.0 mm之間時,胚性愈傷組織的誘導率最高。大于1.0 mm的幼胚愈傷組織誘導率均在50%左右,且出芽率較高,水浸狀愈傷組織較多,這可能是由于較大的幼胚接近于成熟胚,具有較高的分化程度,而脫分化和再生能力下降。這與Draper等[2]對幼胚大小的研究具有相似結論,取二穗短柄草二倍體基因型ABR1不同大小的未成熟胚分別接種在LS和N6附加2.5 mg/L 2,4-D培養基上誘導愈傷組織,長度0.3~0.7 mm的未成熟胚誘導愈傷組織的潛力最大,在LS2.5培養基上胚性愈傷組織誘導率為45%,胚性愈傷組織白苗分化率僅為7%,而在N62.5培養基產生的胚性愈傷組織白苗分化率高達45%。但Draper等[2]是以二穗短柄草二倍體基因型ABR1為材料,而相同幼胚大小,不同基因型的誘導率之間仍存在顯著差異。BD21誘導率最高達87.8%,BD21-3和BDR018誘導率分別為85.6%,72.9%。BD21和BDR018的誘導率均高于他人報道的68%和46%,而BD21-3的誘導率低于Philippe等[11]的研究結果94%,這可能與基因型對誘導培養基的選擇有關[12]。
愈傷組織年齡對不同基因型的愈傷組織的分化再生具有顯著影響。研究表明,在5~8周內胚性愈傷組織具有較高再生率,為轉化提供了良好的受體系統。這一結果與Christiansen等[13]對二倍體基因型和四倍體基因型幼胚培養的研究相同。BDR017、BDR030、BDR001和BDR018愈傷組織愈齡3~6周時的再生率為90%~100%,8周時的再生率低于80%,培養時間越長再生率越低,如BDR017、BDR030愈傷組織培養16周時的再生率分別為30%和55%。

圖4 GUS染色Fig.4 GUS staining
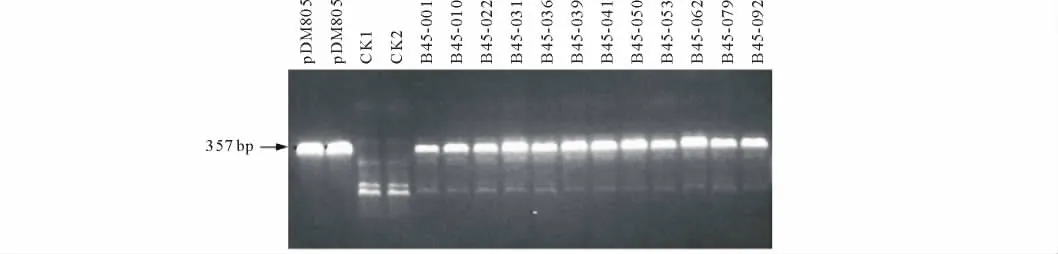
圖5 PCR檢測bar基因在轉基因植株中的表達Fig.5 Expression of bar in transgenic plants
農桿菌介導二穗短柄草的遺傳轉化研究,主要集中于對BD21的轉化研究,而對BDR018的研究目前僅有少數,國內尚未見關于BDR018遺傳轉化的研究報道。Vogel和Leong等[14]利用幼胚和成熟胚來源的胚性愈傷組織及AGL1菌系和p OL001載體首次開展了農桿菌介導轉化短柄草的研究,14個基因型中有10個獲得了轉基因植株,轉化率0.4%~15.0%。Christiansen等[13]用基因槍轉化法對BDR018幼胚的胚性愈傷組織進行轉化平均轉化率5.3%,Vain等[15]用農桿菌轉化法對BDR018幼胚愈傷組織進行轉化,BDR018農桿菌轉化的效率高達55%,高于本實驗中愈齡為5周的BDR018胚性愈傷組織的最高轉化效率40.3%和真空處理5 min的最高轉化效率43.1%。原因可能是由于實驗中轉化的愈傷組織年齡為5周高于前兩者作為受體材料的愈傷組織年齡,但是由于培養5周的愈傷組織可以獲得更多的轉化受體材料,因此雖然轉化效率稍低,但仍具有重要的意義。浸染過程中,真空處理5 min和菌液中加入0.01%的Silwet L-77,均可提高轉化效率。真空處理可提高轉化率可能是由于真空使浸染環境產生負壓,使菌液充滿微孔從而提高轉化效率。苜蓿(Medicagosativa)[16]、結縷草(Zoysiajaponica)[17]、花生(Arachishypogaea)[18]等的遺傳轉化中利用負壓處理,轉化效率也得到不同程度的提高。
[1]Tateoka T.Proposition of a new phylogenic system of Poaceae[J].Japan Bot,1957,32:275-287.
[2]Draper J,Mur L A J,Jenkins G,etal.Brachypodiumdistachyon:A new model system for functional genomics in grasses[J].Plant Physiology,2001,127:1539-1555.
[3]Kellogg E A.Evolutionary history of the grasses[J].Plant Physiology,2001,125:1198-1205.
[4]Gaut B S.Evolutionary dynamics of grass genomes[J].New Phytologist,2002,154:15-28.
[5]Havukkala I J.Cereal genome analysis using rice as a model[J].Current Opinion in Genetics & Development,1996,6:711-714.
[6]Tyagi A k,Mohanty A.Rice transformation for crop improvement and functional genomics[J].Plant Science,158:1-18.
[7]Shi Y,Draper J,Stace C.Ribosomal DNA variation and its phylogenetic implication in the genusBrachypodium(Poaceae)[J].Plant Syst Evol,1993,188:125-138.
[8]Vogel J,Garvin D,Leong O,etal.Agrobacteriummediated transformation and inbred line development in the model grassBrachypodiumdistachyon[J].Plant Cell,Tissue and Organ Culture,2006,85:199-211.
[9]Tingay S,McElroy D,Kalla R,etal.Agrobacteriumtumefaciens-mediated barley transformation[J].Plant Journal,1997,11:1369-1376.
[10]楊成麗,劉樹楠,周吉源,等.高效煙草遺傳轉化體系的建立及甜蛋白基因的導入[J].生物技術,2004,14:9-11.
[11]Philippe V,Barbare W,Vera T,etal.Agrobacterium-Mwndiated transformation of the temperate grassBrachypodium distachyon(genotype BD21)for T-DNA insertional mutagenesis[J].Plant Biotechnology,2008,6(3):236-245.
[12]Cheng Ming.Invited review:Factors influencingAgrobacterium-mediated transformation of monocotyledonous species,In Vitro Cell.Dev[J].Biology of Plant,2004,40:31-45.
[13]Christiansen P,Didion T,Andersen C H,etal.A rapid and efficient transformation protocol for the grassBrachypodium distachyon[J].Plant Cell Reports,2005,23:751-758
[14]Vogel J P,Leong O M.Agrobacterium-mediated transformation of the model grassBrachypodiumdistachyon(abstract)[J].In Vitro Cellular and Developmental Biology,2004,40:29.
[15]Vain P,Worland B,etal.Agrobacterium-mediated transformation of the temperate grassBrachypodiumdistachyon(genotype Bd21)for T-DNA insertional mutagenesis[J].Plant Biotechnology,2008,6:236-245.
[16]黎茵,黃霞,黃學林.根癌農桿菌介導的苜蓿體胚轉化[J].植物生理與分子生物學學報,2003,29(2):109-113.
[17]張磊,吳殿星,胡繁榮,等.結縷草組織培養及農桿菌介導轉化的主要因子優化[J].草業學報,2004,13(4):100-105.
[18]鄒湘輝,莊東紅,胡忠,等.負壓和超聲波處理對農桿菌介導的花生遺傳轉化效率的影響[J].中國油料作物學報,2004,26(1):12-16.

