丹參飲對2型糖尿病性心肌病大鼠心肌的保護作用*
倪 青,王 階△,趙安斌,于 斌,王 敏,黃春榮,李恩慶
(1.中國中醫科學院廣安門醫院,北京 100053;2.暨南大學醫學院,廣東廣州 510632)
糖尿病心肌病(DCM)是糖尿病患者心肌細胞原發性損傷引起廣泛的結構異常,最終引起左心室肥厚、舒張期和(或)收縮期功能障礙的一種疾病狀態,是心肌對糖尿病的急性反應而導致的慢性病理改變。臨床研究多中心1278例糖尿病合并冠心病住院病人在院治療情況發現,丹參飲使用頻率很高,開展本研究旨在驗證丹參飲對治療糖尿病心肌病的機制。
1 材料與方法
1.1 主要試劑與儀器
Trizol購自invitrogen生物技術科技公司,RNA逆轉錄試劑盒購自上海貝博生物技術公司,實時熒光定量PCR試劑盒購自genecopoeia生物技術公司,TSP-1、TGF-β1、tribble-3 和 chymase 單克隆抗體購自美國 santa cruze生物技術公司,A-TGFβ1和 LTGF-β1多克隆抗體購自武漢博士德生物技術公司,ABC檢測試劑盒購自美國vectro生物技術公司,BCA蛋白定量試劑盒購自上海貝博生物試劑公司,鏈尿佐菌素購自Sigma生物技術公司。丹參飲(丹參30g,檀香6g,砂仁6g)購自暨南大學附屬第一醫院中醫科,以上藥物丹參和檀香以10倍量水,煎煮1.5h后入砂仁10min,濾出藥液后以6倍量水煎煮1h,合并2次藥液,過濾并最后濃縮至0.6g/ml。
1.2 動物與造模方法
雄性SD大鼠42只,體重200g±20g,購自北京維通利華實驗動物技術有限公司。隨機分為3組:正常組(n=12)只,對照組(n=15)和丹參飲組(n=15)。正常組喂以標準大鼠飼料,對照組及丹參飲組喂以高脂高熱量飼料。4周后給予對照組及丹參飲組大鼠1次性腹腔注射鏈脲佐菌素50mg/kg,正常組大鼠給予同等劑量檸檬酸鈉緩沖液腹腔注射;各組以原飼料繼續喂養1周后,測定血糖,對照組及丹參飲組連續2次血糖≥16.7 mmol/L且有多飲、多食、多尿的大鼠納入實驗,共有38只大鼠納入實驗(正常組12只,對照組和丹參飲組各13只)。各組大鼠繼續以原飼料喂養9周,同時丹參飲組每天予以丹參飲7.5ml/kg灌胃,模型組予以等量蒸餾水灌胃。分別在實驗第8周、11周、14周禁食12h后殺死各組大鼠4只,心房取血,離心保留血清-20℃保存以備檢測血脂、血糖、甘油三酯。采血完畢迅速處死大鼠取出心臟,冰鹽水沖洗,剪除包膜、血管,稱重并計算心臟重量指數,垂直于心臟左室長軸對稱中點上下切取部分心肌,分別放入10%中性甲醛及2.5%戊二醛中固定,其余部分組織放入-80℃冰箱中保存。共有34只大鼠完成實驗(模型組死亡1只,丹參飲組死亡1只,死亡原因可能為糖尿病并發癥或感染)。
1.3 心電圖觀察心肌損傷程度
大鼠給予1%戊巴比妥納2ml/kg腹腔注射后做心電圖。
1.4 檢測血糖甘油三酯總膽固醇的變化
心房取血5ml,離心保留血清-20℃保存以備檢測血脂、血糖、甘油三酯。
1.5 HE染色
10%中性甲醛固定心肌組織標本,石蠟切片,行常規HE染色,光鏡下觀察心肌病理損害并拍照,結合超微結構的改變來評價心肌的病變。
1.6 透射電鏡觀察
在左心室中部留取小塊組織,以2.5%戊二醛固定10min后細切(1.0×1.0mm),再固定12h,1%鋨酸固定1h,乙醇、丙酮梯度脫水,環氧樹脂包埋,超薄切片機制備超薄切片,電子染色,在荷蘭PHILIPSTECNAI-10型透射電子顯微鏡觀察心肌超微結構并攝片。
1.7 Masson染色
常規石蠟切片脫蠟后,行Masson染色,光鏡下觀察心肌細胞呈紅色或黃色,膠原纖維呈藍綠色,HMIAS彩色醫學圖文分析系統定量分析切片每個視野中CVF(CVF=同一圖像中膠原面積/所測視野面積),排除富含膠原的血管和疤痕區域。每個切片選取5個視野,最后取其均數。
1.8 Tunel細胞凋亡試劑盒檢測細胞凋亡
常規石蠟切片脫蠟后,按試劑盒說明依次滴加試劑,熒光顯微鏡下觀察,激發波長 450nm~500nm,發射波長515nm~565nm。每張玻片選取熒光表達最強的3~5個視野觀察并由計算機自帶掃描分析軟件測定熒光強度與面積。指標的熒光值=平均熒光強度×平均熒光面積。
1.9 實時熒光定量PCR
RNA提取與cDNA的合成:采用Trizol按試劑盒說明提取RNA,經紫外分光光度計檢測RNA純度和濃度,經電泳法檢測其完整性。按逆轉錄試劑盒說明進行逆轉錄。取2μl逆轉錄產物進行Reamtime PCR檢測。
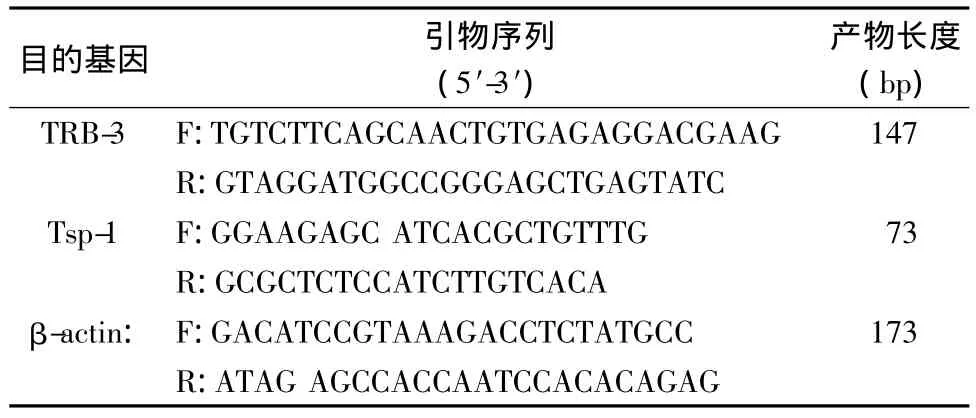
表1 引物序列(5′-3′)
引物由上海生工生物工程技術服務有限公司合成。
反應體系:2 ×AllinoneTM Q-PCR MIX 10μl,ddH2O 1μl,Forward Primer(4μM)2μl,Reverse Primer(4μM)2μl,Template cDNA 5μl。Total:20μl。
反應條件:預變性:95℃ 1min;變性:95℃ 15s;退火:60℃ 30s;延伸:72℃ 30s,共40個循環。
1.10 免疫組化染色
載玻片采用多聚賴氨酸行防脫片劑處理,常規石蠟切片脫蠟,0.3%H2O2封閉。置0.01 mol/L pH 6.0檸檬酸鹽緩沖液中行微波修復抗原(中檔火8min~10min,自然冷卻到室溫,反復3次)。山羊血清封閉,依次加入Ⅰ抗(1∶100小鼠抗 tsp-1,Santa Cruz)、生物素標記的山羊抗小鼠IgG和辣根過氧化物酶標記的卵蛋白-生物素,37℃孵育30 min。以DAB顯色,脫水、透明、封片。陰性對照用PBS代替Ⅰ抗。用Leica Qwin Plus分析系統對染色后的圖片進行灰度分析,對每張切片隨機選取5個不重復的陽性反應視野照像,計算其平均灰度值。
1.11 Western blotting檢測蛋白表達情況
于超凈工作臺上,剪取約100mg組織,加入細胞裂解液400μl,于冰上研磨,轉入1.5ml離心管中,于冰上裂解30min后,4℃ 12000r/10min,取上清液到1.5ml離心管中,此即為蛋白樣品,-80℃冰箱中保存。取上述蛋白樣品40μl,BCA試劑盒蛋白定量,繪制標準曲線。以上蛋白樣品(取20μg)經10%聚丙烯凝膠電泳分離后進行轉膜(濕轉),恒流(GAPDH:240MA,50min;tsp-1:240MA,140min)將蛋白轉移到PVDF膜(孔徑0.45μm)上。然后在封閉緩沖液(5%脫脂牛奶或BSA)中封閉1h,將膜放入封閉緩沖液稀釋的Ⅰ抗(稀釋比例:GAPDH:1∶100 稀釋,tsp-1:1∶200 稀釋;A-TGF-β1:1∶100;LTGF-β1:1∶100)中進行免疫反應,室溫下持續搖動孵育2h,然后4℃過夜。1×PBST洗滌4次,每次5min。將膜用PBST緩沖液稀釋的辣根過氧化物酶(HRP)標記的Ⅱ抗(1∶6000稀釋),室溫孵育50min,1×PBST洗滌4次,每次5min。于暗室中滴加新鮮配制的ECL顯色液0.6ml(A、B液等體積混勻),膜孵育1 min,封入保鮮膜中,壓片,顯影于感光膠片上。以上步驟獨立重復3次。用Bandleader 3.0軟件對條帶進行灰度掃描,按下述公式分別計算3次實驗中樣品蛋白的相對含量:蛋白相對含量(該蛋白條帶的灰度值-背景的灰度值)/(內參條帶的灰度值-背景的灰度值),以此比值計算均數與標準差。
1.12 統計學處理
所有數據用SPSS 13.0統計軟件包進行分析。計量資料以s表示,組間參數的比較采用單因素方差分析。
2 結果
2.1 大鼠一般生存狀況及生化指標變化
模型組和丹參飲組空腹血糖在不同時間點逐漸降低,但是沒有統計學意義(P>0.05);模型組和丹參飲組大鼠血清甘油三酯和總膽固醇水平逐漸增加,各組不同時點縱向比較差異顯著(模型組和丹參飲組的甘油三酯的F值分別為F=25.429和F=7.198,P<0.01;模型組和丹參飲組總膽固醇的F值分別為F=9.065和F=10.952,P<0.01);正常組不同時點縱向比較,大鼠血清甘油三酯和總膽固醇水平無顯著差異(P>0.05),與相同時間點的正常組大鼠比較,模型對照組和丹參飲組大鼠血清甘油三酯和總膽固醇水平明顯升高,丹參飲組大鼠血清甘油三酯和總膽固醇較模型對照組明顯減低,各組之間兩兩比較,差異顯著(P<0.01);與相同時間點的正常組大鼠比較,模型組和丹參飲組大鼠空腹血糖明顯升高,與相同時間點的模型組相比,丹參飲組大鼠空腹血糖水平明顯降低,各組之間兩兩比較,差異顯著(P<0.05)。
2.2 心電圖觀察心肌損傷情況
大鼠心電圖顯示,ST段抬高明顯,提示心肌已損傷。
2.3 病理觀察
HE染色可見,正常大鼠心肌細胞排列整齊、致密,結構清晰,細胞外間質較少,可見少量成纖維細胞(圖1A)。DM大鼠心肌細胞排列紊亂,心肌細胞肥大、扭曲,細胞間隙增大,間質和血管周圍細胞外基質增多,成纖維細胞增多,并有炎癥細胞浸潤(圖1B)。丹參飲組介于兩者之間,與模型對照組相比,細胞間隙減小,間質和血管周圍細胞外基質減少(圖1C)。

圖1 各組大鼠心肌組織HE染色觀察(200×)
2.4 電鏡觀察心肌亞細胞結構
正常大鼠心肌細胞排列整齊,結構清晰,細胞間質膠原含量很少,毛細血管內皮細胞及基底膜結構正常(圖2A)。DM大鼠心肌細胞肌絲纖維稀疏、扭曲、斷裂,線粒體腫脹,數量減少,排列紊亂,空泡變性,部分嵴斷裂,糖原減少,間質膠原增生,毛細血管內皮細胞腫脹,毛細血管基底膜增厚(圖2B)。丹參飲組較DM組明顯減輕,間質膠原沉積較少,毛細血管基底膜增厚減輕,介于正常組和對照組之間(圖2C)。
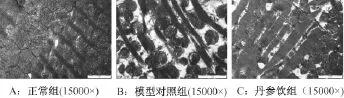
圖2 各組大鼠心肌組織電鏡觀察(15000×)
2.5 Masson染色觀察膠原表達情況
采用Image Pro Plus圖像分析系統進行心肌組織膠原相對含量測定,實驗結果表明,與正常組相比,糖尿病心肌病變大鼠心肌組織膠原相對含量明顯增加(P<0.01),提示該模型大鼠存在膠原纖維增生病變;與模型組相比,丹參飲組能減少心肌組織膠原相對含量(P<0.05),提示丹參飲可以明顯抑制膠原纖維增生。

圖3 各組大鼠心肌組織masson染色(100×)
表1 各組大鼠左室組織Masson染色膠原纖維定量分析結果(s)
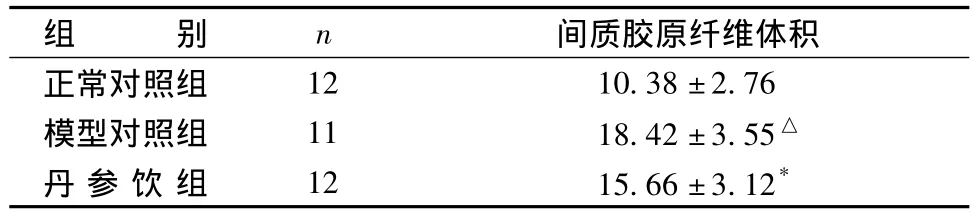
表1 各組大鼠左室組織Masson染色膠原纖維定量分析結果(s)
注:與正常組比較:△P<0.01;與模型對照組比較:*P<0.05
組 別n 間質膠原纖維體積正常對照組12 10.38±2.76模型對照組 11 18.42±3.55△丹 參 飲 組 12 15.66±3.12*
2.6 Tunel細胞凋亡試劑盒檢測細胞凋亡
正常組大鼠的心肌組織僅可見少數細胞凋亡(圖4A),與正常組相比,模型組凋亡細胞數目明顯增多(圖4B),與模型組相比,丹參飲組凋亡細胞顯著減少(圖4C)。
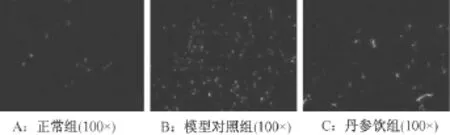
圖4 各組大鼠心肌組織細胞凋亡水平(200×)
2.7 實時熒光定量PCR檢測結果
與正常組相比,模型組 TSP-1和 TRB-3的mRNA表達水平均明顯升高(P<0.01)。與模型組相比,丹參飲組TSP-1和TRB-3的mRNA表達水平顯著降低(P<0.01)。
表2 各組大鼠心肌TSP-1和TRB-3的mRNA表達水平(s)

表2 各組大鼠心肌TSP-1和TRB-3的mRNA表達水平(s)
注:△P<0.01,*P<0.05
組 別n TSP-1 TRB-3正常對照組12 0.0096±0.0042 0.0073±0.0025模型對照組 11 0.0152±0.0051* 0.0137±0.0031△丹 參 飲 組 12 0.0126±0.0049* 0.0096±0.0014△
2.8 免疫組織化學染色
TSP-1染色陽性信號為棕色顆粒,定位于心肌細胞胞漿內。正常組心肌細胞胞漿內可見分布均勻、稀疏的淺棕色顆粒(圖5A),模型組心肌細胞內可見濃密的深棕色顆粒(圖5B),丹參飲組心肌細胞內棕褐色顆粒可見明顯減少(圖5C)。與正常組相比,模型組心肌TSP-1蛋白表達量明顯升高;與模型組相比,丹參飲組TSP-1表達量明顯降低,3個組兩兩相比差異顯著,差異有統計學意義(P<0.01)。

圖5 各組大鼠心肌TSP-1免疫組織化學染色(200×)
TGF-β1染色陽性信號為棕色顆粒,定位于心肌細胞胞漿內。正常組心肌細胞胞漿內可見散在、稀疏的淺棕色顆粒(圖6A),模型組心肌細胞內可見濃密的深棕色顆粒(圖6B)。丹參飲組心肌細胞內棕色顆粒可見明顯減少(圖6C)。與正常組相比,模型組心肌TGF-β1蛋白表達量明顯升高;與模型組相比,丹參飲組TSP-1表達量明顯降低,3個組兩兩相比差異顯著,差異有統計學意義(P<0.01)。

圖6 各組大鼠心肌組織TGF-β1免疫組織化學染色(200×)
Chymase染色陽性信號為棕色顆粒,定位于心肌細胞間隙及肥大細胞胞漿,正常組心肌組織內可見散在稀疏的淺棕色顆粒(圖7A),DCM組心肌組織內可見較多的深棕色顆粒(圖7B)。丹參飲組心肌組織內棕色顆粒可見明顯減少(圖7C)。與正常組相比,模型組心肌Chymase蛋白表達量明顯升高;與模型組相比,丹參飲組Chymase表達量明顯降低,3個組兩兩相比差異顯著,差異有統計學意義(P<0.01)。
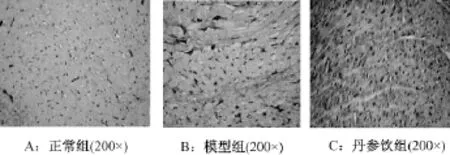
圖7 各組大鼠心肌組織Chymse蛋白免疫組織化學染色(200×)
TRB-3染色陽性信號為棕色顆粒,定位于心肌細胞胞漿內,正常對照組心肌細胞胞漿內可見散在稀疏的淺棕色顆粒(圖8A),模型組心肌細胞內可見濃密的深棕色顆粒(圖8B)。丹參飲組心肌細胞內棕色顆粒可見明顯減少(圖8C)。與正常組相比,模型組心肌TRB-3蛋白表達量明顯升高;與模型組相比,丹參飲組TSP-1表達量明顯降低,3個組兩兩相比差異顯著,差異有統計學意義(P<0.01)。

圖8 各組大鼠心肌組織TRB-3蛋白免疫組織化學染色(200×)
2.9 Western blot檢測蛋白表達情況
心肌組織中 TGF-β1是以活性的 A-TGF-β1和非活性的L-TGF-β1形式存在的,與正常組相比,心肌組織中 TSP-1、A-TGF-β1、L-TGF-β1 3 種蛋白的表達水平均顯著升高(P<0.01)。與模型組相比,丹參飲組的 TSP-1、A-TGF-β1、L-TGF-β1 3 種蛋白的表達水平均顯著降低(P<0.05~0.01)。
表3 各組大鼠心肌TSP-1、A-TGF-β1和L-TGF-β1蛋白的表達水平(s)

表3 各組大鼠心肌TSP-1、A-TGF-β1和L-TGF-β1蛋白的表達水平(s)
注:△P<0.01,*P<0.05
組 別 n TSP-1 A-TGF-β1 L-TGF-β1 12 93.225±5.371 106.429±6.32 102.461±6.124模型對照組 11 129.772±6.548△ 139.812±7.26△ 144.633±7.377△丹 參 飲 組 12 118.392±6.226△ 124.385±6.65*126.377±6.924正常對照組*
3 討論
本研究以高糖高脂高熱量飲食誘導出胰島素抵抗,加小劑量STZ注射建立的動物模型。HE染色病理切片顯示,心肌細胞肥大、扭曲,細胞間隙增大,間質和血管周圍細胞外基質增多。電鏡觀察顯示,心肌細胞排列稀疏、斷裂并有大量膠原纖維分布。結合心電圖示心肌受損,提示本研究已成功地建立了糖尿病心肌病的動物模型。
丹參飲出自《時方歌括》,由丹參、檀香、砂仁3味藥物組成,方中重用丹參活血祛瘀為君藥;檀香、砂仁行氣寬中而止痛為佐使,主要用于血瘀氣滯、心胃諸痛證。在臨床上主要應用于血瘀氣滯型胸痹心痛。研究表明,丹參飲可以顯著提高心肌缺血的保護能力,有效緩解缺血對心肌造成的損傷,使酶的外漏減少,從而起到保護心肌的作用[1]。現代藥理研究證實,丹參飲可使冠狀動脈擴張,增加冠脈血流量;對周圍血管也有擴張作用,而致血壓降低。當心功能不全時,可改善心肌收縮力,促進側支循環及體內血流的再分配,降低冠心病患者的血漿黏度,加速紅細胞電泳率,改善紅細胞比容,進而改善微循環。本實驗發現,正常組大鼠心肌細胞排列整齊、致密,細胞間隙較少,masson染色顯示心肌細胞間僅有少量膠原纖維,電鏡觀察心肌細胞排列整齊,線粒體完整,低倍鏡下(1250×)成纖維細胞數目較少(≤2個),而且成纖維細胞周圍膠原纖維少。與正常組相比,模型組大鼠心肌細胞排列紊亂,細胞間隙較多,masson染色顯示心肌細胞間充滿大量膠原纖維,電鏡觀察心肌細胞肌絲斷裂崩解,線粒體腫脹、破裂,低倍鏡下(1250×)成纖維細胞數目較多(≥5個),而且成纖維細胞周圍聚集大量膠原纖維。丹參飲組介于兩者之間,與模型組相比,丹參飲組大鼠心肌細胞排列較為整齊,細胞間隙膠原纖維較少,電鏡低倍鏡下(1250×)成纖維細胞數目為2~4個,成纖維細胞周圍有中等量的膠原纖維,提示丹參飲可以有效延緩糖尿病大鼠心肌病發生。
TSP-1對多種間質細胞的分化、增生具有很強的調控作用,其異常表達在多種類型纖維化疾病進程中起關鍵作用[2]。有研究表明,糖/TSP-1/TGF-β1信號傳導途徑在糖尿病心肌病心肌間質纖維化發生發展過程中起著重要的作用[3]。最近1項有關TRB3信號轉導通路的研究結果表明,TRB3對MAPK信號轉導通路的連鎖反應具有廣泛和特異的調控作用,TRB3與MAPKK結合而調控MAPK通路信號蛋白的活性[4]。大量研究證實,MAPK不僅是糖尿病慢性并發癥發生發展過程的關鍵細胞因子[5],也是心肌纖維化過程中重要的信號轉導通路[6]。研究證實,糖尿病狀態下,心肌局部升高的Ang II,通過多條途徑引起心肌氧化應激、細胞凋亡、心肌間質膠原沉積以及心肌纖維化,在糖尿病心肌病變變的發生中扮演著重要角色[7]。Chymase除了通過生成Ang II引起心肌病變,還可能直接激活TGF-β從而誘導細胞增殖,促使心肌纖維化[7]。本實驗結果表明,與正常組相比,模型對照組masson染色膠原纖維表達增多,電鏡觀察成纖維細胞周圍膠原纖維表達增高,免疫組化結果表明,與正常組相比,模型組大鼠心肌細胞 TSP-1、TGF-β1、chymase、TRB-3表達量均明顯增高,差異具有統計學意義(P<0.01)。與模型組相比,丹參飲組大鼠心肌細胞TSP-1、TGF-β1、chymase、TRB-3 有不同程度的降低,差異有統計學意義。結合masson染色及電鏡結果,提示丹參飲可以有效緩解糖尿病心肌病的心肌纖維化進程,減輕糖尿病心肌病的纖維化程度。Western半定量結果顯示,與正常組相比,模型對照組的TSP-1、A-TGF-β1、L-TGF-β1 表達量均明顯升高。熒光定量PCR結果顯示,與正常組相比,模型對照組的TSP-1、TRB-3 mRNA的表達量增高,說明模型組大鼠心肌組織中纖維化過程中的關鍵因子在基因和蛋白水平均表達明顯增高。非活性的L-TGF-β1雖然不直接參與糖尿病心肌病的纖維化過程,但是表達水平仍然升高,這與其他研究結果一致,可能是由于TGF-β1基因表達增多,從而導致L-TGF-β1表達量也增高。與模型組相比,丹參飲組的TSP-1、ATGF-β1、L-TGF-β1 表達量均明顯降低,提示丹參飲可以通過降低纖維化過程中的細胞因子TSP-1、ATGF-β1、L-TGF-β1,從而延緩心肌纖維的發生。
[1]李然,劉立萍.丹參飲對大鼠急性心肌缺血的保護作用[J].遼寧中醫雜志,2008,35(12):1944-1945.
[2]Morishima Y,Nomura A,Uchida Y,et al.Triggering the induction of myofibroblast and fibrogenesis by airway epithelial shedding[J].Am J Respir Cell Mol Biol,2001,24:1-11.
[3]鐘鳴,張薇,苗雅,等.糖/血小板反應素-1/轉化生長因子 β1信號傳導途徑在糖尿病心肌病發病中的作用[J].中華心血管病雜志,2006,34(3):217-220.
[4]Regulation of expression and signaling modulator function of mammalian tribbles is cell-type specific[J].Immunllogy Letters,2006,10:171-177.
[5]Ling Li,SAWAMURA Tatsuya,RENIER Geneviève.Glucose enhances human macrophage LOX-1 expression:Role for LOX-1 in glucose-induced macrophage foam cell formation[J].Cire Res,2004,94(7):892-90.
[6]Park JK,Fischer R,Dechend R,et al.P38 mitogen-activated protein kinase inhibition ameliorates angiotensin II-induced target organ damage[J].Hypertension,2007,49(3):481-489.
[7]叢麗,俞茂華,李益明.Chymase與糖尿病心肌病變[J].國外醫學·內分泌學分冊,2004,24(增刊):33-35.

