不同部位銀杏莖段培養及位置效應的研究
陳 穎,曹福亮,徐彩平,汪貴斌,張往祥
不同部位銀杏莖段培養及位置效應的研究
陳 穎,曹福亮,徐彩平,汪貴斌,張往祥
(南京林業大學森環院,江蘇 南京 210037)
以一個月月齡銀杏()無菌幼苗各部位莖段為外植體,研究其頂芽、帶腋芽的中段、帶子葉的下段腋芽萌發和不定芽的分化情況。結果表明:①銀杏頂芽段(上段)在以改良MS、N6、DCR為基本培養基,附加0.1mg/L NAA和0.5 mg/L 6-BA的培養基上頂芽生長較其他培養基好,抽出的芽苗長得高,最高達2.98 cm,未見有不定芽的分化;②中段外植體在四種基本培養基(MS、DCR、N6、改良MS)中附加0.1 mg/L NAA和0.5 mg/L 6-BA和0.25%AC時,都能誘導出腋芽和不定芽,4種培養基之間芽誘導率無明顯差異,以N6培養基的誘導效果最好,平均每個外植體產生1.56個芽;③帶有子葉下段的外植體培養后,能誘導出2 ~ 3個子葉腋芽和新的不定芽,在改良MS+0.1 mg/L NAA+0.5 mg/L 6-BA、N6+0.1 mg/L NAA+0.5 mg/L 6-BA培養基上兩個腋芽的誘導率均達80%以上。表明,不同部位的銀杏莖段在芽的誘導上存在位置效應,可利用不同部位進行銀杏的定向快速繁殖。
銀杏莖段;組織培養;位置效應
銀杏()由于其含有黃酮和萜內酯而倍受人們的青睞,銀杏黃酮和萜內酯主要來源于銀杏葉片,但含量很低。在土地面積日益減少的今天,借助于植物細胞的大量培養來工業化生產銀杏次生物質代謝產物,是一條比較可行、又節省土地、實現集約化經營的途徑。細胞培養的外植體來源一是來自于實生苗的葉片及幼莖;二是來自于試管苗的各組織器官。來自于實生苗的外植體只能在春季4-6月采集,且污染率大,不能常年供應愈傷組織的起始外植體。盡管細胞培養體系建立后也可以保持常年愈傷組織的增殖,但仍不能滿足大量培養的要求。因此建立一個微型無菌的快繁體系可以為細胞培養、組織培養、遺傳轉化不斷地提供原始材料,真正實現銀杏細胞培養生產次生代謝物的大規模生產和銀杏遺傳轉化研究。
在銀杏的組織培養中,國內外學者對未成熟胚、成熟胚、子葉、莖段的分化有了一定的研究,但仍然存在分化難、分化數少、體系不穩定的問題。為進一步提高銀杏的芽發生頻率和減少偶然性因素,本研究以不同部位的銀杏莖段為外植體,研究了不同培養基、不同調節劑對銀杏定芽和不定芽誘導的影響,建立了一個穩定的銀杏莖段組培快繁體系,為通過組織培養快速繁殖銀杏苗木提供了技術支持。
1 材料與方法
1.1 材料來源
以28號銀杏成熟胚培養出的一個月月齡無菌幼苗各部位莖段為外植體。選擇長勢和高度基本一致的幼苗,按部位剪成3段:帶有頂芽的上段0.5 cm左右,帶腋芽的中段1 cm左右、帶有子葉腋芽的下段1 cm左右,分別接種在下述不同的培養基上。
1.2 芽誘導培養基
以MS、DCR、N6、改良MS(NHNO減半)4種基本培養基。附加NAA0.1 ~ 0.5 mg/L、6-BA0.1 ~ 2.0 mg/L、AC(活性炭)0.25%。
1.3 培養基配制、滅菌及培養室條件
以上培養基各添加蔗糖30 g/L、瓊脂7.0 g/L,pH值5.80左右;121℃高壓滅菌20 min,每30 d繼代1次。培養溫度為25±2℃,光強為30 ~ 40 mol·m·s,每天14 h光照,10 h黑暗。
1.4 芽苗高度和基部愈傷組織直徑測定
在培養的同時,觀察各種培養基上外植體的生長狀況,到一定培養時間后,均勻取出6棵,量取芽苗高度和基部愈傷組織直徑。用SPSS11.5統計軟件進行數據統計分析。
2 結果與分析
2.1 不同調節劑濃度、不同培養基對頂芽生長的影響
將無菌苗的頂芽接種在四種基本培養基、附加不同濃度NAA、6-BA的培養基上(表1),培養30 d后發現,在MS培養基中不加調節劑的頂芽基部無愈傷組織的產生,頂芽只長高,展葉。附加調節劑后頂芽高度生長受到抑制,在NAA為0.1 mg/L時,隨著6-BA濃度的提高,其抑制作用越強,2.0 mg/L時,頂芽高度只有對照的60.5%(4號培養基),6-BA的作用大于NAA;NAA為0.5 mg/L時,其與6-BA的聯合作用加強,抑制作用加大;6-BA為2.0 mg/L時,頂芽高度只有對照的52%(7號培養基)。方差分析表明:各處理之間的高度達極顯著的水平(F= 3.53 < F = 10.901)。多重對比表明,對照與各處理之間達極顯著水平,而在2 ~ 5號培養基之間無顯著性差異,6 ~ 7號培養基之間無顯著性差異,但它們與2 ~ 5號培養基之間有顯著性差異。

表1 不同NAA、6-BA濃度對頂芽生長的影響(30 d)
在DCR培養基上,0.5 mg/L的6-BA促進頂芽的生長,高濃度(1.0 ~ 2.0 mg/L)的6-BA抑制頂芽的生長,但抑制作用并沒達到顯著水平。與MS培養基比較,DCR培養基更有利于頂芽的高生長。
在N6、改良MS培養基上的頂芽高度較在MS和DCR培養基上的增加1 cm之多(如13號與9號),達極顯著水平,其長勢也是較粗壯,因此這兩種培養基更有利于頂芽的培養,缺點是基部與愈傷組織直徑較大。在各培養基上只發現頂芽的生長,未見不定芽的分化。
2.2 不同調節劑濃度、不同培養基對中段腋芽誘導和不定芽誘導的影響
剪取一個月月齡無菌苗的中段1 cm左右(帶腋芽),接種在不同的培養基上培養30 d后,腋芽長出。在不加調節劑的MS和DCR培養基上一般都能誘導出一個腋芽,但莖段基部易木質化。在NAA0.1 ~ 0.5 mg/L,6-BA濃度小于2.0 mg/L時,除了誘導出腋芽外,還能誘導出不定芽(如2、3、6、9、12、13號培養基),6-BA濃度在2.0 mg/L時,莖段及腋芽會全部愈傷化。綜合各指標,NAA0.1mg/L、6-BA0.5 mg/L 對腋芽誘導最好(表2)。
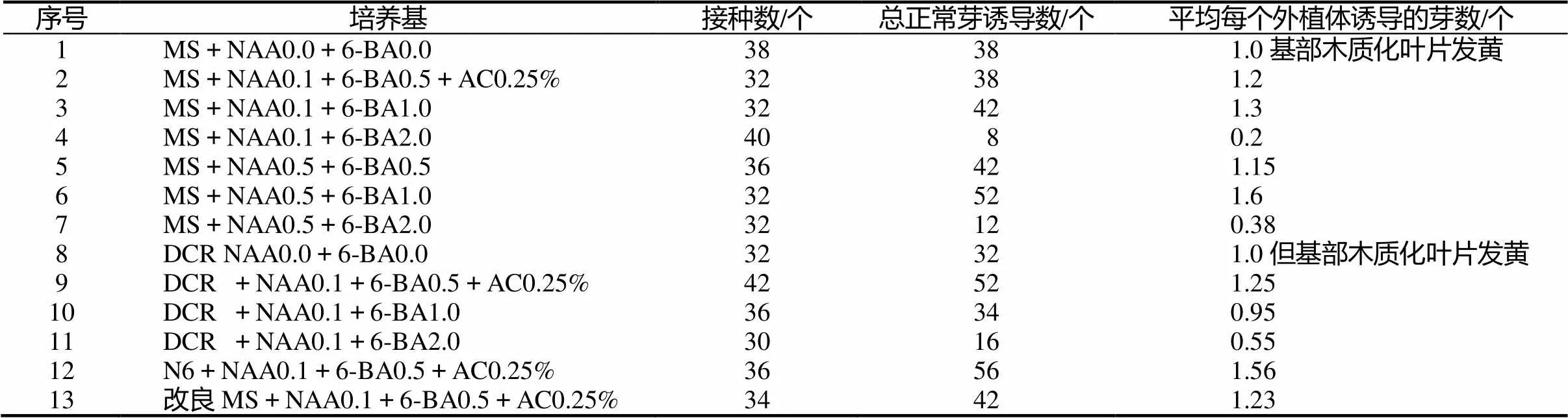
表2 不同NAA、6-BA濃度對中段腋芽誘導的影響
4種基本培養基(MS、DCR、N6、改良MS)中在NAA0.1 mg/L、6-BA0.5 mg/L和AC 0.25%時,對腋芽和不定芽的誘導無明顯差異。整體來看N6培養基的誘導效果最好,其總正常芽誘導數和平均每個外植體芽誘導的芽數最多。但是也有缺點,表現在其基部的愈傷組織直徑最大。
2.3 下段子葉腋芽的誘導
銀杏的胚中有的帶有兩片子葉,有的帶有3片子葉,培養成無菌苗后,會在子葉葉腋處留有2 ~ 3個子葉腋芽。一個月月齡的銀杏無菌苗,剪去根部、頂芽、中段后,將帶有子葉的下段1 cm左右,在不同培養基培養后,其子葉腋芽萌動和生長情況出現不同(表3)。
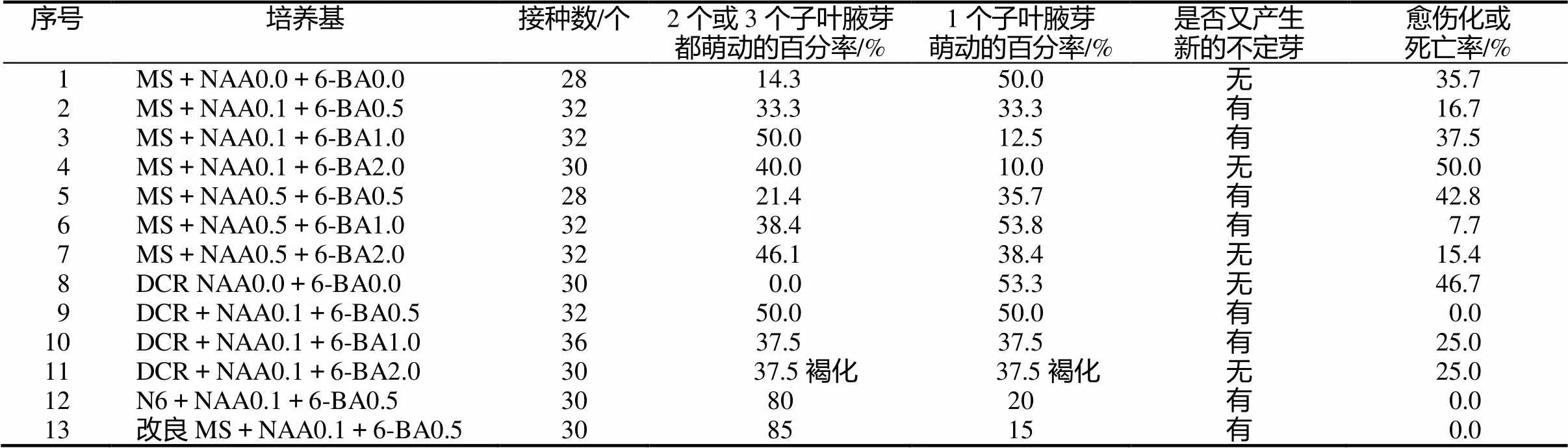
表3 不同NAA、6-BA濃度對子葉腋芽誘導的影響
從表3中可以看出,子葉的兩個腋芽在不加調節劑的MS和DCR培養基上一般只有一個子葉腋芽長出,另一個不能萌動。添加NAA、6-BA后,在MS培養基上,NAA為0.1mg/L條件下,兩個腋芽萌動的百分數多于只有一個腋芽的百分數,最高達50%,而在NAA為0.5 mg/L的條件下,則前者所占的百分率小于后者(7號除外),說明NAA對子葉腋芽的萌發作用大于6-BA,同時也說明外植體的位置效應明顯,影響著其腋芽的萌動率。帶有子葉下段的培養不但能把子葉腋芽誘導出來,還能誘導出不定芽,在6-BA0.5 ~ 1.0 mg/L的培養基上,都能誘導出新的不定芽,但在2.0 mg/L時出現愈傷化。總體效果仍然是N6與改良MS效果好,兩者腋芽的誘導率最高達85%。
3 結論與討論
將銀杏不同部位的莖段分別培養后,其生長和分化存在位置效應,即帶有頂芽的上段、帶有腋芽的中段、帶有子葉的下段,在培養過程中器官發生存在較大差異:頂芽段(上段)一般只長高,展葉;中段先誘導出腋芽或不定芽,再長高;下段一般能誘導出2 ~ 3個子葉腋芽和不定芽。
頂芽外植體在不加調節劑的培養基上雖能夠生長,但會出現木質化,在DCR+NAA0.1 mg/L+6-BA0.5 mg/L、N6+NAA0.1 mg/L+6-BA0.5 mg/L、改良MS+NAA0.1 mg/L+6-BA0.5 mg/L的培養基上頂芽生長最好,高度最高,最高達2.98 cm,未見有不定芽的分化出來。
中段外植體在四種基本培養基(MS、DCR、N6、改良MS)中在0.1mg/L NAA、6-BA0.5mg/L和0.25%AC時,都能誘導出腋芽和不定芽,4種培養基之間誘導率無明顯差異,整體來看N6培養基的誘導效果最好,平均每個外植體可產生1.56個芽。
帶有子葉下段外植體,在改良MS+NAA0.1 mg/L+6-BA0.5 mg/L和N6+NAA0.1 mg/L+6-BA0.5 mg/L培養基上腋芽的誘導率均達80%以上,并且在NAA0.1 mg/L和6-BA0.5 mg/L下,有不定芽的出現。
培養基的基本成分也影響著頂芽高的生長和腋芽、子葉腋芽的誘導率,四種培養基中以N6和改良MS培養基最好。
郝崗平在銀杏幼嫩莖段快繁中發現,頂芽數量雖少于腋芽,但仍可看出不同培養基對頂芽生長成苗的影響不同。這可能是由于頂芽和腋芽的生長模式、生理狀態等不同造成的。我們的研究也表明頂芽在培養過程中只長高,未見不定芽的分化。帶腋芽的莖段除了能把原有的腋芽誘導出來,還發現有不定芽的產生;另外帶有子葉的下段,能夠把2個或3個子葉腋芽誘導出來,除此之外還有新的不定芽誘導出來。
組織培養過程中的離體再生很大一部分在于生長素和細胞分裂素的比例,一般生長素/細胞分裂素比值高,有利于根的誘導,比值低有利于芽的誘導,而比值中等有利于愈傷組織的誘導。從我們的研究結果中可看出,銀杏各部位在離體培養中的位置效應可能與其內源激素的含量有關。銀杏的頂芽是生長素的主要存在部位,因而在離體培養時頂芽主要是高的生長,很難分化,添加6-BA后,改變了兩者的比例,也改變了頂芽需要高生長素的要求,因而表現出抑制高的生長。
而在中段、下段內源激素可能主要以細胞分裂素存在,因而在不加調節劑的培養基上,腋芽也能萌發,添加低濃度的NAA和6-BA后,誘導的腋芽更加粗壯,同時能又誘導出不定芽來,這時NAA的誘導作用大于6-BA,體現外植體中生長素較低。
因此在銀杏的莖段培養過程中,可以通過頂芽的不斷伸長,獲得遺傳穩定性強的再生植株,這對保持銀杏雌雄植株的性別和優良性狀是有利的。通過對下部和帶腋芽莖段的培養,可以獲得不定芽,增加再生頻率,達到快繁的目的。
[1] P S CHOI,D Y CHO,W Y SOH. Shoot organogenesis from immature zygotic embryo culture[J]. Biologia plantarum,2003,47(2):309-312.
[2] F Tommasi,F Scaramuzzi. In vitro propagation of Ginkgo biloba by using various bud cultures[J]. Biologia plantarum,2004,48(2):297-300.
[3] 羅紫娟. 銀杏莖段的組織培養[J]. 杭州師范學院學報,1990(3):60-64.
[4] 王洪善,孫滿芝. 銀杏愈傷組織培養形態建成的研究[J]. 林業科技通訊,1997(9):27-29.
[5] 孫滿芝. 組織培養法繁殖銀杏苗木試驗[J]. 山東林業科技,1996,104(3):4-6.
[6] 羅言云,賈勇炯. 銀杏莖段的組織培養及其植株再生[J]. 四川大學學報(自然科學版),2001,38(3):412-416.
[7] 郝崗平,杜希華,尤勇,等. 不同因素對離體培養的銀杏幼莖腋芽生長發育的影響[J]. 林業科學研究,2000,13(2):217-221.
[8] 郝崗平,杜希華,史仁玖. 銀杏幼嫩莖段培養誘導愈傷組織及其細胞學研究[J]. 西北植物學報,2003,23(4):648-652.
[9] 胡蕙露,胡翠玲,楊枝發. 銀杏莖段組織培養正交實驗[J]. 安徽農業大學學報,1997,24(2):129-133.
[10] 胡蕙露,楊景華,楊荻榮. 銀杏莖段試管培養條件篩選研究[J]. 林業科學,2002,38(3):52-56.
[11] 郭長祿,陳力耕,何新華,等. 銀杏幼胚離體培養再生植株的研究[J]. 園藝學報,2005,32(1):105-107.
[12] 郭長祿,陳力耕,何新華,等. 銀杏胚軸、子葉誘導胚狀體發生及成苗的研究[J]. 林業科學,2005,41(2):178-181.
[13] 羅言云,賈勇炯. 銀杏莖段的組織培養及其植株再生[J]. 四川大學學報(自然科學版),2001,38(3):412-416
[14] 陳穎,曹福亮,謝寅峰,等. 5個銀杏優良品種成熟胚離體繁殖培養基的選擇研究[J]. 西北植物學報,2004,24(11):2 025-2 032.
[15] Skong F,Stui C. Chemical control of growth and bud formation in tabacco stem segments and callus cultured in vitro[J]. Am J Bot,1948(35):782-787.
[16] Skong F, Miller C O. Chemical regulation of growth and organ formation in plant tissues cultured in vitro[J]. Symp Soc Exp Biol,1957(1):118-130.
Studies of Stem Segments Culture in-vitro of
CHEN Ying,CAO Fu-liang,XU Cai-ping,WANG Gui-bin,ZHANG Wang-xiang
()
Experiment was conducted by taking stem segments including terminal buds, segment with axillary buds, segments with cotyledon of 1-month seedling as explants for studying germination and differentiation of adventitious buds of. The result demonstrated that growth of terminal bud segments (upper section) was better in the medium of modified MS, N6, DCR supplemented with 0.1 mg/L NAA and 0.5 mg/L 6-BA than in other media, the highest shoot was up to 2.98 cm. But the adventitious buds were not observed. The explants of segments with axillary buds could induce axillary buds and adventitious buds in four media (MS, DCR, N6, modified MS) supplemented with 0.1 mg/L NAA and 0.5 mg/L 6-BA and 0.25%AC, and the induction rate had no significant difference among the four media, but N6 had better effect with 1.56 bud per explant. Segments with cotyledons could be induced with 2 ~ 3 axillary buds and adventitious buds. The two axillary buds induction rate was more than 80% in the media of modified MS+0.1 mg/L NAA+0.5 mg/L 6-BA and N6+0.1 mg/L NAA+0.5 mg/L 6-BA. The results indicated that different stem segments ofhad different induction effect.
stem of; tissue culture; position effect
1001-3776(2010)01-0028-04
S792.95
A
2009-10-25;
2009-12-14
江蘇省高校自然科學研究計劃項目(07KJB220048)
陳穎(1966-),女,山東濰坊人,副教授,博士,從事植物生物技術研究。

