AKT1基因PH結構域在亞洲胃腸道腫瘤中的變異研究
李玉琴,孫泯丹,李麗娜,田中康雄,小俁政男
(1.吉林大學白求恩第一醫院,吉林長春 130021;2.日本東京大學醫學研究系消化內科)
AKT1基因PH結構域在亞洲胃腸道腫瘤中的變異研究
李玉琴1,孫泯丹1,李麗娜1,田中康雄2,小俁政男2
(1.吉林大學白求恩第一醫院,吉林長春 130021;2.日本東京大學醫學研究系消化內科)
目的 分析AKT1基因PH(the p leckstrin homology,PH)結構域第4外顯子的堿基序列,探討中國人和日本人AKT1基因突變與胃腸道腫瘤的關系。方法采用激光顯微切割技術捕獲胃癌組織和大腸癌組織的腫瘤細胞,以這些標本的基因組DNA為模板,用聚合酶鏈反應PCR方法擴增AKT1基因PH結構域,PCR產物經純化后直接測序。結果
分析測序圖發現AKT1基因PH結構域第4外顯子第49核苷酸沒有出現點突變。結論中國人和日本人的胃腸道腫瘤的AKT1基因PH結構域沒有出現點突變,與胃腸道腫瘤發生發展關系不大。
AKT1基因;激光捕獲顯微切割;胃癌;大腸癌;突變
(Chin J Lab Diagn,2010,14:1173)
AKR小鼠T細胞淋巴瘤癌蛋白(AKRmouse T-cell lymphoma oncoprotem,AKT)屬于絲氨酸/蘇氨酸蛋白激酶類,是PI3K/AKT細胞信號通路中的重要成員之一,在調控細胞生存和凋亡的平衡中發揮重要作用。該蛋白激酶催化不同的底物,發揮促進細胞生長、增殖、存活、代謝等作用,與腫瘤的發生發展密切相關[1]。最近人類腫瘤基因組學研究表明,在多數人類腫瘤中PI3K通路的許多成員都發生了種系突變或體細胞突變。最近在黑色素瘤、乳腺癌、結腸直腸癌及卵巢癌中發現有AKT1的PH(the pleckstrin homology,PH)結構域活化突變E17K,導致細胞膜病理性的異常活化,促進細胞生長、增殖[2]。為了進一步確定AKT1基因PH結構域的突變在亞洲消化道腫瘤患者中的突變情況。本研究選取了部分中國和日本的消化道腫瘤患者進行研究,探討亞洲人消化道腫瘤的發病機制是否與AKT1基因pH結構域突變相關。
1 材料和方法
1.1 材料
1.1.1 胃癌、結直腸癌組織由日本東京大學及吉林大學白求恩第一醫院提供。AKT1基因PH結構域E17K突變的DNA由Dr.Kerry L.Blanchard提供。
1.1.2 材料和儀器 ABIAmpliTaq Gold○RDNA 聚合酶、DNA凝膠提取試劑盒、BigDye Terminator測序試劑盒購自App lied Biosystems公司;QIAamp DNA Mini kit購自QIAGEN公司,其他分子生物學試劑購自Takara公司。
1.1.3 引物序列 引物由Takara公司合成.AKT1的PH結構域的引物如下P1:上游引物5′-ACA TCT GTC CTG GCA CAC-3′,P2:下游引物 5′-GCC AGT GCT TGT TGC TTG-3′,擴增片段為 220 bp。以GAPDH作為外參照:GAPDH的引物如下P3:上游引物5′-CCA CCA TGG CAA ATT CC-3′,P4:下游引物5′-TGGGAT TTC CAT TGA TGA CAA G-3′,擴增片段為200 bp。測序引物為 P5 5′-ATC CCG AGA GGC CAAGGGGA-3′。
1.2 方法
1.2.1 選取2007-2008年吉林大學第一醫院病理科保存的60例胃癌和66例結直腸癌患者的石蠟包埋組織塊和日本東京大學病理科保存的42例胃癌和64例結直腸癌患者的石蠟包埋組織塊。所選病例手術前均未經化療。每例病理標本由資深臨床病理醫師閱片核對后選取。患者的一般情況、病理類型見表1。

表1 胃癌和結腸癌患者的一般情況及病理類型
1.2.2 激光捕獲顯微切割(Laser Capture microdissection,LCM)及提取基因組DNA為了從用福爾馬林固定,石蠟包埋(formalin-fixed paraffin-embedded,FFPF)的臨床樣本中提取基因組DNA,樣本被切成厚度為10um的切片。切片用蘇木素染色用于組織學檢查。為了避免腫瘤和非腫瘤細胞間的混淆,我們采用LM200型LCM系統(日本Olympus/美國A rcturus EngineeringInc)對所有的FFPE樣本進行了激光捕獲顯微切割,安置已染色的FFPF切片和收集管,在合適的放大倍數下選擇目的細胞,用鼠標勾畫選擇的目的細胞,根據視野、放大倍數和目的細胞分布等調整激光孔徑、速度及強度,切割癌細胞至收集管中。FFPE組織的基因組DNA用QIAamp DNA Mini kit提取。
1.2.3 PCR擴增及測序 取FFPE組織的基因組DNA 55 ng,加入 1 μM 的引物 P1、P2,0.25mMdNTPs,1XPCR 緩沖液,2.5UAmpliTaq Gold○RDNA聚合酶,行PCR反應,預期擴增片段為220 bp。并以GAPDH作為外參照:以 P3、P4為引物,并加入基因組DNA行PCR反應,預期擴增片段為200 bp。PCR反應條件如下:94℃5min;96℃30 s,57℃30 s,72℃30 s,30個循環;72℃10min。擴增產物用1%瓊脂糖凝膠進行電泳,陰性的進行二次PCR。陽性對照為由Dr.Kerry L.Blanchard提供的有AKT1基因PH結構域E17K突變的DNA,陰性對照為雙蒸水。DNA凝膠提取試劑盒回收純化的 PCR產物。使用ABI 3730xl DNA測序儀進行正向直接測序。
2 結果
2.1 PCR方法檢測結果激光捕獲顯微切割所收集的胃癌、結直腸癌組織共計232個樣本,對所有樣本進行PCR檢測,結果均顯示大小約220 bp的特異性條帶,說明所有胃癌和結直腸癌患者的基因組中均有不同程度的AKT1基因的表達,我們展示了其中18例患者腫瘤組織的AKT1及GAPDH的PCR結果。(如圖1)。
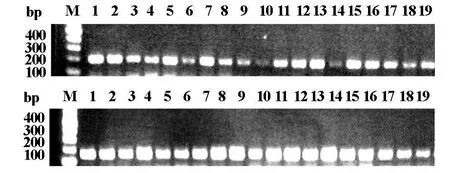
圖1 AKT基因PH結構域第4外顯子擴增結果
2.2 PCR產物進行測序測序結果發現待測胃癌和結直腸癌組織基因組DNA的AKT1位點均未出現如文獻報道的與歐美患者相同的點突變,即AKT1基因的PH結構域第4外顯子第49核苷酸均為G;而陽性對照的第49核苷酸為A/G,結果顯示:共計232例中國人和日本人的胃癌和結直腸癌患者的AKT1基因的PH結構域均無點突變(圖2)。
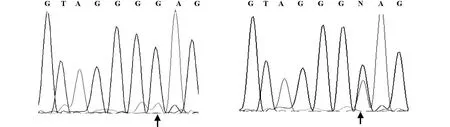
圖2 AKT1基因的PH結構域測序結果
3 討論
PI3K/AKT信號傳導通路活化可以抑制多種刺激誘發的細胞凋亡,促進細胞周期進展,從而促進細胞的生長和增殖,同時參與血管新生,在腫瘤的形成中扮演重要角色,并參與腫瘤的侵襲和轉移[3]。據報道PI3K/AKT信號傳導通路異常活化與許多惡性腫瘤如胃癌、結腸癌,乳腺癌和卵巢癌的發生發展相關[4]。很多研究表明,PI3K通路的許多成員包括PI3KCA、PTEN、AKT在惡性腫瘤的殖及轉移過程中都發生了種系突變或體細胞突變,參與了腫瘤的增殖和轉移。當發生包括PIK3CA或PTEN突變表達過量等信號通路組分異常表達時,PI3K-AKT信號傳導通路出現異常的調控反應[5-8]。AKT在腫瘤細胞中處于高度激活狀態,也會發生突變影響細胞增殖,Parson等人研究證實AKT基因在催化領域的340絲氨酸/蘇氨酸激酶有基因的突變。AKT2基因的突變在大腸癌的檢出率為1.0%(2/204),不過其突變的生理意義尚不清楚[9]。除了這個AKT2的激酶結構域突變AKT1基因pH結構域,外顯子4的核苷酸49發生點突變,G變成A,這導致了在賴氨酸取代谷氨酸賴氨酸17(E17K)。AKT PH結構域的E17K突變體存在于很多腫瘤中,在乳腺癌患者中AKT1的PH結構域的突變率在體細胞為8%(5/61),在大腸癌患者中則為 6%(3/51),卵巢癌為2%(1/50)[10]。該突變顯著增加T308的磷酸化,而不影響S473的磷酸化。K8R/E17K突變的AKT,其泛素化修飾水平降低,同時AKT1的膜定位和T308位點的磷酸化水平也降低,AKT1的細胞膜病理性的異常活化,考慮有可能是激活PI3K-AKT通路的新機制[2]。
AKT1基因E17K突變是否是敏感的PI3K的定位抑制劑成為目前研究的熱點。但有關AKT的突變的研究大多是在歐美進行的,對于亞洲人種這種突變還沒有進行廣泛地確認。在以前的研究中并沒有發現日本人胃腸道腫瘤和肝癌患者中AKT1基因E17K突變。而在本實驗中,首次同樣發現102例胃癌患者和130例結直腸癌患者的臨床樣本沒有外顯子4中E17K的突變,外顯子4的核苷酸49仍為G。而在陽性對照(E17K突變的DNA,Dr.Kerry L.Blanchard提供)中發現有點突變,外顯子4的核苷酸49由G變成A,從而在對應的蛋白質的相應位置賴氨酸取代谷氨酸賴氨酸17(E17K),泛素化修飾受到影響,可促進腫瘤的發生及轉移。
LCM技術是目前從組織中純化細胞的最好方法之一,該技術可有效地克服組織中細胞異質性造成的偏差。成功地解決了從所需標本不同成分中獲取純凈細胞的問題,具有簡單、快速以及精確度高等特點,被廣泛用于腫瘤學、細胞發生學和其他學科的研究。因此,本研究采取了LCM技術,避免了非腫瘤細胞的污染,保證了得到的細胞具有特異性[11-12]。在本實驗中取樣的中國人和日本人胃癌和結直腸癌患者中并沒有出現AKT1基因PH結構域突變,可能為由于種族差異所致。由于臨床分析樣本數量有限,在進一步的研究我們將采取更大量的樣本去驗證以上結果。一旦測知這些突變與分子靶向治療的療效有相關性,則根據靶點進行靶向治療成為可能。
綜上所述,盡管我們的結果并未否定AKT1基因PH結構域突變的可能性,但本研究發現這種突變在中國人和日本人的胃腸道腫瘤的發生率很低,需要進行更全面的基因突變分析加以證實,為以后的研究及治療提供了有用的信息。
[1]Franke TF,Hornik CP,Segev L,et al.PI3K/Akt and apoptosis:sizematters[J].Oncogene,2003,22:8983.
[2]Brugge J,HungMC,M illsGB.A newmutational AKT ivation in the PI3K pathway[J].CancerCell,2007,12:104.
[3]Cantley LC.The phosphoinositide 3-kinase pathway[J].Science,2002,296:1655.
[4]Vivanco I,Sawyers CL.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2:489.
[5]Shayesteh L,Lu Y,KuoWL,et al.PIK3CA is implicated asan oncogene in ovarian cancer[J].Nat Genet,1999,21:99.
[6]Li J,Yen C,Liaw D,etal.PTEN,aputative protein tyrosine phosphatase genemutated in human brain,breast,and prostate cancer[J].Science,1997,275:1943.
[7]Steck PA,Pershouse MA,Jasser SA,et al.Identification of a candidate tumour suppressor gene,MMAC1,at chromosome10q23.3 that ismutated in multiple advanced cancers[J].NatGenet,1997,15:356.
[8]Samuels Y,Wang Z,Bardelli A,et al.High frequency ofmutationsof the PIK3CA gene in human cancers[J].Science,2004,304:554.
[9]Parsons DW,Wang TL,Samuels Y,etal.Colorectal cancer:mutations in a signalling pathway[J].Nature,2005,436:792.
[10]Carpten JD,Faber AL,Horn C,et al.A transformingmutation in thepleckstrin homology domain of AKT1 in cancer[J].Nature,2007,448:439.
[11]Neubauer H,Clare SE,Kurek R,etal.Breast cancer proteom icsby laser capturemicrodissection,sample pooling,54-cm IPG IEF,and differential iodine radioisotope detection[J].Electrophoresis,2006,27(9):184052.
[12]Ai J,Tan Y,YingW,etal.Proteome analysisofhepatocellular carcinoma by lasercapturemicrodissection[J].Proteom ics,2006,6(2):53846.
The variation in PH domain of AKT1 gene in gastrointestinal cancer in Asia
LIYu-qin,SUNMin-dan,LILi-na,etal.(Departmentof Gastroenterology,First Hospital of Norman BethuneMedica l College,Jilin University,Changchun130021,China)
ObjectiveTo Analysis of AKT1 gene PH(the p leckstrin homology,PH)domain in exon 4 of the base sequence,study the relations of Chineseand Japanese AKT1genemutation and gastrointestinal tumor.MethodsThe tumor cellsweregot from Gastric cancer and colorectal cancer tissue by Lasermicrodissection.The the PH domain of AKT1 genewere Amplificated by RTPCR.PCR productswere purified and directly sequenced.ResultsPH domain of AKT1 gene in exon 4 of 49 nucleotidemutation does notappear Pointmutation.ConclusionPH domain of AKT1 gene of Chinese and Japanese gastrointestinal tumor does notappear Pointmutation,the developmentofgastrointestinal cancer has little to dowith it.
AKT1 gene;Laser Capturemicrodissection;Gastric cancer;colorectal cancer;mutation
R57
A
1007-4287(2010)08-1173-03
2009-05-18)

