不同時間去勢對大鼠CIA發病情況的影響
鞠大宏,趙宏艷,王 燕,肖 誠,查青林,張繼東,董鑫鑫呂 誠,劉梅潔,李 艷,劉 紅,于 崢,潘貴超,呂愛平
(1.中國中醫科學院中醫基礎理論研究所,北京 100700;2.中日友好醫院臨床醫學研究所,北京 100029;3.江西中醫學院,江西南昌 330004;4.天津骨科醫院,天津 300211;5.中國中醫科學院中醫臨床基礎醫學研究所,北京 100700;6.北京市昌平區華一醫院,北京 102208)
目前類風濕性關節炎(Rheumatoid arthritis,RA)動物模型主要采用Ⅱ型膠原免疫誘導進行制作,隨著人們對RA和膠原誘導性關節炎(collageninduced arthritis,CIA)的深入研究,發現二者存在許多類似之處[1~8],是目前公認的RA最佳動物模型。從中醫角度來看,該模型缺乏中醫證候屬性。中醫理論認為,腎虛在痹證(RA)發病中起著重要作用,據此本實驗擬在去勢的基礎上,用CⅡ進行免疫來制作腎虛痹證(RA)病證結合動物模型。主要觀察不同程度的腎虛狀態對大鼠關節炎發病情況的影響,以及尋找出在去勢后的那個時間點進行CⅡ免疫誘導能夠制作出發病率高和發病程度重的動物模型,以期為腎虛痹證(RA)病證結合動物模型的制作提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 動物 選用6周齡SPF級SD大鼠100只,雌雄各半,由中國藥品生物制品檢定所提供,動物許可證號SCXK(京)2005-0004。在中國中醫科學院中醫基礎理論研究所清潔級動物室喂養,實驗動物室許可證號SYXK(京)2005-0024。
1.1.2 主要試劑與儀器 主要試劑:牛Ⅱ型膠原(CⅡ)、不完全弗氏佐劑(IFA):美國Chondrex公司產品,批號080217;戊巴比妥鈉:北京化學試劑有限公司產品,批號020427;大鼠IL-6 ELISA試劑盒:美國 Bender公司產品,批號 BMS625;大鼠 IL-10ELISA試劑盒:美國 Bender公司產品,批號BMS629;大鼠皮質酮(Corticosterone,CORT)ELISA試劑盒:德國DRG公司產品,批號EIA-4164;大鼠抗Ⅱ型膠原ELISA試劑盒:美國Chondrex公司產品,批號2042。
主要儀器:Leica QwinV3圖像分析系統,德國Leica公司產品;AS325型切片機:英國SHONDON公司產品;T10 BASIC手持式分散機:德國IKA公司產品;Multiskan Mk3酶標儀、Wellwash 4 Mk2洗板機:美國Thermo公司。
2 方法
2.1 動物分組及處理
將動物隨機分為對照CIA組、去勢1周CIA組、去勢2周 CIA組、去勢3周 CIA組、去勢4周CIA組5組,每組20只(雌雄各半)。為了保證CⅡ免疫條件的齊同性,各組均在同一時間免疫,以免疫時間為基準點,在免疫前1周行去勢手術的即為去勢1周CIA組,去勢2周CIA組、去勢3周CIA組、去勢4周CIA組則以此類推。免疫后每7 d稱重1次。
按常規方法[9]切除大鼠的雙側睪丸或卵巢。CⅡ免疫的具體方法:取適量Ⅱ型膠原溶液(濃度為2mg/ml)逐滴加入至等容積的不完全弗氏佐劑中,Ⅱ型膠原終濃度為1mg/ml。冰浴中用勻漿器充分乳化,以滴加水中不擴散為度,取乳化后的混合物按0.2ml/只,即200μg CⅡ/只于尾根部皮下注射。7d后按0.1ml/只,即100μg CⅡ/只,于尾根部皮下加強免疫1次。
2.2 取材
于免疫后第35天戊巴比妥鈉麻醉下,采用腹主動脈取血,2500 r/min,20 min離心后取血漿,分裝后-80℃冰凍備用。開腹立即取出胸腺、脾臟和腎上腺并稱重。每只大鼠的胸腺、脾臟和及腎上腺(mg)分別與對應大鼠體重(g)的比值為胸腺系數、脾臟系數及腎上腺系數。取雙側膝、踝關節,在福爾馬林中固定備用。
2.3 指標的測定
2.3.1 一般狀態觀察 觀察大鼠一般狀態的改變:精神狀況,如是否有委靡、嗜睡、蜷縮、扎堆,對聲音、觸動刺激反應遲鈍以及毛松消瘦、失去光澤等。
2.3.2 關節炎指數(Arthritis index,AI)評分方法 造模后開始觀察并記錄關節病變程度,每7d 1次。參照5級評分法評價[10、11],將2只后踝關節的病變程度累計積分,計算出關節炎指數,每個動物最大為8分。
0分:無關節炎;1分:小趾關節輕度腫脹;2分:小趾關節和足跖腫脹;3分:踝關節以下的足爪腫脹;4分:包括踝關節在內全部關節腫脹。
2.3.3 關節切片及光鏡下關節破壞半定量分析方法 關節在福爾馬林固定1周后,5%HNO3脫鈣1周,酒精逐級脫水,二甲苯透明,石蠟包理,切片,常規HE染色。光鏡下觀察滑膜、軟骨、骨的病理改變,并進行關節病理損傷半定量分析[12]。
0分:關節結構正常,關節間隙均勻,軟骨、骨無損傷,滑膜組織無炎癥、增生等;1分:關節結構基本正常,有滑膜增生,血管數量增加,可見少量炎細胞浸潤,軟骨表層輕度破壞;2分:關節軟骨有明顯的侵蝕破壞,血管翳形成,炎細胞浸潤明顯,無骨破壞,關節間隙基本正常;3分:有大量的血管翳形成,可見廣泛的軟骨的侵蝕破壞,可見骨破壞,關節結構遭破壞。
2.3.4 血漿CORT、抗Ⅱ型膠原抗體、IL-6、IL-10的檢測 采用ELISA方法,按照所附說明書測定血漿中CORT、抗Ⅱ型膠原抗體、IL-6、IL-10含量。
2.4 統計學處理
3 結果
3.1 CⅡ免疫誘導對不同時間去勢大鼠脾臟、胸腺及腎上腺系數的影響
表1、2顯示,胸腺系數:與對照CIA組相比,去勢1周、2周、3周CIA組大鼠胸腺系數明顯升高(P<0.05,0.01),去勢4周 CIA組與對照 CIA組相比,無顯著性差異。脾臟系數:去勢1周、2周CIA雌性大鼠脾臟系數與對照CIA組相比明顯升高(P<0.05),去勢2周CIA雄性大鼠脾臟系數與對照CIA組相亦比明顯升高(P<0.05),其余各組與對照CIA組相比,無顯著性差異。腎上腺系數:去勢3周雄性大鼠與對照CIA組大鼠相比,腎上腺系數明顯增高(P<0.05);其余各組與對照CIA組相比,無顯著性差異。
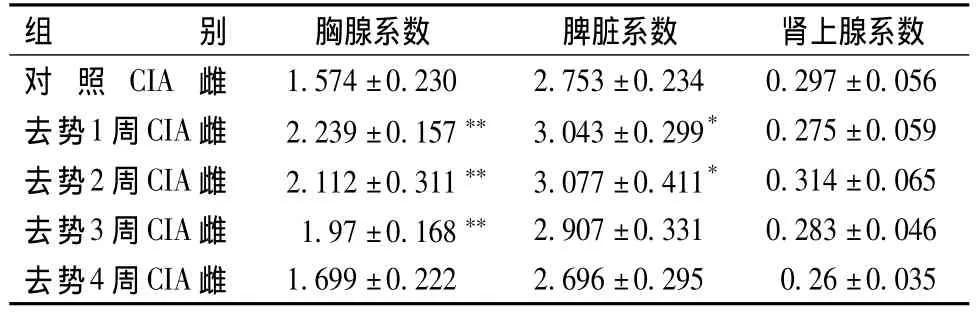
表1 各組雌性大鼠脾臟、胸腺及腎上腺系數的變化(mg/g)
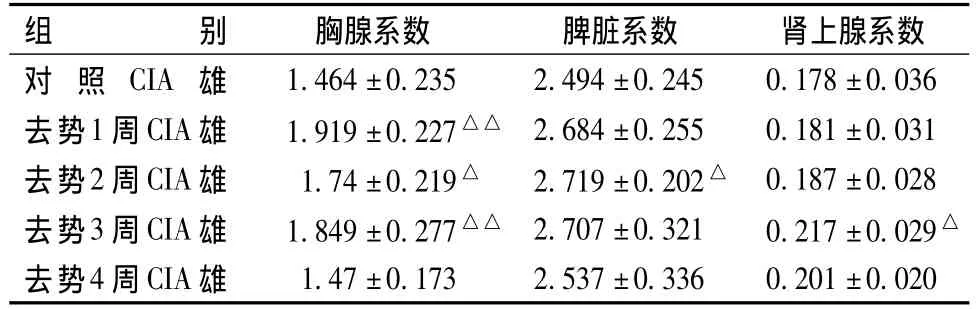
表2 各組雄性大鼠脾臟、胸腺及腎上腺系數的變化(mg/g)
3.2 CⅡ免疫誘導對不同時間去勢大鼠關節炎發病率的影響
對不同去勢時間關節炎發病情況數據進行動態分析,發現對照CIA組大鼠與CIA去勢組大鼠,或者不同去勢時間CIA大鼠發病率影響沒有顯著性差異(P=0.9159)。
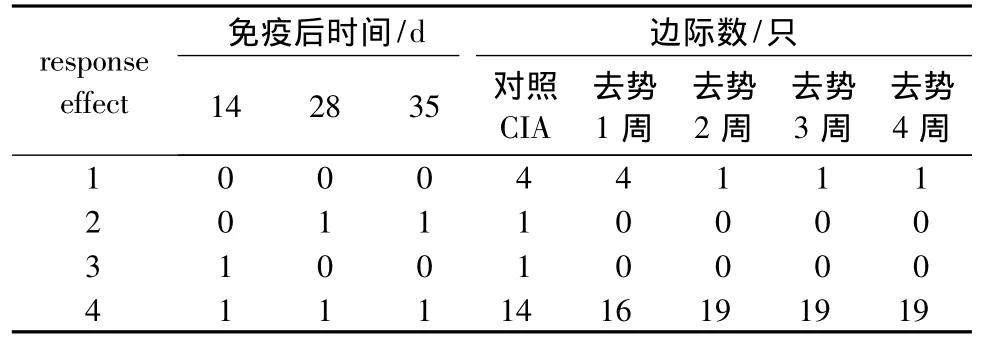
表3 CⅡ免疫誘導的SD大鼠對不同時間去勢關節炎發病情況邊際數比較
大鼠從14d開始發病然后一直持續到觀察結束仍然處于疾病狀態則視為有效發病,不同去勢時間有效發病率見表4。

表4 不同時間去勢造模大鼠有效發病率情況
3.3 CⅡ免疫誘導對不同時間去勢大鼠關節炎指數的比較
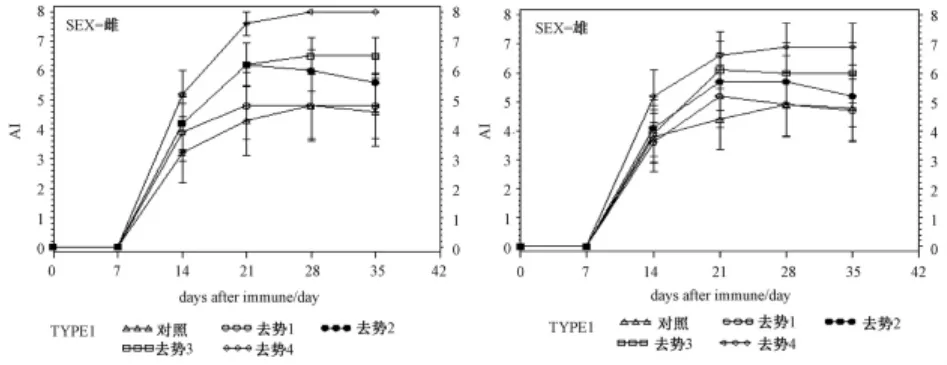
圖1 不同時間去勢CIA模型關節炎指數隨時間變化曲線圖
3.4 CⅡ免疫誘導對不同時間去勢大鼠膝、踝關節病理積分的影響
光鏡下觀察結果顯示,各組膝、踝關節可見明顯的滑膜細胞增生,排列紊亂,滑膜組織充血水腫,毛細血管增生,并可見炎細胞浸潤;增生的滑膜組織形成絨毛狀,可伸向關節腔深處,或向軟骨面爬行形成血管翳。在血管翳覆蓋下的軟骨表層可見明顯的軟骨表層組織的變性、壞死。關節軟骨面剝脫,可見關節腔內有脫剝的關節軟骨及滑膜組織。
3.5 CⅡ免疫誘導對不同時間去勢大鼠血漿中CORT含量的影響
雙因素方差分析統計結果顯示,性別對CORT影響有顯著性(P<0.0001)。數據顯示,性別和分組之間有交互作用(P<0.05),所以按性別做分層分析可以了解不同性別分組之間的差異。結果顯示,去勢后不同性別大鼠對CORT的反應變化相反,即與未去勢CIA組比較,雌性去勢CIA組大鼠血漿CORT水平明顯降低(P<0.01,P<0.05),除去勢1周組外,雄性大鼠CORT均顯著升高(P<0.01,P<0.05),且與去勢時間呈正相關,大鼠去勢3周血漿CORT與去勢4周相比,無顯著性差異。

圖2 不同時間去勢關節病理積分比較圖
3.6 CⅡ免疫誘導對不同時間去勢大鼠血漿中抗CⅡ抗體含量的影響

圖3 不同時間去勢CIA大鼠血漿CORT變化
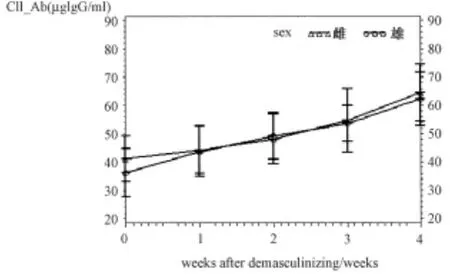
圖4 不同時間去勢CIA大鼠血漿抗CⅡ抗體變化
雙因素方差分析統計顯示性別對抗Ⅱ型膠原抗體影響無顯著性(P=0.384),去勢時間對抗Ⅱ型膠原抗體影響有顯著性差異(P<0.0001),LSD法兩兩比較顯示,隨著去勢時間增加,抗Ⅱ型膠原抗體明顯升高,與對照CIA組比較,去勢2、3、4周 CIA組大鼠血清抗Ⅱ型膠原抗體水平明顯升高(P<0.05),去勢1~4周CIA組大鼠血清抗Ⅱ型膠原抗體水平有顯著性差異(P<0.05)。
3.7 CⅡ免疫誘導對不同時間去勢大鼠血漿中IL-6含量的影響
雙因素方差分析統計結果顯示,性別對IL-6影響有顯著性(P=0.0034),數據顯示性別和分組之間無交互作用(P=0.3356),去勢時間對IL-6影響有顯著性差異(P<0.0001),兩兩比較采用LSD法檢驗,結果顯示,與對照 CIA組比較,去勢2周、3周、4周CIA組大鼠IL-6水平明顯升高(P<0.05),去勢1周、2周、3周、4周CIA組大鼠血清IL-6水平亦有顯著性差異(P<0.05),隨著去勢時間增加,明顯升高。
3.8 CⅡ免疫誘導對不同時間去勢大鼠血漿中IL-10含量的影響

圖5 不同時間去勢CIA大鼠血漿IL-6變化

圖6 不同時間去勢CIA大鼠血漿IL-10變化
雙因素方差分析結果顯示,性別對IL-10影響有顯著性(P<0.0001)。數據顯示,性別和分組之間無交互作用(P=0.3356),去勢時間對IL-10影響有顯著性差異(P<0.0001);兩兩比較采用LSD法檢驗,結果顯示,各組CIA組大鼠血清IL-10水平隨去勢時間增加,明顯升高,均有顯著性差異(P<0.05)。
3.9 動物行為學評定
圖1、2顯示,去勢2周后,大鼠無明顯行為形態異常;去勢3周后,出現活動減少、弓背蜷縮、畏寒喜暖、體毛枯疏、扎堆及飲食減少、肛周污穢等一系列與臨床貼近的腎虛證候。
4 討論
中醫理論認為,腎虛在RA發生發展中起著重要作用,選擇恰當的腎虛模型是研究腎虛型病證結合動物模型的關鍵。目前有多種制作腎虛動物模型的方法[13~16],而去勢法應用較為成熟和穩定。現代研究表明,“下丘腦-垂體-靶腺”軸不同環節、不同程度的功能紊亂是腎虛證的主要病理基礎。下丘腦-垂體-腎上腺軸(HPA)是神經內分泌的重要組成部分,糖皮質激素(人類主要為皮質醇,大鼠主要為CORT)是該軸的終末激素。實驗檢測了大鼠血漿CORT含量,發現睪丸切除后大鼠的CORT升高,且與去勢時間成正相關,而卵巢切除后大鼠的CORT水平下降。該結果說明性激素對腎上腺皮質激素有調節作用,且這種調節作用存在性別差異,有關其機制有待進一步研究。
CⅡ主要分布于軟骨和眼的玻璃體中,機體在正常的情況下,CⅡ是一種與免疫系統隔絕的蛋白,但在某些病理條件下卻可作為一種自身抗原呈現出來,誘導機體產生抗 CⅡ抗體,誘發關節炎的發生[17]。實驗結果表明,CIA大鼠含有大量抗CⅡ抗體,去勢后即腎虛條件下制作的CIA模型,抗CⅡ抗體水平明顯升高,表明抗CⅡ抗體在CIA的發病過程中起著重要的作用。細胞因子在RA的病理過程中亦是極為重要的介質。IL-6是一種具有活化T細胞、B細胞、巨噬細胞和破骨細胞等多種功能的細胞因子[18]。實驗結果表明,隨著去勢時間的延長,即腎虛程度的加重,IL-6的含量明顯增加。IL-10主要由Th2細胞產生,是一種具有很強免疫抑制及免疫調控作用的細胞因子,幾種不同的RA動物模型實驗證實IL-10具有治療作用,能抑制CIA的進展,減輕關節腫脹和軟骨破壞[19]。但實驗結果可見,去勢CIA大鼠血清中IL-10水平較對照CIA組顯著升高。隨著去勢時間的延長,即腎虛程度的加重,IL-10的含量明顯增加。有研究證實,雖然RA患者血清和關節滑液中IL-10水平高于正常,但是仍然處于相對缺乏的狀態[30]。所以CIA大鼠血漿中IL-10的升高可以視為補償性增加。
本實驗所制作的腎虛型類風濕性關節炎病證結合動物模型與人類腎虛型RA相比,有許多相似之處,具體表現在以下幾個方面:(1)動物行為學特征表現出腎虛證狀態,主要為活動減少、弓背蜷縮、體毛枯疏、扎堆及飲食減少、肛周污穢等。腎虛相關因子血漿CORT的變化與人類腎虛時皮質醇的變化相似;(2)該模型病理形態學改變主要以滑膜病變為主,與人類腎虛型RA病變亦相似;(3)抗CⅡ抗體在該動物模型上能夠明顯檢出;(4)隨著去勢時間的延長,即腎虛程度加重,CIA發病率和發病程度亦隨之增加。這與臨床上腎虛痹證病人類風濕性關節炎發病年齡有向更大年齡移動的趨勢相一致[20~22]。由此可見,本實驗制作的腎虛型RA模型既有明顯的腎虛癥狀,又有明顯的關節炎的外部表現,說明是一個成功的病證結合動物模型。實驗結果表明,隨著去勢時間的延長,即腎虛程度加重,CIA有效發病率和發病程度亦隨之增加,在去勢4周后其有效發病率就可達到95%,且發病程度明顯高于同期未去勢大鼠。在有效發病率和發病程度上,雌雄之間并無明顯差異。因此,在制作腎虛痹證(類風濕性關節炎)病證結合動物模型時,在大鼠去勢4周時就可用CⅡ進行免疫誘導。
[1]Cook A D,Rowley M J,Wines B D,et al.Antibodies to the collagen-like region of C1q and typeⅡcollagen are independent populations in systemic lupus erythematosus and rheumatoid arthritis[J].J Autoimmun,1994,(3):369-378.
[2]Choi E K,Gatenby P A,Bateman J F,et al.Antibodies to typeⅡcollagen in SLE:a role in the pathogenesis of deforming arthristis[J].Immunol Cell Biol,1990,68(Pt1):27.
[3]Cutolo M,Accuado S.Sex hormones,HLA and rheumatoid arthritis[J].J Clin Exp Rheumatol,1991,9:641.
[4]艾景錄,呂愛平.性腺功能異常型腎虛痹證發生機理的實驗研究[J].中國中醫基礎醫學雜志,1995,(2):142.
[5]Ostensen M,Veiby O P,Raiss R,et al.Reponses of normal and rheumatoid human anticular chondrocyte cultured nuder various experimental conditions in agarose[J].Scand J Rheumatol,1991,20:172.
[6]呂愛平,王安民,曾嘵蓮.益腎蠲痹丸對大鼠實驗性痹證影響的病理學研究[J].中醫雜志,1989;29(6):49-51.
[7]Clague R B,Moore L J.IgG and IgM antibody to native typeⅡcollagen in rheumatoid arthritis serum and synovial fluid[J].Arthritis Rheum,1984,27:1370-1376.
[8]Shinmei M,Masuda K,Kikuchi T,et al.Produtions of cytokines by chondrocytes and its role in proteoglycan degradation[J].J Rheumatol supl,1991,27:89.
[9]鞠大宏,于福祿,張麗坤,等.滋陰補腎法對卵巢切除所致骨質疏松大鼠成骨細胞COX-2蛋白和 mRNA表達的影響[J].中國中醫基礎醫學雜志,2006,14:44-46.
[10]Holmdahl R,Jansson L,Andersson M,et al.Immunogenetics of typeⅡcollagen autoimmunity and susceptibility to collagen arthritis[J].Immunology,1988,65(2):305.
[11]張鈞田.現代藥理實驗方法[M].北京:北京醫科大學中國協和醫科大學聯合出版社,1998:1383.
[12]C.Schneider,Y.Matsumoto.Experimental autoimmunr myositis in the Lewis rat:lack of spontaneous T2 cell apoptosis and therapeutic response to glucocorticosteroid application[J].Journal of Neuroimmunology,2000,(107):83-87.
[13]呂愛平,朱碗華,徐世杰,等.類風濕性關節炎中西醫結合應用基礎研究[M].北京:中醫古籍出版社,1999:92-166.
[14]呂愛平,王安民,艾景錄,等.腎虛痹證發病機理研究[J].中醫雜志,1995,(8):492.
[15]高崗,楊根金,婁子洋.腎虛證大鼠尿液的核磁共振譜代謝組學研究[J].第二軍醫大學學報,2009;30:565-568.
[16]陳小野,鄒世潔,王震,呂愛平,艾景錄.大鼠腎上腺次全切除腎陽虛模型胃、舌病理觀察[J].中國中醫基礎醫學雜志,1999,5:20.
[17]Takagishi K,Hotokebuchi T,Arai,et al.Collagen arthritis in rats:the importance of humoral immunity in the initiation of the disease and perpetuation of the disease by suppressor T cell[J].Intern Ren Immunol,1998,4:35-48.
[18]Choy E.Clinical experience with inhibition of interleukin-6[J].RheumDis Clin North Am,2004,30:405-415.
[19]Joosten LA,Lubberts E,Durez P,et al.Role of interleukin-4 and interleukin-10 in murine collagen-induced arthritis;protective effect of interleukin-4 and interleukin-10 treatment on cartilage destruction[J].Arthritis Rheum,1997,40:249-260.
[20]Kaipiainen-Seppanen O,Aho K,Laakso M.Shift in the incidence of rheumatoid arthritis toward elderly patients in Finland during 1975-1990[J].Clin Exp Rheumatol,1996,14:537-542.
[21]Doran MF,Pond GR,Crowson CS,et al.Trends in incidence and mortality in rheumatoid arthritis in Rochester,Minnesota,over a forty-year period[J].Arthritis Rheum,2002,46:625-631.
[22]Imanaka T,Shichikawa K,Inoue K,et al.Increase in age at onset of rheumatoid arthritis in Japan over a 30 year period[J].Ann Rheum Dis,1997,56:313-336.

