新課程化學課堂教學生成四例
喬中云
1 乙酸乙酯制備實驗
“乙酸”教學中,課堂演示實驗“乙酸乙酯的制備”,由于蒸出物含有大量的乙酸和乙醇,仔細觀察也能夠看到與飽和碳酸鈉溶液的分層現象,但是這種分層并不像苯、四氯化碳等純有機溶劑與水溶液的分層那樣有明顯的界面,不便于學生觀察,是一個教學遺憾。上課時,筆者想在飽和碳酸鈉溶液中滴加幾滴墨水來改變這個情況,結果沒有找到墨水,情急之下看到講桌上有一瓶剛剛檢驗乙酸酸性用的紫色石蕊試劑,滴加后,呈現出藍色,復習了飽和碳酸鈉溶液呈較強堿性的知識。實驗后分層現象非常清晰,學生也很興奮。又一想,既然碳酸鈉溶液是用來除去乙酸和乙醇的,那么上下兩層液體的體積肯定會發(fā)生變化。于是讓一個學生用米尺量了一下上下層液體的高度,然后振蕩試管,靜置以后觀察。奇跡出現了,清清楚楚地看到上層液體幾乎少了一半,下層液體增多,溶液的藍色也稍微變淺了,然后與學生共同探討得出有關知識結論。
2 氯堿工業(yè)電解飽和食鹽水
討論完課本上的3個問題后(蘇教版《化學反應與原理》第19頁),引導學生觀察、分析電解飽和食鹽水的原理示意圖,見圖1。
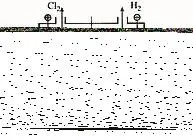
圖1 工業(yè)電解飽和食鹽水原理示意圖
一個學生提出這樣一個問題:“從圖上看,上邊的左出口分離出淡鹽水,為什么不把食鹽水中NaCl電解完呢?那樣不就可以直接得到氫氧化鈉溶液了嗎?”對學生提出的這個疑問,筆者突然發(fā)現它蘊含著電解時離子濃度影響放電先后順序的問題,生成的教學方法是重新回到剛剛討論過的問題1:“在氯化鈉溶液中存在Na+、H+、Cl-、OH-,請根據實驗事實指出哪些離子優(yōu)先在電極上發(fā)生反應。”引導學生分析:這里的“優(yōu)先”二字表明OH-離子也是可以在電極上發(fā)生反應的,當Cl-、OH-濃度達到一定的比例程度時就不再是Cl-反應而是OH-反應了,也就是說電解食鹽水是不可能將溶液中Cl-電解完的,所以當電解到一定程度時必須將稀的食鹽水分離出去重新補進高濃度食鹽水。同樣,在水溶液中能夠進行鍍鋅、有的電解電鍍要控制溶液的pH等都是與離子濃度有關的放電問題。這種即時生成的問題教學由于來自學生,比教師自己預設提問具有更大的教學吸引力,效果更佳。
3 乙醇氧化
在學習了乙醇、銅加熱催化氧化成乙醛,乙醛工業(yè)催化氧化成乙酸的知識后,知識鞏固時讓學生板演上述兩個方程式,其中有一個學生寫出的結果:
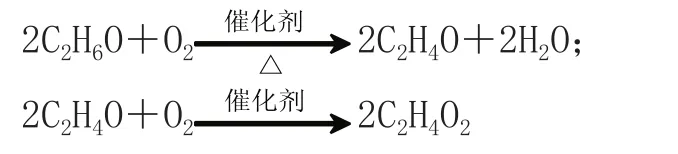
學生剛接觸有機化學,對同分異構現象問題還沒有產生很深認識,習慣熟悉思維——用物質分子式來寫化學反應方程式。面對這種錯誤,教師的反應會嚴重影響教學氣氛和后續(xù)教學效果。筆者沒有批評該學生,也沒有簡單地強調一遍了事,而是回憶“物質結構多樣性”學習中C2H6O的結構問題,加工C2H6O異構體知識以強化該知識點(有機化學反應中不能用分子式表示化學方程式的原因),待學生對此問題都完全明白以后,再面對黑板上兩個書寫認真、簡潔工整的有一定道理的“錯誤”方程式。筆者提出這樣一個問題:“同學們,××同學所寫的方程式雖然不對,但是這個錯誤的寫法卻將帶給我們一個偉大的發(fā)現,你們看從乙醇(分子式C2H6O)到乙醛(分子式C2H4O)再到乙酸(分子式C2H4O2),在這個氧化反應過程中它們的分子組成上發(fā)生了什么樣的變化?”學生興趣倍增,后來在引導下研究得出了“有機化學反應中去氫加氧是氧化反應,去氧加氫是還原反應”的結論。課堂在預設之外得到了額外的生成效果,寫方程式的學生笑了,全班學生對這個“錯誤”的印象深了,新的知識也掌握了。
4 CH3Cl的結構
高三復習課討論CH4的空間結構、有機分子中氫的等效性問題后,一個學生質疑說“CH3Cl的結構應該有2種”,這時絕大部分學生對這個問題都感覺好笑,筆者也覺得這個學生的問題很蹊蹺,他畫出的2種結構如圖2。

圖2 學生畫的CH3Cl異構體結構圖
請他解釋為什么認為這是兩種不同的結構?他說:“前一個結構中Cl原子取代的是底面三角形上的一個H原子,后一個則是取代頂點上的H原子,不一樣。”筆者問:“你認為底面三角形與另外3個立面的三角形是不一樣的嗎?”他說:“當然不一樣,底面三角形的中心有一個C原子,立面上的三角形里沒有C原子。”原來這位同學錯誤的根源是對CH4分子本身的結構理解出現了偏差,導致對CH3Cl結構的判斷錯誤。但是可以看出,他分析立體結構取代物種類的思想方法卻是正確的。筆者沒有忽略而且適當的表揚了這點,并且利用他對甲烷結構的理解錯誤向全班學生提出如下問題:“同學們,假如甲烷的分子結構真的如沈小揚同學說的這樣,請思考CH4分子中的鍵角還相同嗎?它們是多少度?CH4分子的極性如何?那么CH4的二氯、三氯、四氯取代物的結構又分別是多少種呢?”這個意外的奇怪的錯誤破壞了學生頭腦中原有的認知平衡,激發(fā)了學生思考熱情,通過討論對立體空間結構的理解產生了更好的認識,確為有效的課堂生成。

