灰氈毛忍冬次皂苷乙抑制白血病細胞HL-60的增殖及其機制研究
管福琴,馮 煦,彭 峰,單 宇,王 鳴,趙興增
江蘇省中國科學院植物研究所 (南京中山植物園)江蘇省藥用植物研究開發中心,南京 210014
灰氈毛忍冬次皂苷乙抑制白血病細胞HL-60的增殖及其機制研究
管福琴,馮 煦*,彭 峰,單 宇,王 鳴,趙興增
江蘇省中國科學院植物研究所 (南京中山植物園)江蘇省藥用植物研究開發中心,南京 210014
研究了灰氈毛忍冬次皂苷乙(MB)在體外對白血病細胞 HL-60和結腸癌細胞 LOVO增殖的抑制作用,并初步探討其分子機制。采用MTT法檢測MB的增殖抑制作用;利用 RT2ProfilerTMPCR Array芯片實時定量PCR擴增腫瘤發生中 84個關鍵基因。結果表明MB對兩種腫瘤細胞生長均有抑制作用,且對 HL-60效果更好。以 HL-60作為細胞模型,總共發現差異基因 20個,其中上調基因 14個,下調基因 6個,主要作用是阻滯細胞周期和降低細胞侵襲轉移。
灰氈毛忍冬次皂苷乙;MTT;基因芯片;細胞周期;侵襲轉移;HL-60
灰氈毛忍冬Lonicera m acranthoidesHand.Mazz.為忍冬科忍冬屬植物,具有清熱解毒、抗菌消炎的功效,在臨床上廣泛用于癰腫疔瘡、喉痹、丹毒、熱毒血痢、風熱感冒、溫熱發病等疾病的治療。中華人民共和國 2005版藥典將其作為新增品種收載,與紅腺忍冬、華南忍冬一同列入山銀花項下。雖然其在西南地區被廣泛的應用,但針對它的有效成分和藥理作用研究報道零星可見[1-7]。近年來,本課題組利用現代色譜分離技術,以藥理作用研究為指導,對灰氈毛忍冬化學成分進行系統研究,從灰氈毛忍冬干燥花蕾的乙醇提取物中分離得到三萜皂苷類成分 19個[8-10],其中包括灰氈毛忍冬次皂苷乙 (MB)。韓國的 Ahn教授曾經報道,從白頭翁花Pulsatilla koreanaN.分離出的次皂苷乙,體內體外有一定的抗腫瘤活性,對 Lewis肺癌的抑瘤率達到 50.3%[11]。因此,本課題組在驗證了次皂苷乙有一定的抗腫瘤活性的報道的基礎上[12],又首次研究其對非實體瘤的作用;同時從分子水平上,應用人腫瘤信號通路發現者芯片對次皂苷乙作用前后非實體瘤細胞 HL-60的基因表達差異進行檢測,并對差異基因進行功能分類,研究次皂苷乙的抗腫瘤作用機制。
1 材料與方法
1.1 試劑與儀器
灰氈毛忍冬次皂苷乙 (純度大于 99%)本實驗室生產[8];HL-60細胞購自中科院上海細胞庫; IMDM培養基,購自 G IBCO公司;小牛血清和青霉素、鏈霉素,購自南京生興公司;焦炭酸二乙酯 (diethyl pyrocarbonate,DEPC)購自 Sigma公司,TR IZOL試劑購自 Invitrogen公司;RNeasy?MinEluteTM純化試劑盒購自 Qiagen公司;RT2ProfilerTMPCR Array芯片、Supe rArray PCR混合液、以及 RNA逆轉錄試劑盒均購自美國 SuperArray公司。RT2ProfilerTMPCR Array芯片是專為熒光定量 PCR設計的 96孔微流卡,每孔中預置了 Super Array基因表達試劑,即經過優化設計的用以擴增目的 cDNA片段的上、下游引物和相關的熒光標記探針。腫瘤信號通路發現者 RT2ProfilerTMPCR Array可以同時測定 84個與轉化和腫瘤發生密切相關的代表性的六個信號通路有關的關鍵基因。6孔和 96孔細胞培養板 (Greiner);酶標儀(Tecan);實時定量 PCR儀 (Applied Biosystems)。
1.2 細胞培養
HL-60和LOVO細胞分別常規培養(37℃,5% CO2)于含 10%的小牛血清和青霉素、鏈霉素各 100 U/mL的 IMDM和DMEM培養基中。LOVO細胞每48 h用胰蛋白酶消化傳代。
1.3 MTT法檢測MB作用后細胞存活率
取對數生長期 HL-60和 LOVO細胞接種到 96孔板中。用不同濃度的灰氈毛忍冬次皂苷乙 (0~20μM)處理 48 h后進行檢測。通過酶標儀測吸光度值(A),測量波長 570 nm,參考波長 690 nm,并計算細胞存活率。

1.4 基因芯片分析差異表達基因
1.4.1 細胞總 RNA提取和純化
取對數生長期 HL-60細胞以 2×105/mL的濃度接種 6孔板,加人灰氈毛忍冬次皂苷乙MB,使其最終濃度為 10μM(處理組),對照組是正常培養的HL-60細胞。48 h后離心棄掉培養液上清,以磷酸鹽緩沖液 (PBS)洗滌 2次。每個樣品加入 1 mL TRIZOL試劑完全裂解細胞,氯仿抽提,異丙醇沉淀回收總 RNA,貯存于-70℃。取 Dnase I處理后 RNA,用 RNeasy?MinElute純化試劑盒純化回收 RNA,去除RNA中可能存在的DNA污染。以 1%瓊脂糖凝膠電泳和紫外分光光度計 A260nm/A280nm鑒定 RNA純度和濃度。RNA提取和純化過程使用的移液器頭,EP管和去離子水均經 0.1%DEPC處理,容器經高溫干烤,以防止 RNase的污染。
1.4.2 熒光定量 RT-PCR
取 1.5μg純化后總RNA,按試劑盒說明書逆轉錄合成單鏈 cDNA模板,存于-20℃備用。按照 RT2ProfilerTMPCR Array說明,在 96孔板中加入 PCR所需各種試劑,置于實時定量 PCR儀 AB I PR IS M7700 system進行 PCR反應。95℃10 min,激活DNA聚合酶;隨后按以下參數進行 PCR擴增:95℃15 s、60℃1 min,40個循環。PCR完成后,在AB I PrismSDS 2.1軟件上,經自動分析,查看每個基因的擴增情況,導出相應的域值循環數 (cycle at threshold),即Ct值。
1.4.3 數據分析
以看家基因 (HK基因)B2M、HGPRT/HPRT、RPL13A為陽性內對照基因,校正 cDNA模板的細胞拷貝數,計算相對量采用 2-ΔΔCt方法。

1.5 統計學分析
各組實驗平行進行,每組實驗至少重復 3次。所有數據均以 x ±s表示,采用 t檢驗進行顯著性分析,*P<0.05有顯著差異;**P<0.01有極顯著差異。
2 結果
2.1 細胞存活率測定
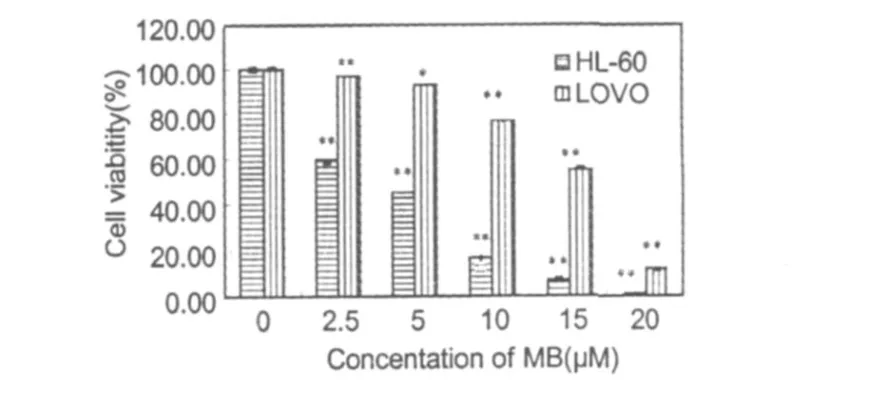
圖 1 MB作用 HL-60和LOVO細胞 48 h后細胞的存活率。數值表示為平均值 ±標準差。與對照組比較*P<0.05,**P<0.01。Fig.1 The effects ofMB on the viability of HL-60 and LOVO.Cells were treated with MB for 48 h.Each data value representsmeans±SD(n=3).*P<0.05 vs. control;**P<0.01 vs.control.
根據MTT法測定不同濃度MB處理 48 h后對HL-60和 LOVO細胞存活率的影響,發現隨著MB濃度的增加,兩種細胞存活率均明顯降低,當濃度大于20μM時,細胞幾乎完全死亡。而且MB對 HL-60的細胞增殖抑制作用更明顯(圖 1)。
2.2 基因芯片檢測結果
2.2.1 RNA質量控制結果
使用NanoDrop?ND-1000生物分析儀鑒定兩份樣品的 RNA質量。分別測定 28s/18s峰值的面積比值、A260/A280的 Ratio值、質量濃度,鑒定結果顯示樣品 RNA均無明顯降解,基本符合基因芯片測定的要求。見圖 2。
2.2.2 芯片雜交質控結果
基因組DNA控制顯示無基因組DNA污染,逆轉錄控制和陽性 PCR控制顯示 RNA純度很高,完全能滿足實時定量 PCR要求。
2.2.3 芯片雜交結果
以 2-ΔΔCt(加藥組)/2-ΔΔCt(對照組)值作為評價標準,若大于 2,則基因表達水平上調;若小于-2,則下調。結果顯示,3個看家基因在灰氈毛忍冬次皂苷乙MB作用后表達水平無明顯變化;在檢測的 84個基因中,共篩選出差異表達基因 20個,14個上調,6個下調 (表 1,表 2)。

圖2 10μM MB處理HL-60細胞 48 h后樣品 RNA的電泳結果圖。Fig.2 The agarose gel electrophoresis of RNA for HL-60 cells treated with 10μM MB for 48 h.

表1 MB處理后表達上調的基因Table 1 Upregulated genes afterMB treatment.
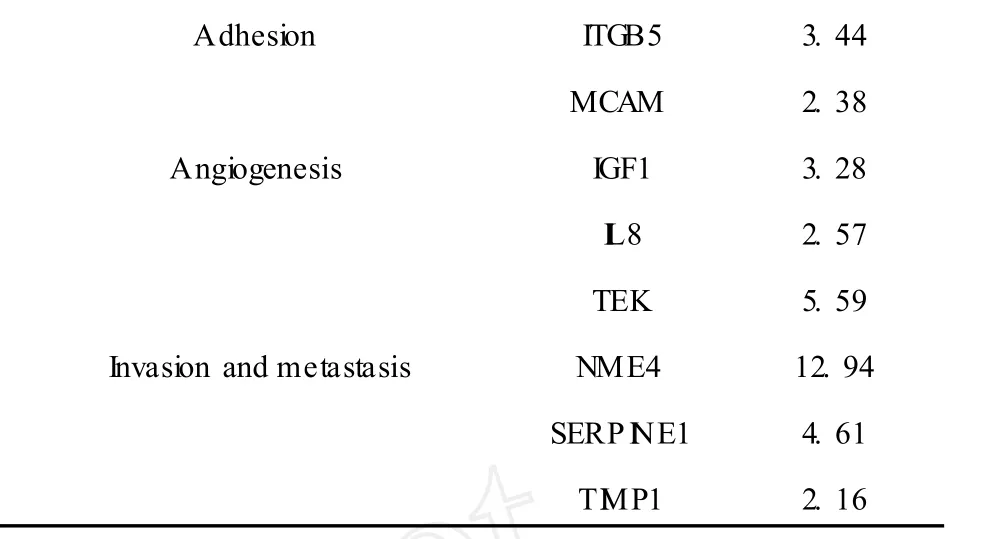
Adhesion ITGB5 3.44 MCAM 2.38 Angiogenesis IGF1 3.28 I L8 2.57 TEK 5.59 Invasion and metastasis NME4 12.94 SERP INE1 4.61 T IMP1 2.16
3 討論
三萜皂苷在自然界分布很廣泛,現代研究表明不同植物來源的多種三萜皂苷具有抗腫瘤活性,如人參、柴胡、合歡、大豆等。灰氈毛忍冬次皂苷乙,一種三萜皂苷,是本課題組從灰氈毛忍冬花蕾中分離得到,前期實驗證實其對多種實體腫瘤細胞有增殖抑制作用[11]。本實驗結果表明,MB體外不僅能抑制實體腫瘤細胞 LOVO生長,而且對非實體瘤細胞HL-60效果更好。為了進一步研究其分子機制,我們以 HL-60作為細胞模型。
不受控制的細胞增殖是惡性腫瘤的最重要特征。多數惡性腫瘤的發生、發展均與細胞周期調控功能紊亂有關,所以,調節或阻斷細胞周期是治療腫瘤的途徑之一。Hsu等[13]在肝癌細胞系 Hep G2中發現柴胡皂苷 d誘導 p53表達、進而上調 p21/ WAF1,導致 G1期阻滯。Mujoo等[14]以合歡皮中三萜皂苷類組分 F035處理人乳腺癌細胞系MDA-MB-453發現有 G1期阻滯。本實驗結果表明,AT M(毛細血管擴張性共濟失調癥突變蛋白)、CCNE1(細胞周期素 E1)基因表達上調,CDC25A(細胞周期調控因子 25A)、CDK2(細胞周期依賴性蛋白激酶 2)表達下調。AT M屬于 PIKK(磷脂酰肌醇-3-激酶樣激酶)家族,是DNA損傷檢查點的主要成員。它們被DNA損傷所激活,通過磷酸化相應的下游蛋白 CHKl(檢驗點激酶 1)和 CHK2等,調節細胞周期各個檢查點,引起細胞周期阻滯,使DNA損傷得以修復。CDC25A,是 Cdc25磷酸酶的一種亞型,對于有效地促進細胞進入 S期是必需的,在細胞周期的后期也具有作用。研究表明,CDC25A在多種癌癥中過表達[15],如肝癌、肺癌、乳腺癌、卵巢癌、結腸癌等。因此,CDC25A的下調可控制癌細胞的增殖。CDK2,定位于人 12q13,編碼 33 kD的蛋白質,為蘇氨酸激酶;CCNE1定位于人 19q12-13,編碼 50 kD的蛋白質,含一個與 CDKs相互作用的細胞周期素盒。CCNE與 CDK2結合并使之激活,形成的復合物可促進視網膜母細胞瘤蛋白 pRB的磷酸化,釋放轉錄因子E2F,促進細胞周期 G1/S期進程。CCNE/CDK2復合物的活性受多種因素調節,如 CDC25A表達下調可抑制 CCNE/CDK2的活性[16-18],阻滯 G1/S期。本研究中,灰氈毛忍冬次皂苷乙作用 HL-60細胞,可能導致 DNA損傷,激活 AT M和 CCNE1、降解CDC25A和 CDK2,從而阻滯細胞于 G1/S期。可見,灰氈毛忍冬次皂苷乙和其類似的三萜皂苷類物質(如柴胡皂苷 d,合歡皮中三萜皂苷類組分 F035)引起的細胞周期改變是一致的。
惡性腫瘤治療的最大障礙就是局部侵襲和遠處轉移,抑制腫瘤細胞侵襲轉移是抗腫瘤治療的一種重要思路。分析基因芯片篩選得到的差異表達基因,我們發現 T IMP1(組織基質金屬蛋白酶抑制因子)上調,PLAUR(尿激酶型纖維蛋白酶原激活劑的受體)下調。T IMP1作為MMPs(基質金屬蛋白酶)的抑制因子,其表達上調可以促進細胞外基質(ECM)、尤其是腫瘤周圍纖維結締組織的合成,使腫瘤周圍包膜形成,最終局限了腫瘤的生長、侵襲與轉移;其次,實驗表明 T IMPl能減少血管的形成,作用一種抑制血管生成的因子,可有效抑制腫瘤血管的形成,導致腫瘤細胞壞死,抑制腫瘤細胞轉移[19]。PLAUR,又稱 uPAR,是 uPA(尿激酶型纖維蛋白酶原激活劑)介導的激活反應的關鍵,uPA只有與細胞膜表面的 uPAR特異性的結合才能激活纖溶酶,降解腫瘤細胞外基質。灰氈毛忍冬次皂苷乙上調T IMP1表達和下調 PLAUR表達,從而降低細胞的侵襲能力和遠端轉移能力。
與傳統的研究方法相比,通過大規模、高通量的基因芯片技術研究MB對白血病細胞系 HL-60基因表達譜的影響,能同時研究大量基因的表達變化,在研究復雜生命活動時具有巨大的優勢。但生命活動的執行者是蛋白質而非mRNA,基因芯片的結果只能代表轉錄水平的變化,因此具有一定的局限性。本研究發現MB作用 HL-60細胞引起了一些非常重要的信號通路的分子改變,如細胞周期進展中的AT M、CCNE1、CDC25A、CDK2,侵襲轉移通路上的T IMP1和 PLAUR。因此推測灰氈毛忍冬次皂苷乙可能通過參與調節這些信號轉導通路而發揮其抑瘤作用,但其具體機制還需進一步研究。
總之,通過本實驗,我們發現灰氈毛忍冬次皂苷乙體外能降低 HL-60細胞的存活率,且通過 PCR芯片確定了 10μM處理后表達改變的基因,為進一步研究灰氈毛忍冬次皂苷乙抗腫瘤作用和分子機制提供了方向。
1 TongQZ(童巧珍),Zhou RB(周日寶),et al.Analysis of volatile oils ofLonicera macranthoidesin Hunan Province by GC-MS.Chin Tradit PatM ed(中成藥),2005,27:52-55.
2 Mao Q(茅青),Cao D(曹東),Jia XS(賈憲生).Studies of the chemical constituentsofLonicera m acranthoidesHand.–Mazz.Acta Phar m Sin(藥學學報),1993,23:273-281.
3 ChenM(陳敏),Wu WW(吳威巍),Sheng GQ(沈國強),et al.Chemical constituents ofLonicera macranthoidesHand.–Mazz Part V.Isolation and structures of Macranthoin F and G.Acta Phar m Sin(藥學學報),1994,29:617-620.
4 Xu XF(許小方),Li HJ(李會軍),Li P(李萍),et al. Chemical constituents in bud ofLonicera m acranthoides.Chin J NatM ed(中國天然藥物),2006,4:45-48.
5 Chen J(陳君),Xu XF(許小方),Cai XY(柴興云),et al. Chemical constituents in the budsofLonicera m acranthoides.Chin J NatM ed(中國天然藥物),2006,4:347-351.
6 Lei ZJ(雷志鈞),Zhou RB(周日寶),He YS(賀又舜),et al.Compare on antibacterial action be tween large flower-like honeysuckle flower and the certified honeysuckble.Guiding J TCM(中醫藥導報),2005,11(9):8-9.
7 Li Y M(李永梅),LiL(李莉),BaiC(柏川),et al.Effect of extracts from honeysuckle flower on anti-adenovirus.W est Chin J Phar m Sci(華西藥學雜志),2001,16:327-329.
8 Jia XD(賈曉東),Feng X(馮煦),Dong YF(董云發),et al.Saponins from flower buds ofLonicera m acranthoides.Chin Tradit Herb D rugs(中草藥),2007,38:1452-1455.
9 Chen Y(陳雨),Feng X(馮煦),Jia XD(賈曉東),et al. Triterpene glycosides from lonicera.Isolation and structural deter mination of seven glycosides from flower buds ofLonicera m acranthoides.Chem Nat Com pd,2008,44:39-43.
10 Chen Y(陳雨),Feng X(馮煦),et al.Chemical constituents in flower buds ofLonicera m acranthoides.Chin Tradit Herb D rugs(中草藥),2008,39:823-825.
11 Bang S,Lee J,Song G,et al.Antitumor activity of Pulsatilla koreana saponins and their structure– activity relationship.Chem Phar m Bull,2005,53:1451-1454.
12 Wang J(王佳),Zhao XZ(趙興增),Qi Q(齊琦),et al. Macranthoside B,a hederagenin saponin extracted from Lonicera macranthoides and its anti-tumor activities in vitro and in vivo.Food Chem Toxicol,2009,47:1716-1721.
13 Hsu YL,Kuo PL,Chiang LC,et al.Involvement of p53,nuclear factorκB and Fas/Fas ligand in induction of apoptosis and cell cycle arrest by saikosaponin d in human hepatoma cell lines.CancerLett,2004,213:213-221.
14 Mujoo K,Haridas V,Hoffmann JJ,et al.Triterpenoid saponins fromAcacia victoriae(Bentham)decrease tumor cell proliferation and induce apoptosis.Cancer Res,2001,61: 5486-5490.
15 Kristjansdottir K,Rudolph J.Cdc25 phosphatases and cancer.Chem B iol,2004,11:1043-1051.
16 Bartek J,Lukas J.Mammalian G1-and S-phase checkpoints in response to DNA damage.Cell B iol,2001,13:738-747.
17 Bartek J,Lukas C,Lukas J.Checking on DNA damage in S phase.M ol Cell B iol,2004,5:792-804.
18 DonzelliM,Draetta GF.Regulating mammalian checkpoints through Cdc25 inactivation.EMBO Rep,2003,4:671-677.
19 BakerAH,EdwardsDR,Murphy G.Metalloproteinase inhibitors:bio1ogical actions and therapeutic opportunities.J Cell Sci,2002,115:3719-3727.
Antiproliferative Effect ofMacranthoside B on Leukem ia cell lines HL-60 and ItsM echanism
GUAN Fu-qin,FENG Xu*,PENG Feng,SHAN Yu,WANGMing,ZHAO Xing-zeng
Institute of Botany,Jiangsu Province and Chinese Academ y of Sciences(Nanjing Botanical Garden,M em. Sun Yat-Sen),Jiangsu Center for Research&Developm ent of M edicinal Plants,Nanjing 210014,China
The cytotoxic effects and the molecularmechanism ofMacranthoside B(MB)were investigated in this study. The cytotoxic effects ofMB forLOVO and HL-60 cellswere detected byMTT assay.Using RT2ProfilerTMPCR Array,84 cancer-related geneswere evaluated by a high-throughput quantitative real-time RT-PCR with orwithoutMB treatment. Cell viability assay showed thatMB inhibited cell growth of two cancer cell lines,especially in human acute promyelocytic leukemia HL-60 cells.As shown in microarray,a totalof 20 differential geneswere found,14 ofwhich were upregulated and 6 were down-regulated.Their biologic functions demonstrate thatMB may exhibit anti-tumor activity against HL-60 cells by arresting cell cycle and reducing cellmetastasis.
Macranthoside B;MTT;PCR array;cell cycle;cell invasion and metastasis;HL-60 cells
R285.5;R733.7;Q946.83
A
1001-6880(2010)05-0765-05
2009-09-28 接受日期:2009-12-17
江蘇省自然科學基金(BK2008353);江蘇省藥用植物研究開發中心開放基金(2008001)
*通訊作者 Tel:86-25-84347158;E-mail:fengxu@mail.cnbg.net

