β-synuclein蛋白原核表達載體的構建與表達
陳安琪,劉學杰,崔曉棟,劉江月,張代娟,郭軍堂
(1.濰坊醫學院基礎醫學教學部,山東濰坊 261053;2.濰坊醫學院附屬醫院,山東濰坊 261041)
β-synuclein蛋白原核表達載體的構建與表達
陳安琪1,劉學杰2,崔曉棟1,劉江月1,張代娟1,郭軍堂1
(1.濰坊醫學院基礎醫學教學部,山東濰坊 261053;2.濰坊醫學院附屬醫院,山東濰坊 261041)
目的 構建人β-synuclein基因的原核表達載體,分析其在大腸桿菌中的表達。方法 從人腦組織中提取總RNA,用RT-PCR方法獲得人β-synuclein基因,克隆至pCUm-T載體中,PCR篩選陽性克隆并測序。將酶切后的目的片段克隆至原核表達載體pGEX-6P-1中,轉化大腸桿菌BL21。IPTG誘導后,經SDS-PAGE電泳分析目的蛋白的表達。結果 RT-PCR擴增出人β-synuclein基因,將其亞克隆至pGEX-6P-1構建成重組表達質粒,并在BL21中表達了β-synuclein蛋白。結論 成功構建人 β-synuclein的原核表達載體,并在大腸桿菌中表達了人 βsynuclein融合蛋白,為進一步研究β-synuclein在帕金森病中的作用奠定了良好的基礎。
β-synuclein;帕金森病;載體構建
β-synuclein蛋白由 l34個氨基酸組成,是synucleins蛋白家族成員之一。β-synuclein與 αsynuclein是同族異構體,兩者在結構上有78%的同源性,但缺失α-synuclein蛋白中部71-82位11個氨基酸長度的 NAC片段[1]。研究發現 β-synuclein能夠 抑 制 α-synuclein 聚 集[2],明 顯 的 改 善 αsynuclein轉基因鼠出現的動力缺乏,有抑制細胞凋亡的作用[3],對帕金森病(Parkinson's disease,PD)具有明顯的神經保護作用,但具體的機制尚不清楚。研究 β-synuclein與其他蛋白之間的相互作用,對于闡述 β-synuclein的神經保護作用具有重要的意義,但目前國內外關于這方面的研究報道甚少。本研究原核細胞表達帶有 GST標簽的βsynuclein融合蛋白,為通過GST pull down等方法研究β-synuclein與其他蛋白之間相互作用的研究打下良好的基礎。
1 材料方法
1.1 材料
腦組織來源于流產胎兒腦組織;質粒pGEX-6P-1和大腸桿菌 BL21、DH5α為本實驗室保存;Trizol、T4DNA連接酶及Pyrobest DNA polymerase購自寶生物工程有限公司;BamHI和 XhoI內切酶、逆轉錄試劑盒、DNA marker-D、蛋白 marker及 pCUm-T載體購自上海生工生物工程技術服務有限公司。
1.2 方法
1.2.1 RT-PCR:用Trizol從腦組織中抽提總 RNA,取1 μg RNA作為逆轉錄模板,采用 AMV First Strand cDNA Synthesis試劑盒進行 RT反應。按照試劑盒說明進行操作。
1.2.2 β-synuclein基因的克隆與鑒定:根據Genbank(ID6620)報道序列設計引物,上游引物:5′-GGATCCAGGATGGACGTGTT CATG-3′(含 BamHI酶切位 點),下 游 引 物:5′-CTCGAGCCTACGCCTCTGGC TCATACT-3′(含 XhoI酶切位點)。采用 Pyrobest DNA polymerase進行PCR擴增。PCR反應條件為:94℃預變性 2 min,循環數為 30,94℃變性 40 s,50℃退火 40 s,72℃延伸90 s,循環結束后再72℃延伸10 min。
1.2.3 pCUm-T-β-synuclein的構建:PCR產物加“A”后與 pCUm-T載體4℃進行連接。取5 μL連接反應液轉化 DH5α感受態細菌,進行藍白斑篩選。挑取白色克隆,少量提取質粒,用BamHI和XhoI雙酶切和PCR反應初步鑒定陽性克隆。將酶切鑒定和PCR反應正確的細菌克隆送交上海生工生物工程技術服務有限公司測序。
1.2.4 原核表達載體的構建:測序正確的質粒pCUm-T-β-synuclein用BamHI和XhoI進行雙酶切,純化回收 419 bp大小的目的片段,與 BamHI和XhoI雙酶切的質粒 pGEX-6P-1 4℃反應16 h,然后轉化大腸桿菌BL21感受態細菌。少量提取質粒,用BamHI和XhoI雙酶切和PCR反應鑒定陽性細菌克隆,獲得pGEX-6P-β-synuclein原核表達載體。
1.2.5 原核蛋白的誘導表達:將鑒定正確的菌株常規培養至對數中期(A600為0.5~1.0),IPTG(終濃度1 mmol/L)誘導6 h收獲菌體,PBS重懸后加入溶菌酶(終濃度 1 mg/mL),冰上放置30 min后,將0.2%Triton X-100注入裂解物中,劇烈震蕩混勻后加入DNase和 RNase(終濃度 5 μg/mL)。震蕩 10 min后,4℃ 3000 r/min離心 30 min,提取上清并加入 DTT至終濃度1 mmol/L,用0.45 μm濾膜過濾。使用10%聚丙烯酰胺凝膠進行SDS-PAGE電泳后。
1.2.6 考馬斯亮藍R250染色:將凝膠放至五倍體積的考馬斯亮藍R250染色液中,搖床上室溫緩慢旋轉3~4 h。換掉染液,用無染料的甲醇/醋酸溶液浸泡凝膠,緩慢搖動4~8 h脫色,其間換3~4次溶液。繼續脫色24 h后,用掃描儀掃描凝膠圖像。
2 結果
2.1 RT-PCR結果
擴增后的PCR產物經1.0%瓊脂糖凝膠電泳分離后得到一條約420 bp的特異條帶,與目的基因βsynuclein的大小一致(圖1)。
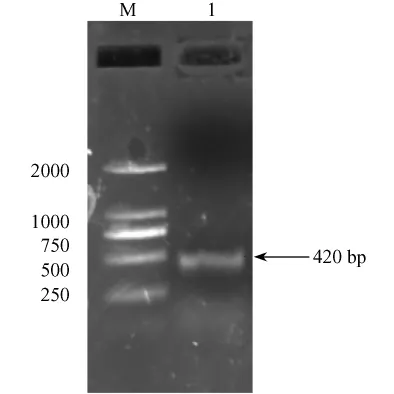
1.PCR產物;M.DNA marker-D圖1 RT-PCR結果1.PCR products;M.DNA marker-DFig.1 Electrophoresis results of RT-PCR
2.2 pCUm-T-β-synuclein的構建與鑒定
挑取白色克隆,小提質粒后進行 PCR、酶切和測序鑒定。重組質粒經BamHI和XhoI酶切后得到預期的約420 bp和2800 bp大小的兩條片段,PCR擴增得到一條約 420 bp大小的條帶(圖2)。對PCR和酶切鑒定的克隆送上海生工進行測序,測序結果與 Genbank序列(ID6620)進行 Blast序列比對,堿基序列完全一致(結果略)。證實目的基因已經克隆到pCUm-T載體中。
2.3 原核表達載體的構建與鑒定
pGEX-6P-β-synuclein經 PCR擴增得到一條約420 bp大小的條帶(圖3)。證實目的基因已經克隆到pGEX-6P-1原核表達載體中。
2.4 β-synuclein原核蛋白的表達
將 pGEX-6P-β-synuclein轉化大腸桿菌 BL21,經IPTG誘導,收集菌體進行 SDS-PAGE電泳,考馬斯亮蘭R-250染色后在預期位置約40×103處有明顯的蛋白條帶,而未經誘導的重組質粒轉化細菌在相應位置則沒有相應的蛋白條帶(圖4),說明該蛋白在大腸桿菌BL21中成功表達。
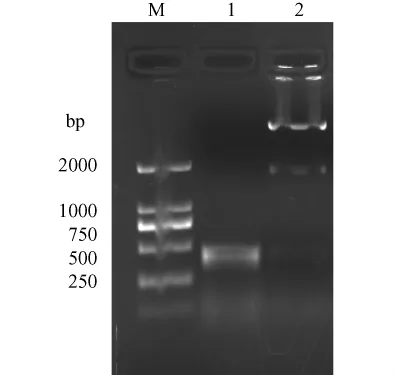
1.PCR products;2.BamHI和XhoI酶切結果;M.DNA marker-D圖2 重組 pCUm-T-β-synuclein的鑒定1.PCR products;2.pCUm-T-β-synucleindigestedbyBamHIand XhoI;M.DNA marker-DFig.2 Identification of pCUm-T-β-synuclein
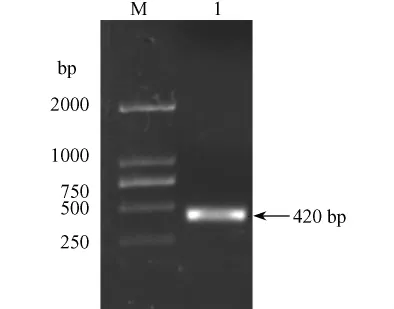
M.DNA marker-D;1.PCR products圖3 重組 pGEX-6P-β-synuclein PCR鑒定結果M.DNA marker-D;1.PCR productsFig.3 Identification of pGEX-6P-β-synuclein by PCR
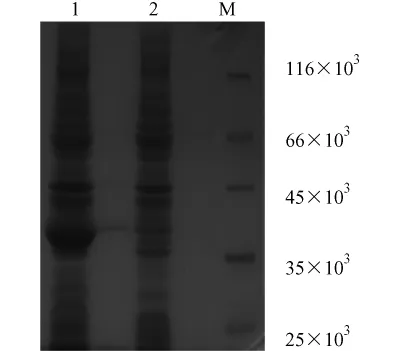
1.pGEX-6P-β-synuclein 經誘導;2.pGEX-6P-β-synuclein 未經誘導;M.蛋白Marker圖4 重組蛋白β-synuclein的鑒定1.Induced pGEX-6P-β-synuclein; 2.Non-induced pGEX-6P-βsynuclein;M.Protein markerFig.4 Expression of β-synuclein analyzed by SDS-PAGE
3 討論
β-synuclein沒有聚集形成原纖維的傾向,不具有神經細胞毒性作用[4],能夠明顯的改善由 αsynuclein聚集引起的神經元變性,對神經元細胞有明顯的保護作用[5]。β-synuclein對PD的這種神經保護作用可能與以下因素有關:(1)β-synuclein具有抗氧化作用,能夠抑制α-synuclein依賴的氧化應激[6];(2)β-synuclein能夠抑制 α-synuclein 的表達,從而抑制α-synuclein的神經毒性作用[7]。
但具體的保護機制尚未完全明了,這也是目前應用β-synuclein進行PD治療的主要障礙。
GST pull down是一種經典的用來研究蛋白相互作用的有效方法,為了發現能夠與β-synuclein相互作用的蛋白,我們采用RT-PCR法從胚胎腦組織中克隆人β-synuclein基因,并將其克隆至谷胱甘肽S-轉移酶(GST)融合表達載體pGEX-6P-1中。基因經測序證實擴增的目的序列與所需的人β-synuclein基因序列一致,適用于后續的基因表達。我們按照IPTG終濃度1 mmol/L,培養6 h進行蛋白的誘導、收獲與檢測,在蛋白電泳圖中可見約40×103的新增蛋白條帶,說明我們已經成功在大腸桿菌中誘導β-synuclein融合蛋白,提取該蛋白的方法可行,為下一步谷胱甘肽親和柱純化β-synuclein融合蛋白、GST pull down捕獲與β-synuclein作用的蛋白及研究其在PD發病機制中的作用奠定了良好的基礎。
[1] Goedert M.Alpha-synuclein and neurodegenerative diseases[J].Nat Rev Neurosci,2001,2(7):492-501.
[2] Yamin G,Munishkina LA,Karymov MA,et al.Forcing nonamyloidogenic beta-synuclein to fibrillate[J].Biochemistry,2005,44(25):9096-9107.
[3] Jakes R,Spillantini MG,Goedert M.Identification of two distinct synucleins from human brain[J].FEBS Lett,1994,345(1):27-32.
[4] Wood SJ,Wypych J,Steavenson S,et al.alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease[J].J Biol Chem,1999,274(28):19509-19512.
[5] Hashimoto M,Rockenstein E,Mante M,et al.beta-synuclein inhibits alpha-synuclein aggregation:a possible role as an antiparkinsonian factor[J].Neuron,2001,32(2):213-223.
[6] Windisch M, Hutter-PaierB, Rockenstein E, etal.Development of a new treatment for Alzheimer's disease and Parkinson's disease using anti-aggregatory β-synuclein-derived peptides[J].Mol Neurosci,2002,19(1-2):63-69.
[7] Fan Y,Limprasert P,Murray IV,et al.β-synuclein modulates α-synuclein neurotoxicity by reducing α-synuclein protein expression[J].Hum Mol Genet,2006,15(20):3002-3011.
Construction of Prokaryotic Expression Vector of β-Synuclein and Expression in E.coli BL21
CHEN An-qi1,LIU Xue-jie2,CUI Xiao-dong1,LIU Jiang-yue1,ZHANG Dai-juan1,GUO Jun-tang1
(1.Department of Basic Medicine;2.Affiliated Hospital,Weifang Medical University,Shandong Weifang 261053,China)
ObjectiveTo construct a prokaryotic expression vector of β-synuclein and analyze its expression in E.coli BL21.MethodsTotal RNA was isolated from human fetal brain tissue.The full-length human β-synuclein cDNA was obtained by RT-PCR and then inserted into pCUm-T vector for sequencing.The target gene fragment was subcloned into pGEX-6P-1 vector correctly and then transformed into E.coli BL21.The expression of β-synuclein was induced with IPTG,and analyzed by SDS-PAGE.Resultsβ-synuclein was amplified by RT-PCR and subcloned into pGEX-6P-1 properly.The recombinant fusion protein was expressed in E.coli BL21.ConclusionThe prokaryotic expression vector of β-synuclein has been successfully constructed and expressed in E.coli BL21,providing a foundation for the further study of β-synuclein in Parkinson's disease.
β-synuclein;Parkinson's disease;Gene expression;E.coli
R742
A
1005-4847(2010)06-0495-03
10.3969/j.issn.1005-4847.2010.06.010
2010-03-23
山東省衛生廳青年基金(2007QW007);濰坊醫學院博士啟動基金。
陳安琪(1981-),講師,研究方向為帕金森病發病機制。
郭軍堂(1973-),男,副教授,研究方向:帕金森病發病機制。E-mail:guojuntang@sohu.com

