高溫下Ti摻雜對Li4 SiO4吸收CO2性能的影響
汪文哲, 熊 貴, 張軍營, 趙永椿, 鄭楚光
(1.華中科技大學煤燃燒國家重點實驗室,武漢430074;2.華中科技大學電子科學與技術系,教育部敏感陶瓷工程研究中心,武漢430074)
溫室氣體CO2已造成嚴重的環境危害,它的排放日益受到人們的關注.目前我國CO2排放總量已居世界前列,而燃煤電廠是CO2排放量最大的化石燃料燃燒場所.采用固體吸收劑對CO2進行捕獲后儲存是一種有效方法.一般認為,高溫CO2固體吸收劑主要有鈣基[1-2]和鋰基兩種.氧化鈣在與CO2的反應中會釋放出大量熱量,這意味著在很高的溫度下捕獲CO2是可行的,但是也需要很高的再生溫度.鈣基吸收劑再生所需要的高溫會增加燒結的可能性及限制多次循環的耐久性.
Masahiro Kato[3]等人研究發現,一些鋰的氧化物能夠在700℃以下與周圍的CO2立即反應.Li4SiO4有4個顯著特點:吸收量大、吸收速度快、溫度和CO2濃度范圍寬廣、循環性能優越.其吸收CO2的反應式為:
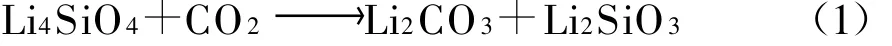
由式(1)計算,得出Li4 SiO4能夠吸收CO2的最大理論質量分數值為 36.72%.M iriam[4]、Takeshi[5]等研究了Li4 SiO4粒徑對CO2吸收的動力學和反應機理的影響.K.Essaki[6]等探討了溫度和CO2濃度等因素對CO2吸收的影響.為了獲得更好的吸收效果,國內外許多學者對Li4 SiO4進行了摻雜研究.王銀杰[7]、Victoria[8]等分別進行了Na2 CO3、K2 CO3摻雜的試驗研究,發現摻雜后比純Li4 SiO4具有更好的CO2吸收效果.C.Gauer[9]等進行了A l2O3、Fe2O3摻雜的試驗研究,發現Fe摻雜的Li4 SiO4可獲得良好的CO2吸收效果.研究表明,通過摻雜合適的金屬氧化物中的元素,使其在Li4SiO4晶體中形成空位缺陷,可以提高反應活性.
由于TiO2和SiO2的標準摩爾吉布斯函數變接近(分別為-889.50 k J/m ol和-856.64 k J/mol),而Ti4+比Si4+的離子半徑大(分別為0.068 nm和0.042 nm),在制備Li4 SiO4時,摻雜 TiO2有利于在晶體結構中形成點缺陷,增加反應活性.筆者分別采用固相合成法和溶膠凝膠法合成了Li4 SiO4材料,并在固相合成法制備Li4 SiO4時摻雜了TiO2,對選擇的樣品在固定床臺架上進行了多次循環吸收/解吸的試驗研究,以期達到更好的CO2吸收效果.
1 試驗部分
1.1 Li4 SiO4的制備
固相合成法制備 Li4 SiO4的方法如下:準確稱取n(SiO2)∶n(Li2 CO3)=1∶2的反應原料,用無水乙醇作為溶劑混合在球磨罐中,以350 r/min的轉速球磨2 h,再將樣品烘干,過篩后在800℃下煅燒4 h,冷卻后得到Li4 SiO4(s-s)樣品;然后將制備得到的樣品破碎研磨,經孔徑250μm標準篩過篩備用.
溶膠凝膠法制備 Li4 SiO4的方法如下:將Li2CO3溶解在去離子水稀釋的醋酸中,在磁力攪拌的同時將正硅酸乙酯(TEOS)按要求加入,將混合液在70℃下烘干,過篩后在800℃下煅燒4 h,冷卻后得到Li4SiO4(s-g)樣品;然后將制備得到的樣品破碎研磨,經孔徑250μm標準篩過篩備用.
摻雜Ti的固溶體 Li4Si1-xTixO4制備方法如下:準確稱取各物質的 n(SiO2):n(TiO2):n(Li2 CO3)=(1-x/2):x:2,摻雜量 x分別取 0、0.02、0.04、0.06、0.08 和 0.10,采用固相合成法制備.
試驗所用的 Li2 CO3、TiO2、SiO2、正硅酸乙酯(TEOS)、醋酸、無水乙醇等試劑均為分析純.
1.2 試驗設備和臺架
X射線衍射儀為荷蘭帕納科公司PANalytical B.V.生產的 X′Pert Pro衍射儀,該儀器使用Cu靶,X射線發生器的最大功率為3 kW.比表面分析(BET)采用美國麥克儀器公司生產的ASAP2020型比表面積與孔徑測定儀在等溫下利用氮吸附進行測試.利用北京光學儀器廠生產的WCT型熱分析儀進行TG測試.由立式管式爐搭建成固定床臺架,在其上進行高溫下Li4 Si1-x Ti x O4樣品對CO2循環吸收/解吸的試驗.
2 結果與討論
2.1 樣品表征
圖1為采用溶膠凝膠法與固相合成法制取的Li4 Si1-x Ti x O4(x為TiO2的摻雜比例)的 XRD圖譜,其特征衍射峰與Li4 SiO4(01-076-1085)相吻合.從圖中可以看出,溶膠凝膠法和固相合成法制得的Li4 SiO4純度均較高,衍射峰峰值的差別表明晶體結構有所不同.隨著x的增加,樣品特征衍射峰強度的大小和相對比值也有所不同.各種固溶體中均未出現TiO2衍射峰,說明TiO2參與了反應,Ti4+替代了部分Si4+,由于 Ti4+的半徑遠大于Si4+,材料的晶體結構產生了正畸變,在晶格中形成點缺陷,這樣有助于提高Li4 SiO4材料吸收CO2的活性.但隨著TiO2摻雜量的增加,Li4SiO4的合成量也減少了.

圖1 800℃煅燒4 h制備的Li4Si1-x Ti x O4的XRD圖Fig.1 XRD patterns of Li4 Si1-x Ti x O4 samp les sin tered at 800℃for 4 h

表1 制備吸收劑的表征結果Tab.1 Characterization resu lts of several Li4 SiO4 samp les prepared
表1列出了制備的幾種樣品的表征結果.由表1可知,由溶膠凝膠法和高溫固相法制得的Li4 SiO4比表面積、孔容和孔徑均相差不大.對于摻雜了TiO2的固溶體 Li4 Si1-x Ti x O4,當 x=0.02時,固溶體的孔徑值大于其他測試樣品,比表面積和孔容均較小;當x=0.04時,比表面積和孔容又明顯地增大.結合圖1分析,當TiO2的摻雜量x=0.02時,摻雜量較少,反應進行完全,生成的固溶體比表面積較小;而當x≥0.04后,Li4 SiO4衍射峰強度變小,且出現了少量其他生成物,使得固溶體的比表面積又增大.
2.2 CO2分壓對吸收效果的影響
在熱重分析儀上對Li4SiO4(s-s)吸收劑在不同CO2分壓下的吸收效果進行測試,結果示于圖2.試驗中控制氣體總流量為60 m L/m in,以20 K/min的升溫速率從室溫升到1 000℃.
從圖2可以看出,隨著CO2分壓的降低,Li4SiO4(s-s)對CO2的最大吸收量急劇減少.在純CO2氣氛下,氣體流量為60 m L/min時,Li4 SiO4(ss)對CO2的最大吸收量可達29.56%.當CO2和N2的流量分別為50 m L/min和10 m L/m in時,其最大吸收量減少到10%以下;當CO2分壓為50%時,最大吸收量進一步減少,只有5%左右;當CO2分壓為20%左右時,樣品質量僅有微量的增加.由此可見,CO2分壓對高溫下Li4 SiO4吸收CO2具有很大影響,分壓越大,吸收量也越大,吸收效果越好.
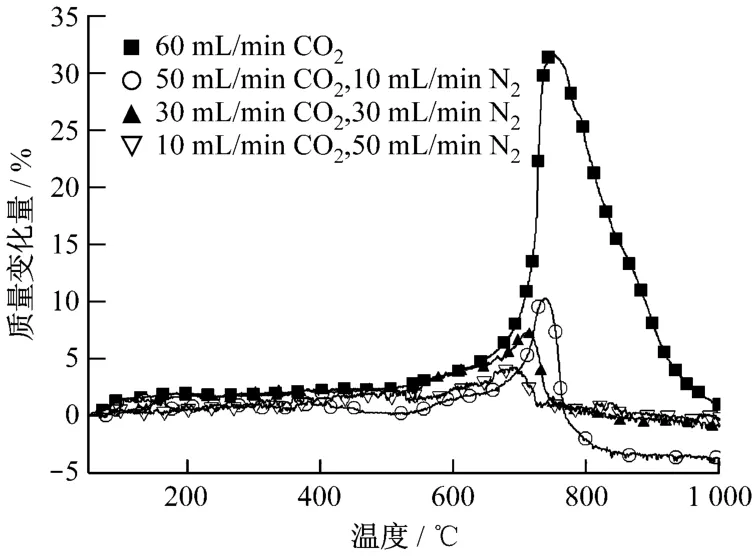
圖2 不同CO2分壓下Li4SiO4(s-s)的TG曲線Fig.2 Thermogravim etric analysis cu rves of Li4SiO4 samples at different partialp ressuresof CO2
2.3 CO2吸收試驗
各種Li4 Si1-x Ti x O4樣品在純CO2氣氛下的熱重曲線示于圖3.試驗中氣體流量為60 m L/m in,升溫速率為20 K/min.從圖中可看出,Li4 Si1-x Ti x O4樣品在550℃后開始快速吸收CO2,質量迅速增加,在750℃時達到最大值,然后進入解吸過程,而在800~1 000℃時,樣品質量下降到初始值,CO2解吸完全.
比較分別由高溫固相法和溶膠凝膠法制取的Li4 SiO4樣品的熱重曲線發現,CO2的最大吸收量相近,均為29.56%左右,達到最大吸收量的溫度也相同,CO2解吸速率和程度也相似,但后者吸收速率更快,能夠更快地達到最大吸收量.

圖3 純CO2氣氛下Li4Si1-x Ti x O4的TG曲線Fig.3 Thermogravimetric analysis curves of Li4Si1-x Ti x O4at pure CO2atmosphere
對摻雜了TiO2固溶體Li4 Si1-x Ti x O4的熱重試驗結果進行對比,發現當摻雜量x=0.02時,固溶體 Li4 Si0.08 Ti0.02 O4有最大的CO2吸收量,可達31.59%.說明摻雜微量TiO2使晶體結構產生了正畸變,形成了一部分點缺陷,在晶格中引入的空位減小了O2-的擴散阻力,提高了Li4 SiO4吸收CO2的活性.但隨著x的繼續增加,固溶體中Li4SiO4的含量相對減少,也減弱了吸收CO2的效果.從圖中還可以看出,在x≥0.04后,各固溶體達到最大吸收量時的溫度均比未摻雜的樣品下降,質量增加的溫度區間減小,吸收量相應減少.試驗表明,比表面積的大小與樣品的CO2吸收量無直接關系,物理吸附并不是Li4 SiO4吸收CO2效果的決定因素.
2.4 固定床CO2循環吸收/解吸試驗
試驗所用的固定床臺架示意圖見圖4.試驗前通入純CO2,控制氣體流量為0.5 L/m in,分別設定立式管式爐的上下兩段爐膛溫度恒定為700℃和850℃,即為CO2吸收和解吸的反應溫度.試驗時稱取適量樣品放入石英坩堝內進行CO2吸收試驗,在700℃保溫一段時間后將樣品取出,在干燥皿內冷卻后放入電子天平稱量,然后將樣品放入管式爐中內管的底端進行解吸,在850℃保溫適當時間后將樣品取出,冷卻后再次稱量,如此反復進行.
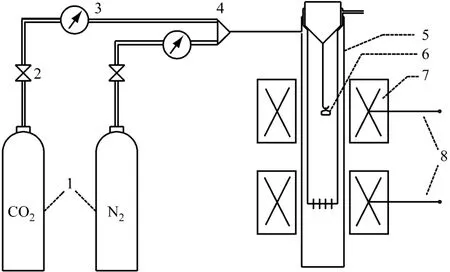
圖4 CO2循環吸收/解吸固定床臺架示意圖Fig.4 Schematic diagram of the fixed bed fo r cyc lic CO2 absorp tion/desorption test
為了測定Li4 SiO4(s-s)在700℃時達到最大CO2吸收量的吸收時間,分別取保溫時間為 10 min 、15 min 、20 min 、25 min 和 30m in,結果示于表2.在保溫25 min后,CO2吸收量可達28.82%,接近保溫30 min后的吸收量(29.34%).因此,在循環試驗時,保溫時間設定為25 min.
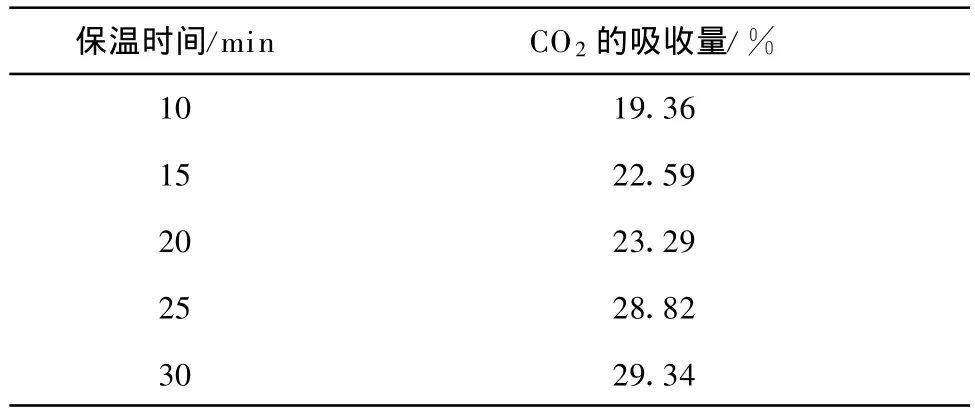
表2 不同保溫時間對Li4 SiO4(s-s)吸收CO2量的影響Tab.2 Effects of holding time on CO2 absorption by Li4 SiO4(s-s)
將制備的 Li4 SiO4樣品在固定床臺架上進行CO2循環吸收/解吸試驗.經過20次循環,CO2的吸收量如圖5所示.由圖5可知,Li4 SiO4(s-s)和Li4Si0.08Ti0.02O4樣品均在第1次保溫25 min時達到最大的CO2吸收量,分別為28.82%和28.68%;在第2次循環后,吸收量分別僅為 9.94%和12.47%;第3次時吸收量開始上升,從第4次后樣品對CO2的吸收量分別穩定在20%和23%左右;循環20次后,Li4 SiO4(s-s)和 Li4 Si0.08 Ti0.02O4樣品對CO2的吸收量分別下降了30%和20%.
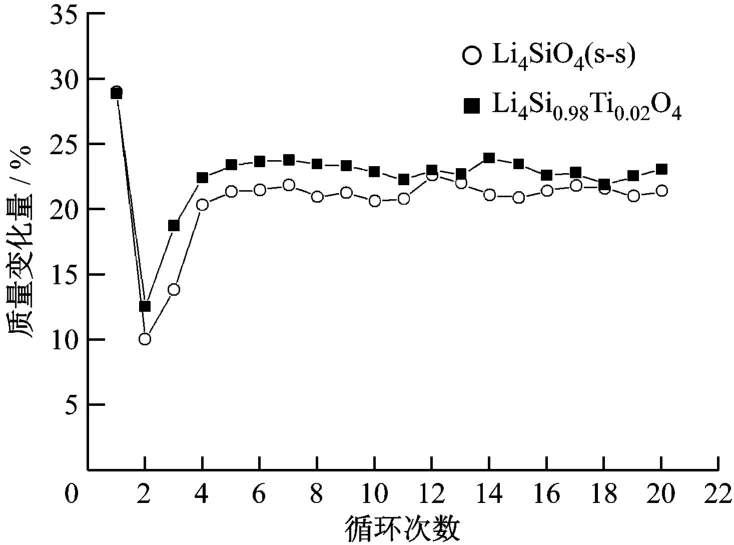
圖5 20次循環中CO2的吸收/解吸量Fig.2 W eight changes of CO2 after 20 cyclesof absorption/desorp tion test
在第2次和第3次循環時,樣品對CO2的吸收量急劇下降,這可能是由于在樣品制備時煅燒溫度只有800℃,而在循環試驗中解吸溫度為850℃,樣品的再次煅燒引起了材料結構和性能發生進一步變化,導致在第2次和第3次循環中CO2的吸收效果下降,但吸收劑的性能在此后的循環中得以恢復.在第4~第20次循環中,固溶體Li4 Si0.08 Ti0.02O4基本達到完全再生,說明此樣品具有優良的再生性能,并且在高溫下有較大的CO2吸收量,可以作為在高溫煙氣中脫除CO2的固體吸收劑.
3 結 論
(1)與固相合成法制備的Li4 SiO4材料相比,溶膠凝膠法制備的 Li4 SiO4材料具有更高的吸收速率,更有利于高溫CO2的吸收.
(2)CO2分壓對高溫下Li4 SiO4吸收CO2有很大影響,分壓越大,吸收的CO2量也越大.
(3)當 TiO2的摻雜量 x=0.02時,固溶體Li4Si0.08Ti0.02O4吸收劑具有較快的吸收速率和良好的吸收效果,最大吸收量可達 31.59%.隨著TiO2摻雜量的繼續增加,吸收劑中Li4 SiO4含量減少,對CO2的吸收能力迅速下降.
(4)在固定床臺架上經過20次CO2循環吸收/解吸后,固溶體Li4 Si0.08 Ti0.02O4對CO2的吸收量僅下降了20%,其中在第4~第20次循環中基本達到完全再生,說明此樣品具有優良的再生性能,并且在高溫下有較大的CO2吸收量,可以作為在高溫煙氣中脫除CO2的固體吸收劑.
[1] ABANADES JC,ANTHONY E J,WANG Jinsheng,et a l.Fluidized bed combustion systems integrating CO2cap ture with CaO[J].Environment Science Technology,2005,39(8):2861-2866.
[2] 李英杰,趙長遂.基于鈣基吸收劑的循環鍛燒/碳酸化反應吸收CO2的試驗研究[J].動力工程,2008,28(1):117-121.LI Yingjie,ZHAO Changsui.Experimental study based on calcium-based absorbent cyclic reaction(CCR)for CO2-capture[J].Journal of Power Engineering,2008,28(1):117-121.
[3] KATO Masahiro,NAKAGAW A Kazuaki,ESSAK I Ken ji,et a l.Novel CO2absorbents using lithium-containing oxide[J].International Journal of Applied Ceram ic Technology,2005,2(6):467-475.
[4] VENEGAS M iriam J,FREGOSO-ISRAEL Esteban,ESCAM ILLA Raul,etal.K inetic and reactionmechanism of CO2sorp tion on Li4SiO4:study of the particle size effect[J].Industrial and English Chem istry Resarch,2007,46(8):2407-2412.
[5] OKUMURA Takeshia,MA TSUKURA Yusuke,GOTOU K im ika,et al.Particle size dependence of CO2absorp tion rate of powdered Li4SiO4w ith different particle size[J].Journal of the Ceram ic Society of Japan,2008,116(12):1283-1288.
[6] ESSAK I K,KATO M,UEMOTO H.Influence of temperature and CO2concentration on the CO2absorption p roperties o f lithium silicate pellets[J].Journal of Materials Science,2005,40(18):5017-5019.
[7] 王銀杰,其魯,代克化.Na摻雜對硅酸鋰吸收CO2性能的影響[J].物理化學學報,2006,22(7):860-863.WANG Yin jie,QI Lu,DA IKehua.Effect of Na-doping on CO2absorption of Li4SiO4[J].Acta Physico-Chim ica Sinica,2006,22(7):860-863.
[8] MEJIA-TREJO V ictoria L,FREGOSO-ISRAEL Esteban,PFEIFFERHeriberto.Tex tural,structura land CO2chem isorp tion effects p roduced on the Lithium O rthosilicate by its doping w ith sodium(Li4-xNaxSiO4)[J].Chem ica lMaterial,2008,20(22):7171-7176.
[9] GAUER C,HESCHEL W.Doped lithium orthosilicate for absorption of carbon dioxide[J].Material Science,2006,41(8):2405-2409.

