國產與進口奧美拉唑腸溶膠囊在健康人體內的藥代動力學和生物等效性研究
袁曉瓊,楊 輝,周遠大
(重慶醫科大學附屬第一醫院,重慶 400016)
奧美拉唑(omeprazole)為苯并咪唑類化合物,能選擇性抑制胃壁細胞膜的H+-K+-ATP酶活性,對于基礎胃酸分泌和各種刺激引起的胃酸分泌具有強而持久的抑制作用,臨床主要用于治療胃潰瘍、十二指腸潰瘍、應激性潰瘍、反流性食管炎和卓-艾綜合征(胃泌素瘤)等[1-2]。奧美拉唑在酸性條件下不穩定,為避免其在胃中分解,故制成腸溶制劑。為評價國產制劑的質量,筆者參照相關文獻建立了測定奧美拉唑血漿濃度的高效液相色譜法[3-5],比較了國產與進口奧美拉唑腸溶膠囊在健康人體內的藥代動力學過程。
1 儀器與試藥
Agilent1100系列高效液相色譜儀,Agilent1100泵系統,Agilent 1100可調波長紫外檢測器和Agilent 1100工作站。受試制劑(T制劑)為重慶蕓峰藥業有限公司研制的奧美拉唑腸溶膠囊,規格為20 mg/粒,批號為050102,含量為100.4%;參比制劑(R制劑)為阿斯利康制藥有限公司生產的奧美拉唑腸溶膠囊(商品名洛賽克),規格為20 mg/粒,批號為0502019;奧美拉唑對照品(重慶市華鼎現代生物制藥有限責任公司);替硝唑(內標,中國藥品生物制品檢定所)。甲醇、乙腈為色譜純,磷酸二氫銨為分析純,所有試驗用水均為重蒸餾水。
2 方法與結果
2.1 血藥濃度測定
2.1.1 色譜條件
色譜柱:Phenomenex? C18柱(250 mm ×4.6 mm,5μm);固定進樣環:100μL;流動相:甲醇-0.1 mol/L乙酸胺緩沖液-二乙胺(62 ∶38 ∶0.5);流速:0.8 mL/min;紫外檢測波長:302 nm;柱溫:室溫。在此條件下,奧美拉唑與內標替硝唑及血漿中內源性雜峰分離良好(圖 1)。
2.1.2 溶液配制
精密稱取奧美拉唑13.45 mg,用適量甲醇溶解后,置25 mL量瓶中,加甲醇至刻度,混勻,即得質量濃度為538μg/mL的奧美拉唑標準貯備液。使用時以甲醇稀釋為53.8μg/mL的奧美拉唑標準溶液。精密稱取替硝唑標準對照品29.3 mg,用適量甲醇溶解,置50 mL量瓶中,加甲醇至刻度,混勻,即得質量濃度為586μg/mL的替硝唑標準貯備液。使用時以甲醇稀釋為3.516μg/mL的替硝唑標準溶液。

2.1.3 血漿樣品處理
取受試者血漿1.0mL,加入替硝唑標準溶液50μL和0.1mol/L氫氧化鈉適量,混勻,加4 mL乙醚,旋搖1 min,靜置,取乙醚層,于40℃水浴中用氮氣吹干,加100μL流動相復溶,進樣分析。
2.1.4 方法學考察
標準曲線制備:在空白血漿中添加奧美拉唑使血藥濃度分別相當于 4.8,4.0,1.0,0.25,0.062 5,0.015 6,0.003 9 μg/mL,按血漿樣品的處理與測定方法進行處理和測定,所得數據經回歸,得標準曲線方程 Y=7.924 6 X-0.082 90,r=0.999 93(n=7)。
回收率及精密度試驗:按照標準曲線制作方法,采用高、中、低3個質量濃度,結果血漿中奧美拉唑含量的回收率見表1,日內、日間相對標準差(RSD)見表2,最低定量質量濃度為0.003 9μg/mL,RSD=7.50%(n=5)。

表1 高效液相色譜法測定血漿中奧美拉唑含量的回收率(n=5)
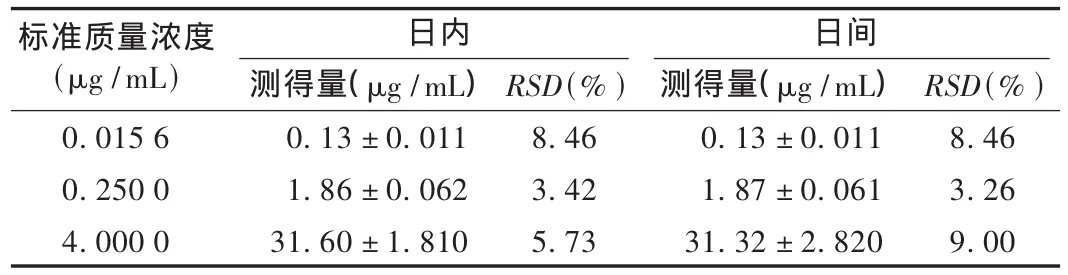
表2 日內和日間精密度測定結果(n=5)
穩定性試驗:將奧美拉唑和替硝唑混合標準溶液于室溫放置,0,5,10,24,48 h時進行測定,測得奧美拉唑質量濃度分別為0.14,0.14,0.14,0.15,0.13 μg/mL,平均(0.14 ±0.007 1)μg/mL,RSD=5.05%(n=5),結果表明室溫放置48 h穩定性良好。將含藥血漿反復冷凍(-20℃)、融化,按血漿樣品的處理與測定方法進行處理和測定,3 d內測定5次,測得奧美拉唑質量濃度分別為0.41,0.38,0.41,0.40,0.42μg/mL,平均(0.40±0.0152)μg/mL,RSD=3.75%(n=5),結果表明血漿樣品3 d內反復凍融穩定性良好。
2.2 血藥濃度測定方法與結果
20名健康志愿者均為男性,年齡(22.8±2.09)歲,體重(61.2±6.5)kg,身高(168.5±5.41)cm,經血尿常規、肝腎功能及心電圖檢查均示健康,且試驗前2周內未服任何藥品,均簽署知情同意書并經本院倫理委員會批準。隨機分成兩組,每組10名,分別單劑量給予進口或國產奧美拉唑 60 mg,在給藥后 0.5,1,2,3,4,5,6,8,10,12,24 h 各取前臂靜脈血3 mL,離心分離血漿0.5mL,于-18℃保存待測。20名受試者用藥后各時間點平均血藥濃度-時間曲線見圖2。
2.3 藥代動力學參數
健康志愿者不同時間測得的血藥濃度數據用3P97程序經計算機迭代擬合,結果顯示兩種奧美拉唑腸溶膠囊分別口服60 mg后的體內過程均符合一室開放模型(表3),兩種腸溶膠囊主要藥代動力學參數經統計檢驗無顯著性差異(P>0.05)。結果表明,國產奧美拉唑腸溶膠囊在健康人體內的藥代動力學過程與進口制劑相似,主要藥代動力學參數與文獻報道一致[4]。
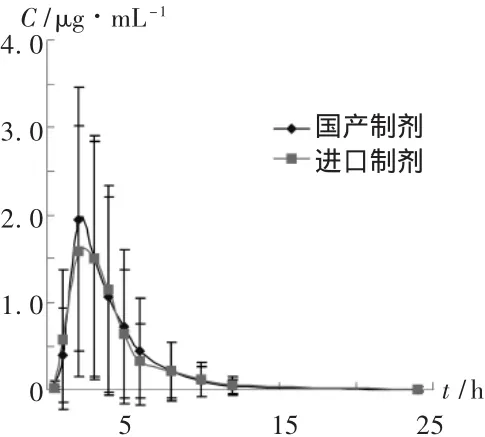
圖2 受試者用藥后各時間點平均血藥濃度-時間曲線圖

表3 兩種奧美拉唑腸溶膠囊的藥代動力學參數比較(n=20)
2.4 生物等效性評價
將 AUC0-∞,tmax,Cmax分別經三因素方差分析,國產與進口制劑間、周期間差異均不顯著(P>0.05)。國產制劑與進口制劑的 AUC0-∞分別為(7.31±6.98)μg·h/mL 和(7.10±6.45)μg·h/mL,國產制劑相對生物利用度為(103.61±16.14)%。方差分析結果經對數轉換,兩種制劑間無顯著差異,F(1,18)=0.208 5,P>0.05;雙單側 t檢驗 t1=6.338,t2=5.424,等效;(1-2α)置信區間為[95.3%,108.7%],等效。國產制劑與進口制劑的 AUC0-t分別為(7.18±6.86)μg·h/mL 和(6.93±6.37)μg·h/mL,國產制劑相對生物利用度為(95.54±10.99)%。方差分析結果經對數轉換,兩種制劑間無顯著差異,F(1,18)=0.453 4,P >0.05;雙單側 t檢驗 t1=6.917,t2=5.570,等效;(1-2α)置信區間為[96.3% ,109.0%],等效。國產制劑與進口制劑的 Cmax分別為(2.19±1.53)μg/mL和(2.13±1.48)μg/mL。方差分析結果經對數轉換,兩種制劑間無顯著差異,F(1,18)=0.057 2,P >0.05;雙單側 t檢驗 t1=2.839,t2=2.361,等效;(1-2α)置信區間為[88.0%,118.5%],等效。國產制劑與進口制劑的 tmax分別為(2.30±0.73)h和(2.20±0.89)h,經非參數統計方法(Wilcoxon法)進行統計分析,兩種制劑間無顯著差異(P>0.05)。結果表明,兩種腸溶膠囊為生物等效制劑。
3 討論
奧美拉唑經肝細胞P450酶系催化代謝,主要代謝途徑為羥化代謝。從血藥濃度測定結果可以看出,奧美拉唑在體內消除迅速,受試者血藥濃度個體差異較大,其原因可能是人群中存在著與 s-美芬妥英代謝表型相關的羥化代謝多態性,表現為某些個體對藥物的羥化代謝能力低下或發生缺陷,使原型藥物消除減慢,消除半衰期延長和 AUC明顯增加,從而使個體差異增大。由于奧美拉唑的療效與血藥濃度之間無直接關系,因此這兩種制劑的臨床療效比較有待于進一步研究。
[1]聶浩鴻,田維霞.克拉霉素與奧美拉唑、阿莫西林聯合治療慢性胃炎82例[J].中國藥業,2008,17(9):55.
[2]古 莉,鄧德明.凝血酶加奧美拉唑治療殘胃出血40例[J].中國藥業,2008,17(11):60.
[3]王樂群,馬長清.高效液相色譜法測定奧美拉唑腸溶膠囊的含量[J].中國藥師,2008,11(6):656-657.
[4]陳少波,吳定國.高效液相色譜法測定健康人血漿中奧美拉唑的濃度[J]. 醫藥導報,2006,25(10):999-1 000.
[5]鄧 鳴,張曉麗,侯艷寧.高效液相色譜法測定人血漿中奧美拉唑濃度[J].中國藥事,2006,20(12):759-761.

