原發性痛風合并腎損害的臨床研究
陳國崇
痛風是由于嘌呤代謝紊亂和血尿酸增高而引起的以關節炎為主的疾病,但是其也可以損害內臟,尤其是腎臟,嚴重者可以發展為腎衰竭而危及生命,因此對于痛風患者腎損害的早期發現顯得尤為重要,具有重大的價值[1]。2000年1月至2009年7月本院收治76例原發性痛風合并腎損害的患者,現對其臨床資料進行回顧分析,旨在探討其臨床特點及治療方法。
1 臨床資料
1.1 一般資料 住院治療的原發性痛風患者共98例,其中男50例,年齡30~76歲,平均為61.5歲。女48例,年齡36~70歲,平均62.6歲。所有患者的診斷標準均符合1977年ACR急性痛風關節炎分類標準,同時排除了繼發性痛風、假性痛風、類風濕關節炎等。
1.2 方法 比較單純痛風患者和痛風合并腎損害患者的白蛋白、β-2微球蛋白和托-霍蛋白的差別;同時,對比分析痛風合并腎損害患者治療前后的臨床表現、血清肌酐的變化以及對預后的影響。
1.3 統計學方法 數據分析采用SPSS 12.10統計軟件,計量資料用均數±標準差表示。計量資料組間差異的顯著性檢驗采用t檢驗。
2 結果
2.1 發生率 98例患者中有76例出現腎臟損害(77.55%),其中14例夜尿增多(18.42%),12例出現輕、中度的蛋白尿(15.79%),8例出現低蛋白血癥(10.53%),10例腎臟B超顯示集合系統炎癥(26.32%),12例合并尿路結石(15.79%),20例出現腎功能不全(26.32%),其中3例需維持性血液透析治療。
2.2 臨床特點 如表1所示,單純痛風患者與痛風合并腎損害患者相比,尿白蛋白、尿β-2微球蛋白和尿托-霍蛋白顯著升高。此外,98例患者尿酸296.6~770.7 μmol/L,升高者84例(85.71%);血清肌酐 60.1~960.0 μmol/L,升高者 37例(37.76%);血紅蛋白65~165 g/L,偏低者43例(43.88%);血清白蛋白28.3~51.2 g/L,偏低者8例(8.16%);尿比重1.005~1.025,低比重尿68例(69.39%);蛋白尿 +-++12例(12.24%);鏡下血尿8例(8.16%);腎臟B超顯示集合系統炎癥10例(10.20%);腎臟縮小6例(6.12%);尿路結石12例(12.24%);伴有痛風石11例(11.22%)。
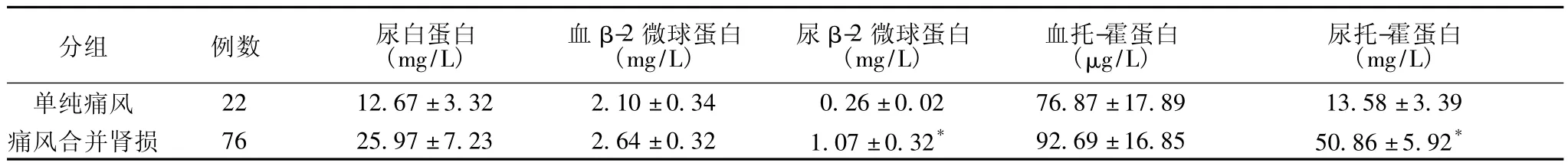
表1 單純痛風患者與痛風合并腎損害患者的白蛋白、β-2微球蛋白和托-霍蛋白
2.3 治療 診斷明確后,給予綜合治療,包括低熱能飲食,避免高嘌呤食物,避免暴食、受涼、過度疲勞等,鎮痛治療,抑制尿酸形成及促進尿酸排泄,堿化尿液、使pH值保持在6.5左右,防治感染,糾正貧血,避免使用噻嗪類利尿劑及β受體阻滯劑和鈣拮抗劑,嚴重腎功能不全給予血液透析治療。
2.4 預后 大多數患者血尿酸水平迅速下降,腎功能有明顯好轉,僅3例需維持性血透治療。
3 討論
原發性痛風多見于40歲以上的男性,其病因主要為遺傳因素,并與肥胖、原發性高血壓、血脂異常、糖尿病、胰島素抵抗關系密切。由于嘌呤代謝或/和尿酸排泄異常,導致高尿酸血癥。使得過飽和狀態的尿酸鹽沉積于關節、皮下,臨床上可表現為發作性關節炎、關節變形及功能障礙、痛風石等,X線表現為受累關節面骨質穿鑿樣破壞,這為痛風關節典型的X線特征,或者可表現為骨質疏松,伴關節間隙狹窄,周圍軟組織腫脹。腎臟損害不僅是原發性痛風患者的常見并發癥,也是嚴重并發癥,發生率高(本組患者為77.55%),是導致原發性痛風患者生活質量下降、病死的主要原因之一。早期發現、及時治療,特別是30歲以前出現初發癥狀和病程在8年以上的患者,可以迅速緩解腎臟損害,改善腎功能,對提高原發性痛風患者的生活質量、降低病死率有重大意義[2,3]。
目前一般認為臨床表現和血尿酸、尿常規,血、尿β2微球蛋白檢查對痛風腎臟損害早期診斷十分重要。白蛋白是血漿中帶負電荷的中分子蛋白質,幾乎不能通過腎小球基底膜。當腎小球損害時,腎小球濾過膜孔徑增大,尿白蛋白明顯升高。β-2微球蛋白在體內合成經腎小球排泄,絕大部分由腎小管重吸收,因此當腎小管重吸收功能下降時,尿β-2微球蛋白升高。托-霍蛋白是腎臟特異性糖蛋白,當遠曲小管受損時托-霍蛋白排入尿液和進入血液中的量減少,白蛋白、β-2微球蛋白和托-霍蛋白聯合檢測可作為痛風患者早期腎損害的指標[3,4]。
痛風患者腎功能障礙的發病機制主要是高尿酸血癥和尿中尿酸過飽和,導致尿酸鹽沉積到腎小管管腔或間質中。此外,可能與高齡及合并癥有關。本組痛風性腎病患者中位年齡55歲,且多合并糖尿病、高血壓、高脂血癥、冠心病、腦梗死、肥胖等老年性疾病,12例合并尿路結石,提示痛風腎病可能非單純的高尿酸血癥所致。痛風腎病的可能危險因素除高尿酸血癥外,還與病程、高血壓、高脂血癥,以及嗜煙、酒等有密切關系。因此,改變不良習慣,戒煙、酒,調整飲食等,及早控制高尿酸血癥、高血壓、高脂血癥是減輕和延緩腎損害的關鍵。痛風合并腎損害一經明確診斷,應低嘌呤飲食,積極堿化尿液,加用苯溴香豆酮促進尿酸排泄,給予別嘌呤醇抑制尿酸生成,解除結石梗阻,治療繼發的尿路感染,必要時配合血液透析治療,血尿酸水平可迅速下降,腎功能可明顯改善。大部分腎臟明顯縮小的患者經治療后血肌酐長期維持在300 μmol/L以下,勿需長期依賴透析,提示痛風合并腎功能衰竭患者盡管雙腎已不可逆性縮小,但通過綜合治療后腎功能仍可明顯改善,可能是由于痛風性腎病以小管間質損害為主,到后期間質纖維化較腎小球病變重。但是,由于有腎損害的患者貧血相對較重,因此給予促紅細胞生成素治療對改善患者生存質量更為重要。此外,停用非甾體類抗炎藥,對于保護腎功能也有重要意義[5,8]。
總之,腎臟損害是原發性痛風的常見并發癥,發生率高,早期診斷和及時治療能阻止或減緩腎功能不全的發生及進展,可以明顯改善預后。
[1]Edwards NL.The role of hyperuricemia in vascular disorders.Current opinion in rheumatology,2009,21(2):132-137.
[2]Nuki G.Colchicine:its mechanism of action and efficacy in crystalinduced inflammation.Current rheumatology reports,2008,10(3):218-227.
[3]Nakamura T.Historical review of gout and hyperuricemia investigations.Nippon rinsho,2008,66(4):624-635.
[4]Corrado A,D’Onofrio F,Santoro N,Melillo N,Cantatore FP.Pathogenesis,clinical findings and management of acute and chronic gout.Minerva medica,2006,97(6):495-509.
[5]Amlang MH,Zwipp H.Damage to large tendons:Achilles,patellar and quadriceps tendons.Der Chirurg;Zeitschrift fur alle Gebiete der operativen Medizen,2006,77(7):637-649.
[6]Kudaeva FM,Barskova VG,Gordeev AV.Current ideas about factors responsible for renal damage in gout.Terapevticheskii arkhiv,2005,77(5):90-95.
[7]Cameron JS,Simmonds HA.Hereditary hyperuricemia and renal disease.Seminars in nephrology,2005,25(1):9-18.
[8]McGill NW.Gout and other crystal-associated arthropathies.Bailliere’s best practice.research,2000,14(3):445-460.

