中溫α-淀粉酶基因的克隆及在枯草芽孢桿菌中的高效表達
劉逸寒,路福平,王建玲,胡 博
(工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
中溫α-淀粉酶基因的克隆及在枯草芽孢桿菌中的高效表達
劉逸寒,路福平,王建玲,胡 博
(工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
利用高效表達載體pWB980,實現了Bacillus subtilis BF7658中溫α–淀粉酶基因amy在B. subtilis DB403中的高效表達,活力達到770,U/mL.經多步純化,重組酶AMY的比活達到35.8,U/mg,純化倍數為1.7,獲得凝膠電泳條帶單一的蛋白樣品,經 SDS-PAGE檢測,重組酶 AMY相對分子質量為 4.8×104.對酶學性質進行分析,重組酶 AMY的最適反應溫度為60,℃,最適反應pH為6.0.
枯草芽孢桿菌;中溫α–淀粉酶;高效表達;純化;酶學性質
中溫α–淀粉酶的最適作用溫度和 pH分別為60,℃和 6.0,是工業中應用最普遍的酶種之一,被廣泛應用于淀粉糖、味精、啤酒、酒精以及紡織退漿等工業生產[1].1965年,我國開始應用B. subtilis BF7658生產α–淀粉酶,發酵活力為 200,U/mL左右[2].我國于 20世紀 90年代后期引進了國外生產中溫α–淀粉酶的優良菌株B. amyloliquefaciens和工藝技術,發酵活力平均在 400,U/mL左右.目前我國多數廠家仍采用 B. subtilis BF7658及其變異株生產中溫α–淀粉酶,產酶水平穩定在 550,U/mL左右.但與其他酶制劑品種相比較,其發酵水平提高較慢,限制了中溫α–淀粉酶在各行業中的應用.
目前,枯草芽孢桿菌表達系統已成為繼大腸桿菌之后重要的原核表達系統.枯草芽孢桿菌遺傳背景清楚[3],蛋白分泌機制健全,生長迅速,培養簡便,不分泌內毒素,具有較好的生物安全性,是美國食品藥物管理局(FDA)和中國農業部批準使用的安全菌株;并且它可直接將表達產物分泌到培養基中,產物便于提取和純化,是表達外源基因的良好受體菌.但由于枯草芽孢桿菌自身可向胞外分泌高濃度的蛋白酶,以致影響了表達產物的產量和穩定性.
本研究將獲得的B. subtilisBF7658中溫α–淀粉酶基因,利用表達載體pWB980[4]和宿主菌株B. subtilis DB403[5],對中溫α–淀粉酶進行表達.表達載體pWB980具有高拷貝數(121個/細胞)且含有可高效表達外源基因的 P43啟動子以及可將外源蛋白分泌到細胞外的信號肽 sacB基因;同時,B. subtilis DB403為 3個蛋白酶缺陷菌株,可減少胞外蛋白酶的分泌量,以期獲得中溫α–淀粉酶的高效表達,為以淀粉為原料深加工工業的發展提供有力的支撐.
1 材料與方法
1.1 菌株、質粒與培養基
B. subtilisBF7658和B. subtilisDB403,均為本實驗室保存.質粒 pWB980由加拿大 Calgary大學Dr. Sui-Lam Wong惠贈.
LB培養基用于細菌培養,篩選培養基為含卡那霉素 30,μg/mL的 LB/瓊脂培養基,酶活力初步檢測培養基為含 1%淀粉的 LB/瓊脂培養基,用作透明圈選擇.枯草芽孢桿菌轉化培養基為 GMI、GMII培養基[6].
1.2 酶與試劑
基因組提取試劑盒、質粒提取試劑盒、限制性內切酶、T4DNA 連接酶、高保真 TaqDNA 聚合酶,TaKaRa公司;DNA相對分子質量標準、蛋白相對分子質量標準、卡那霉素,上海英駿生物技術有限公司;引物合成及測序由TaKaRa 公司完成.
1.3 重組菌株的構建
根據 NCBI網站公布的 B. subtilisα–淀粉酶基因序列,經比對后設計引物,以B. subtilisBF7658總 DNA為模板,PCR擴增獲得B. subtilisBF7658中溫α–淀粉酶基因 amy,上游引物 P1:5′-CCC AAGCTTTTGCGCTTACAGCACCGTCGATCAA-3′(下劃線部分為 HindIII酶切位點),下游引物 P2:5′-CGCGGATCCTTGAAAGAATGTGTTACACCT-3′(下劃線部分為BamHI酶切位點).將PCR產物及提取的質粒pWB980,分別用HindIII和BamHI進行雙酶切,酶切產物經純化回收后,用T4 DNA連接酶于16,℃連接過夜,構建重組質粒 pWB-amy,參照文獻[7]轉化B.subtilisDB403,將含卡那霉素的酶活初步檢測平板上的轉化子逐一點接在含卡那霉素的 LB/瓊脂平板上保存,碘液熏蒸檢測平板,確定透明圈與菌落直徑比值大的轉化子后,在 LB/瓊脂保存平板上挑取相應轉化子,分別進行 PCR和雙酶切法鑒定并進行測序.
1.4 重組酶的表達
將獲得的工程菌株 pWB-amy/DB403和對照菌株 pWB980/DB403分別接種于 5,mL的含卡那霉素LB培養基中,37,℃振蕩培養過夜,按1%的接種量轉接于裝有50,mL含卡那霉素LB培養基的250,mL三角瓶中,37,℃培養 36,h,12,000,r/min 離心 10,min,收集上清液,SDS-PAGE(分離膠濃度為 10%,濃縮膠濃度為 5%)檢測蛋白的表達情況,同時測定酶活力.采用Lowry法測定蛋白含量[8].
1.5 工程菌株7,L發酵罐放大培養
種子培養基:LB培養基.
發酵培養基(g/L):玉米粉 55,豆餅粉 45,淀粉2,硫酸銨 4,磷酸氫二鈉 8,氯化銨 1.3,氯化鈣 2.7,pH自然.
7 L發酵罐培養條件參照文獻[9].
1.6 活力檢測
中溫α–淀粉酶活性測定方法和其他溶液的配制參照 QB/T 1803—1993《工業酶制劑通用試驗方法》.酶活計算:X=c×n.式中:X為樣品的酶活力,U/mL(U/g);c為測試酶的濃度,U/mL;n為樣品的稀釋倍數.
1.7 重組酶的分離純化
收集工程菌 pWB-amy/DB403發酵上清液100,mL,加硫酸銨至 70%,4,℃靜置過夜,6,000,r/min離心20,min,蛋白沉淀用10,mL 0.02,mol/L磷酸緩沖液(pH,7.0)溶解.得到的活性組分上樣到用濃度為0.02,mol/L磷酸緩沖液(pH 7.0)平衡過的 DEAESepharose Fast Flow(2.4,cm×30,cm)離子交換層析柱,用同樣的緩沖液先洗脫未吸附的蛋白,再用含0~1,mol/L,NaCl的 0.02,mol/L磷酸緩沖液(pH,7.0)線性梯度洗脫,收集活性組分.將得到的活性組分上樣到用 0.02,mol/L磷酸緩沖液(pH,7.0)平衡過的Sephadex G-75(1.6,cm×80,cm)凝膠層析柱,再用同樣的緩沖液洗脫,收集活性組分.每步收集到的活性組分進行活力檢測,并采用 Lowry法測定蛋白含量[8].
1.8 重組酶學性質分析
1.8.1 溫度對酶活力的影響
純酶最適反應溫度的測定:在不同溫度(30、40、50、60、70、80、90、100,℃)、pH 6.0 條件下保溫5,min,測定重組酶純酶液的酶活力,將最高酶活力定為100%.
純酶的熱穩定性測定:將重組酶純酶液置于不同溫度(40、60、80、100,℃)、pH,6.0 條件下保溫 1,h,每隔10,min取出,各自測定其殘余酶活力,以未保溫的酶液活力為100%,繪制熱穩定性曲線.
1.8.2 pH對酶活力的影響
純酶最適反應 pH 的測定:在不同 pH(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)、60,℃條件下保溫 5,min,測定重組酶純酶液的酶活力,將最高酶活力定為100%.
純酶的 pH穩定性測定:將重組酶純酶液在不同pH(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)條件下 60,℃保溫 60,min,各自測定其殘余酶活力,將最高殘余酶活力定為100%,繪制pH穩定性曲線.
2 結果與分析
2.1 重組菌的篩選與鑒定
以提取的B. subtilisBF7658總DNA為模板,利用 PCR擴增出中溫α–淀粉酶基因片段(GenBank 的登錄號為 FJ463162).測序結果表明中溫α–淀粉酶的信號肽含有 41個氨基酸,成熟肽含有 436個氨基酸.將中溫α–淀粉酶成熟肽基因片段amy經HindIIIBamHI雙酶切,與HindIII-BamHI線性化的質粒pWB980連接,構建重組質粒pWB-amy.將構建的重組質粒pWB-amy轉化B. subtilisDB403,通過水解透明圈與菌落直徑比篩選活力高的重組菌株,在含有卡那霉素的 LB/瓊脂平板上挑取該陽性轉化子,提取質粒分別用HindIII和HindIII-BamHI進行單酶切和雙酶切驗證,電泳檢測結果(圖 1)表明重組子質粒中已帶有目的基因amy,獲得重組菌株pWB-amy/DB403.
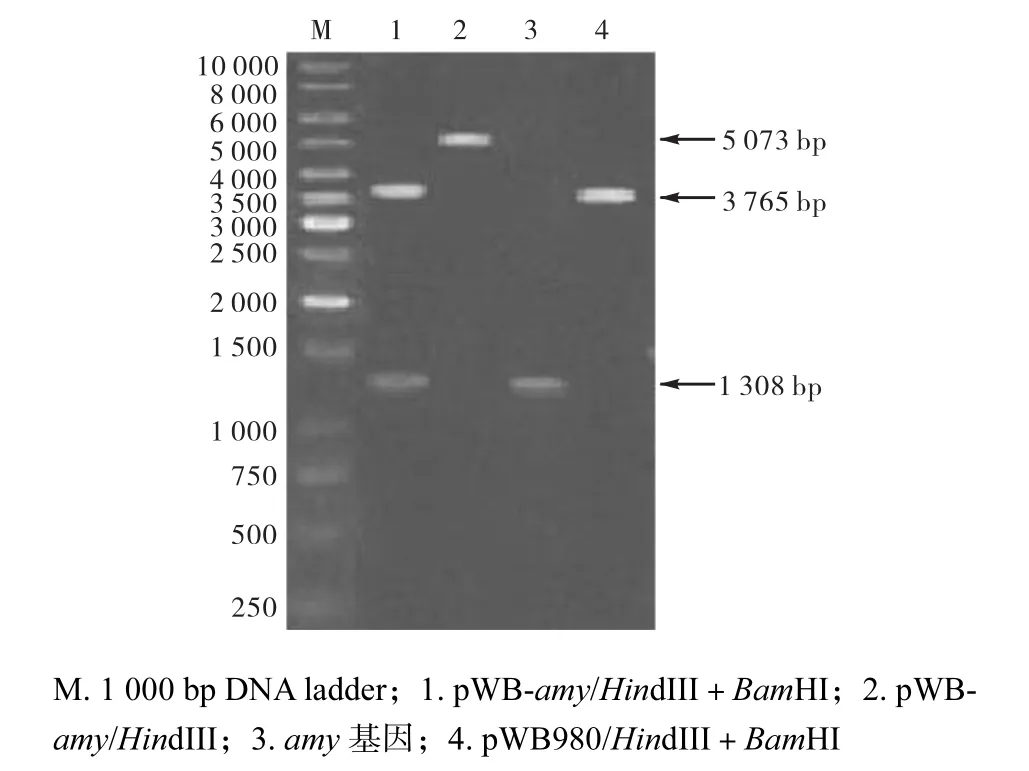
圖1 pWB-amy重組質粒酶切圖Fig.1 Verification of recombinant plasmids with single and double enzyme digestion
2.2 重組酶AMY的表達
將pWB-amy/DB403、B. subtilisBF7658和pWB980/DB403分別點接到含 1%淀粉的 LB/瓊脂平板上,如圖 2所示.pWB-amy/DB403的水解透明圈與菌落直徑的比值明顯大于B. subtilisBF7658和pWB980/DB403.
將pWB-amy/DB403和pWB980/DB403在37,℃分別培養 36,h,收集上清液,SDS-PAGE檢測蛋白的表達情況(圖 3),pWB-amy/DB403的上清液中發現有相對分子質量為 4.8×104的表達蛋白 AMY(泳道1),與經過純化的B. subtilisBF7658中溫α–淀粉酶(泳道 4)的大小一致,在 pWB980/DB403(泳道 3)上清液中未發現同樣的表達產物.同時,測定 pWB–amy/DB403上清液中溫α–淀粉酶 AMY的酶活力可達530,U/mL,而B. subtilisBF7658的中溫α–淀粉酶活力僅為 200,U/mL.按照方法 1.5所述對 pWB–amy/DB403進行 7,L發酵罐放大培養,中溫α–淀粉酶AMY的酶活力可達770,U/mL.

圖2 α–淀粉酶活性的平板檢測Fig.2 Plate assay for activities of alpha amylase
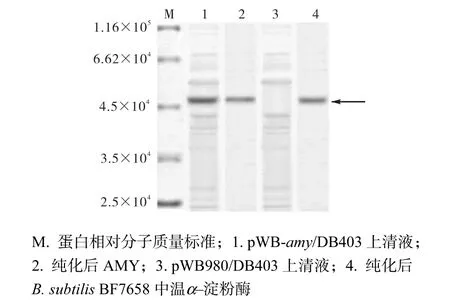
圖3 表達產物的聚丙烯凝膠電泳分析Fig.3 SDS-PAGE analysis of proteins secreted by B. subtilis DB403
2.3 重組酶的分離純化
收集 pWB-amy/DB403發酵上清液 100,mL,經硫酸銨鹽析、DEAE-Sepharose Fast Flow(2.4,cm×30,cm)離子交換層析、Sephadex G-75(1.6,cm×80,cm)凝膠層析,進行純化.通過對重組酶 AMY 整個提純工藝各純化步驟的總蛋白、總酶活、比活、純度及回收率等指標的跟蹤測定,得到 100,mL重組酶發酵上清液的純化表,見表 1.重組酶 AMY發酵上清液經分離純化后,純度提高了 1.7倍,回收率為74.3%.重組酶AMY的粗酶液經純化后,得到相對分子質量為 4.8×104的單一電泳條帶(圖 3,泳道 2),與經過純化的B. subtilisBF7658中溫α–淀粉酶(圖3,泳道4)的大小一致.

表1 重組酶AMY純化表Tab.1 Summary of purification of recombinant AMY
2.4 重組酶的酶學性質分析
2.4.1 酶的熱穩定性
重組酶AMY及B. subtilisBF7658中溫α–淀粉酶反應的最適溫度均為 60,℃.分別對 AMY及B.subtilisBF7658中溫α–淀粉酶的熱穩定性進行分析,結果表明在 40,~80,℃保溫 60,min,殘余酶活分別為初始活力的90%、80%及50%(圖4和圖5);在100,℃保溫30,min,完全失活.

圖4 重組酶AMY的熱穩定性曲線Fig.4 Thermostability curve of recombinant AMY

圖5 B. subtilis BF7658中溫α -淀粉酶熱穩定性曲線Fig.5 Thermostability curve of the medium-temperature alpha amylase in B. subtilis BF7658
2.4.2 酶的pH穩定性
重組酶AMY及B. subtilisBF7658中溫α–淀粉酶的最適 pH為 6.0.分別對 AMY及B. subtilisBF7658中溫α–淀粉酶的pH穩定性進行分析(如圖6所示),結果表明在60,℃保溫60,min,pH在5.5~7.5范圍內較穩定.

圖6 B. subtilis BF7658中溫α-淀粉酶及AMY的pH穩定性曲線Fig.6 Stability curve of pH of recombinant AMY and the medium temperature alpha amylase in B. subtilis BF7658
3 討 論
本項研究中,利用高效表達載體 pWB980,以 3個蛋白酶缺陷的B. subtilisDB403作為宿主菌株,實現了B. subtilisBF7658中溫α–淀粉酶的高效表達,經發酵工藝優化后,活力可達到770,U/mL,明顯高于出發菌株B. subtilisBF7658的中溫α–淀粉酶活力200,U/mL.董晨等[10]利用強啟動子 P43實現了地衣芽孢桿菌耐高溫α–淀粉酶在B. subtilis1A752S中的高水平表達,比原始菌株提高了 8.9倍.劉逸寒等[11]利用質粒 pWB980與 6個蛋白酶缺陷的 B. subtilis WB600實現了突變耐酸性高溫α–淀粉酶的高效表達,活力可達到 4,700,U/mL.可見,由強啟動子高拷貝載體質粒及本身胞外蛋白酶減少的枯草芽孢桿菌宿主菌株構建的表達體系可有效提高產酶量.
重組酶 AMY經超濾、硫酸銨鹽析、離子交換層析及凝膠層析純化后,得到的 AMY比活為35.8,U/mg,純化倍數為 1.7倍,獲得凝膠電泳條帶單一的蛋白樣品.在純化過程中,操作相對簡單且每步回收率較高,分析原因為外源蛋白表達量較高,同時由于宿主菌株B. subtilis DB403胞外蛋白分泌相對較少,穩定了外源蛋白并簡化了純化過程.
重組酶AMY與B. subtilisBF7658中溫α–淀粉酶最適溫度均為 60,℃,在 40~80,℃保溫 60,min,殘余酶活分別為初始活力的 90%、80%及 50%;在100,℃保溫 30,min,完全失活.AMY 及B. subtilisBF7658中溫α–淀粉酶的最適 pH 為 6.0.分別對AMY及B. subtilisBF7658中溫α–淀粉酶的pH穩定性進行分析,結果表明在 60,℃保溫 60,min,pH 在5.5~7.5范圍內較穩定.研究顯示,中溫α–淀粉酶經過不同的宿主菌株表達后,催化性質并沒有發生改變,保留原有的生物學活性.
外源基因的表達多采用大腸桿菌細胞內表達,提純蛋白需要將細胞破碎或裂解,過程繁瑣.而枯草芽孢桿菌具有將胞內蛋白分泌到細胞外的特點引起人們的普遍關注,利用枯草桿菌的分泌特點,構建高效表達體系表達外源蛋白,可簡化生產工序,有效降低生產成本.在本研究基礎上,下一步探索將B. subtilisBF7658中溫α–淀粉酶分別實現在分泌胞外蛋白酶更少的B. subtilisWB600中的游離及整合型表達,利用高拷貝質粒或將目的基因構建多個拷貝整合入宿主菌株基因組中,獲得安全高效穩定的表達,為進一步工業化大規模生產應用在不同行業中的中溫α–淀粉酶奠定堅實的基礎.
[1]李文德,路義,周明琨. 枯草桿菌 BF7658α–淀粉酶在釀造工業上的應用[J]. 中國調味品,1995(10):17–19.
[2]劉仲敏,張新武,曹明照,等. 以玉米粉代替部分玉米淀粉生產中溫α–淀粉酶的研究[J]. 食品與發酵工業,2003,29(6):96–97.
[3]Wong S L. Advances in the use ofBacillus subtilisfor the expression and secretion of heterologous proteins[J].Current Opinion in Biotechnology,1995,6(5):517–522.
[4]Wu S C,Wong S L. Development of improved pUB110-based vectors for expression and secretion studies inBacillus subtilis[J]. Journal of Biochemistry,1999,72(1/2):185–195.
[5]蔡恒,陳忠軍,李金霞,等.α–淀粉酶的耐酸性改造及在枯草芽孢桿菌中的分泌表達[J]. 食品與發酵工業,2005,31(10):33–36.
[6]Yasbin R E,Wilson G A,Young F E. Transformation and transfection in lysogenic strains ofBacillus subtilis:Evidence for selective induction of prophage[J]. Journal of Bacteriology,1975,121(1):296–304.
[7]Liu Y H,Lu F P,Li Y,et al. Characterisation of mutagenised acid-resistant alpha amylase expressed inBacillus subtilisWB600[J]. Applied Microbiology and Biotechnology,2008,78(1):85–94.
[8]Lowry O H,Rosbrough N L,Farr A L. Protein measurement with folin phenol reagent[J]. The Journal of Biological Chemistry,1951,193(1):2265–2275.
[9]孫靜,路福平,劉逸寒,等. 枯草芽孢桿菌工程菌產中溫α–淀粉酶發酵條件優化[J]. 中國釀造,2009,5:265–268.
[10]董晨,曹娟,張跡,等. 耐高溫α–淀粉酶基因在枯草芽孢桿菌中的高效表達[J]. 應用與環境生物學報,2008,14(4):2534–2538.
[11]Liu Y H,Lu F P,Li Y,et al. Acid stabilization of Bacillus licheniformisalpha amylase through introduction of mutations[J]. Applied Microbiology and Biotechnology,2008,80(5):2795–2803.
High-Level Expression of the Medium-Temperature Alpha Amylase inBacillus subtilis
LIU Yi-han,LU Fu-ping,WANG Jian-ling,HU Bo
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
The medium-temperature alpha amylase gene fromBacillus subtilisBF768 was cloned into vector pWB980 and high-level expressed inB. subtilisDB403. The activity of AMY in the supernatant of the culture medium reached a maximum of 770 U/mL. By multi-step purification,the specific activity of AMY was up to 35.8 U/mg with a 1.7-fold purification. The recombinant enzyme AMY had a molecular mass of 4.8×104. The optimum pH and temperature of AMY was 6.0 and 60 ℃.
Bacillus subtilis;medium-temperature alpha amylase;high-level expression;purification;enzyme properties
Q814.4
A
1672-6510(2011)04-0001-05
2011–03–23;
2011–05–27
天津市科技攻關重點培育項目(06YFGPSH03500);天津科技大學自然科學基金資助項目(20090205)
劉逸寒(1982—),男,天津人,講師,博士,lyh@tust.edu.cn.

