磷酸三丁酯萃取體系從鹽湖鹵水提取鋰
,,,,
(1.中國科學院青海鹽湖研究所中國科學院鹽湖資源與化學重點實驗室,青海西寧 810008;2.中國科學院研究生院)
鋰及其化合物有許多特有的優良性能,可廣泛應用于玻璃、陶瓷、潤滑、電子、冶金、醫藥、制冷、新能源航空航天等諸多領域。中國鹽湖含鋰鹵水資源中鋰含量以及鎂鋰比都很高,為鋰資源的開發帶來困難。鋰鹽生產過程中會排放大量的老鹵,其中的鎂、鋰、硼等元素未被回收利用。這不僅造成資源極大的浪費和經濟的巨大損失,也使環境及資源結構遭到嚴重破壞。中科院青海鹽湖研究所在20世紀70年代提出的TBP-磺化煤油萃取體系對高鎂鹵水萃取鋰具有良好的萃取效果[1-2],但終因工藝流程復雜、酸堿用量過大、強腐蝕性對設備要求過高等問題未能實現工業擴大化生產。筆者提出采用磷酸三丁酯(TBP)萃取體系從鹽湖鹵水中分離提取鋰的工藝,旨在為鹵水資源再利用和工業擴大化生產提供參考。
1 實驗部分
1.1 實驗原料及試劑
原料:采用東臺吉乃爾鹽湖提鉀老鹵為基本原料,實驗室進行算法除硼后,其主要成分見表1。

表1 鹵水主要成分 mol/L
試劑:磺化煤油,化學純;TBP、FeCl3·6H2O、鹽酸、NaOH,均為分析純;鉻黑T等。
1.2 實驗設備及檢測方法
1.2.1 儀器設備
ARCOS型全譜直讀等離子體發射光譜儀(ICP);便攜式pH計;康氏振蕩器;分析天平;分液漏斗等。
1.2.2 檢測方法
采用全譜直讀等離子體發射光譜儀分析Li+、Na+、K+、Ca2+、Fe2+等的含量;用乙二胺四乙酸(EDTA)絡合法測定Mg2+的含量;采用汞量法測定Cl-的濃度。
1.3 實驗原理
在FeCl3存在下用TBP對鹵水進行萃取,再用鹽酸進行反萃取,反應式如下[2]:

(1)

HFeCl4·2TBP (有機相)+LiCl(水相)
(2)
用稀NaOH中和空載有機相HFeCl4·2TBP中的H+后形成 NaFeCl4·2TBP 循環使用,在酸性環境下萃取鋰時再次形成LiFeCl4·2TBP。
2 實驗結果及討論
2.1 萃取影響因素分析[1-3]
2.1.1 TBP含量對萃取率的影響
固定其他條件:相比為2.0、鐵鋰物質的量比為1.5、c(H+)=0.05 mol/L、振蕩時間為5 min。TBP體積分數分別取60%、70%、75%、80%、85%、90%、95%、100%。分別進行單級萃取實驗后,用等離子體發射光譜儀測水相中Li+的含量,用差減法計算有機相中Li+的含量。
圖1為TBP的體積分數對鋰萃取率的影響。由圖1可知,鋰萃取率隨TBP體積分數的增加呈平拋線上升趨勢,在φ(TBP)=80%時上升趨勢明顯放緩。這是因為隨著TBP體積分數的增大,水相中絕大部分(90%左右)的Li+已被萃入有機相,余液中的Li+濃度降低使得其與TBP碰撞結合形成絡合物的幾率減小,水相Li+濃度越小,被萃入有機相的難度越大,導致鋰萃取率上升速率減緩。考慮到TBP的價格較貴,且稀釋劑磺化煤油含量太低會導致有機相黏度、密度過大而影響兩相分離效果,因此實驗采用TBP最佳體積分數為80%。
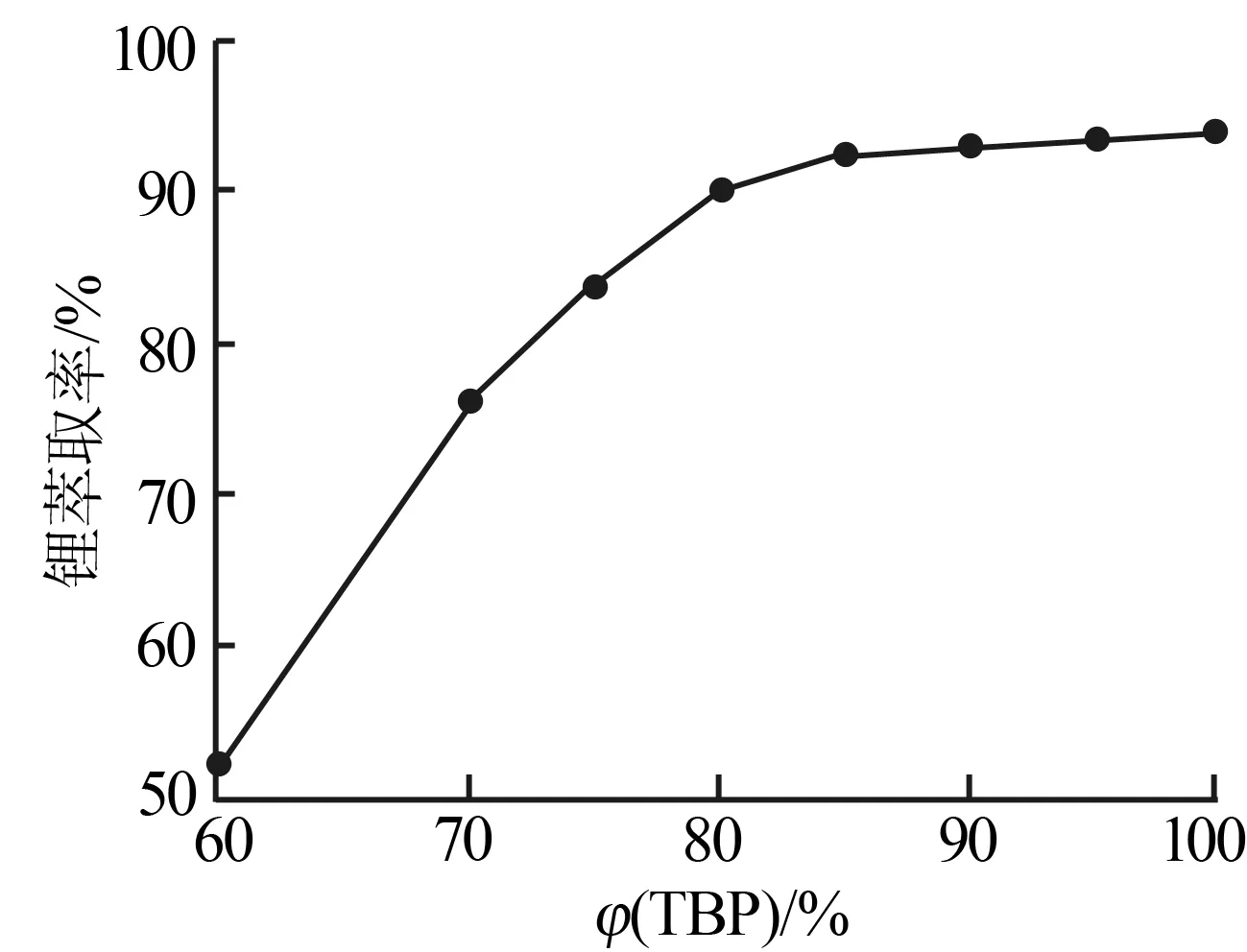
圖1 TBP的體積分數對鋰萃取率的影響
2.1.2 相比對萃取效果的影響
相比(O/A)是影響萃取過程的一個重要因素,相比過大不但會造成資源浪費,成本提高,還可能增加Mg2+、Na+、K+等雜質離子在負載有機相中的含量;相比過小則會使鋰的萃取率偏低,甚至出現第三相而影響萃取效果。


圖2 相比對鋰萃取率及鎂鋰分配系數的影響
綜合考慮相比對萃取率和鋰鎂分離系數的影響,最佳相比應選擇在1.8~2.0。實驗最終采用相比為2.0。
2.1.3 鐵鋰物質的量比對萃取率的影響
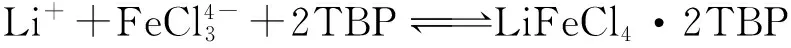
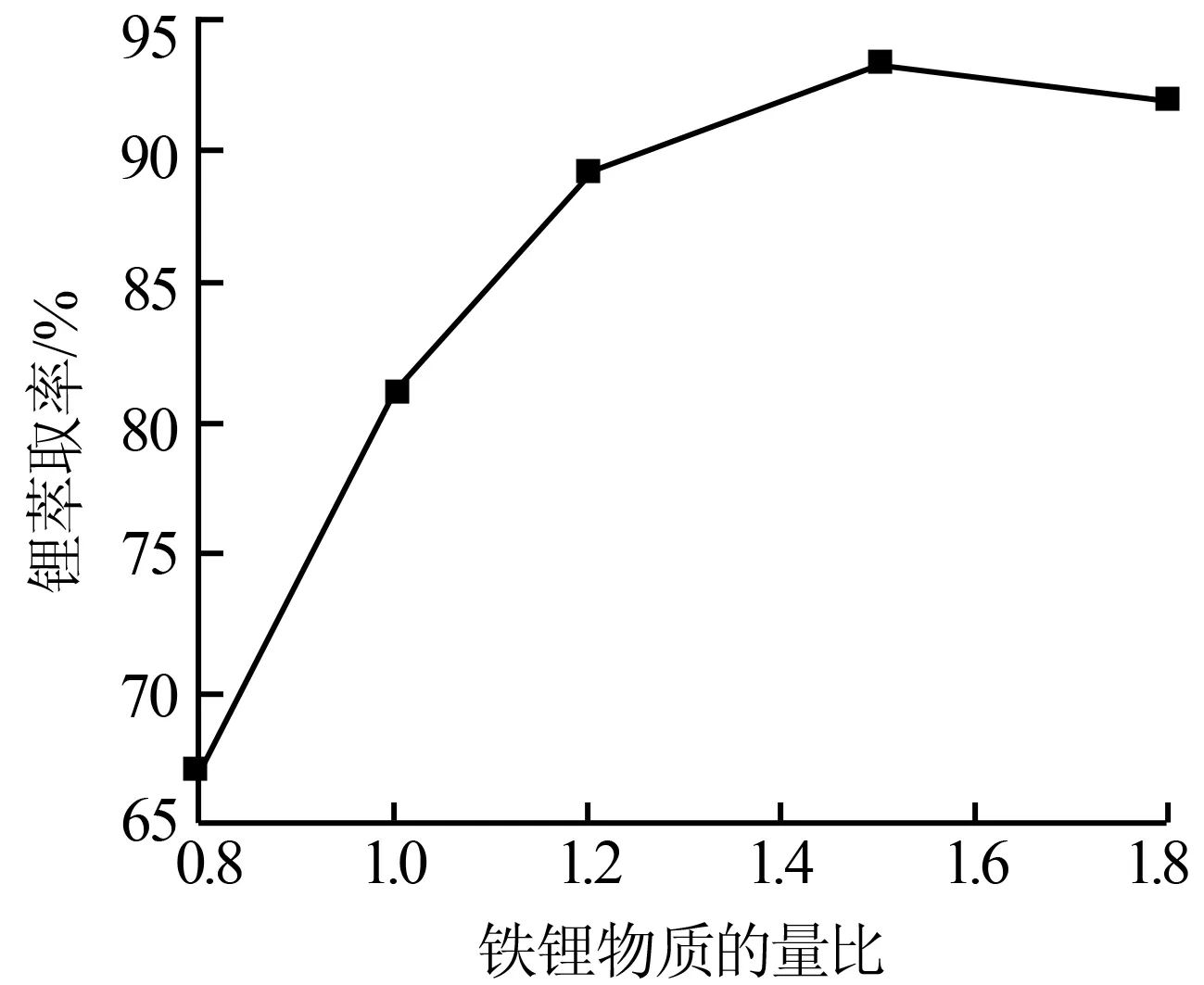
圖3 鐵鋰物質的量比對鋰萃取率的影響
2.1.4 H+濃度對萃取效果的影響
一方面,在萃取過程中Li+和H+與有機相的結合是競爭關系,H+的存在不利于對鋰的萃取;另一方面,助萃取劑中的Fe3+會與H2O發生水解反應生成Fe(OH)3沉淀而失去助萃取效果,因此必須使水相保持一定的酸度以保證Fe3+不水解;此外,水相酸度還會影響分相時間。
固定其他條件:φ(TBP)=80%、相比為2.0、鐵鋰物質的量比為1.5、振蕩時間為5 min。H+濃度分別取0.02、0.04、0.06、0.08 mol/L進行實驗。圖4為H+濃度對萃取率及分相時間的影響。由圖4可知,隨著H+濃度的增大,鋰萃取率的曲線呈近似直線的下降趨勢,但當H+濃度在0.04~0.06 mol/L時鋰萃取率下降速率趨緩,變化率僅為0.2%,而這又是分相時間快速降低的階段。因此,適宜的H+濃度應選擇在0.04~0.06 mol/L。實驗最終采用c(H+)=0.05 mol/L。

圖4 H+濃度對鋰萃取率及分相時間的影響
2.1.5振蕩時間對萃取效果的影響
振蕩時間即為兩相接觸時間,Li+傳質進入有機相并與有機相反應生成萃合物即發生在此階段。振蕩時間的長短直接決定著Li+與有機相的絡合反應是否充分,反應是否達到平衡,從而影響萃取率及分相時間。
固定其他條件:φ(TBP)=80%、相比為2.0、鐵鋰物質的量比為1.5、c(H+)=0.05 mol/L。振蕩時間分別取1、2、5、8、12 min進行實驗。圖5為振蕩時間對鋰萃取率及分相時間的影響。由圖5可知,隨著振蕩時間的延長,鋰萃取率增大,當萃取時間為5 min后鋰萃取率幾乎無增長;分相時間隨振蕩時間的增加而增加,但增速緩慢。這是因為當振蕩時間增加到一定程度(5 min)時,絡合反應和相際傳質均已趨于平衡,故萃取率和分相時間達到最大后不再變化。因此,實驗選擇適宜的振蕩時間為5 min。
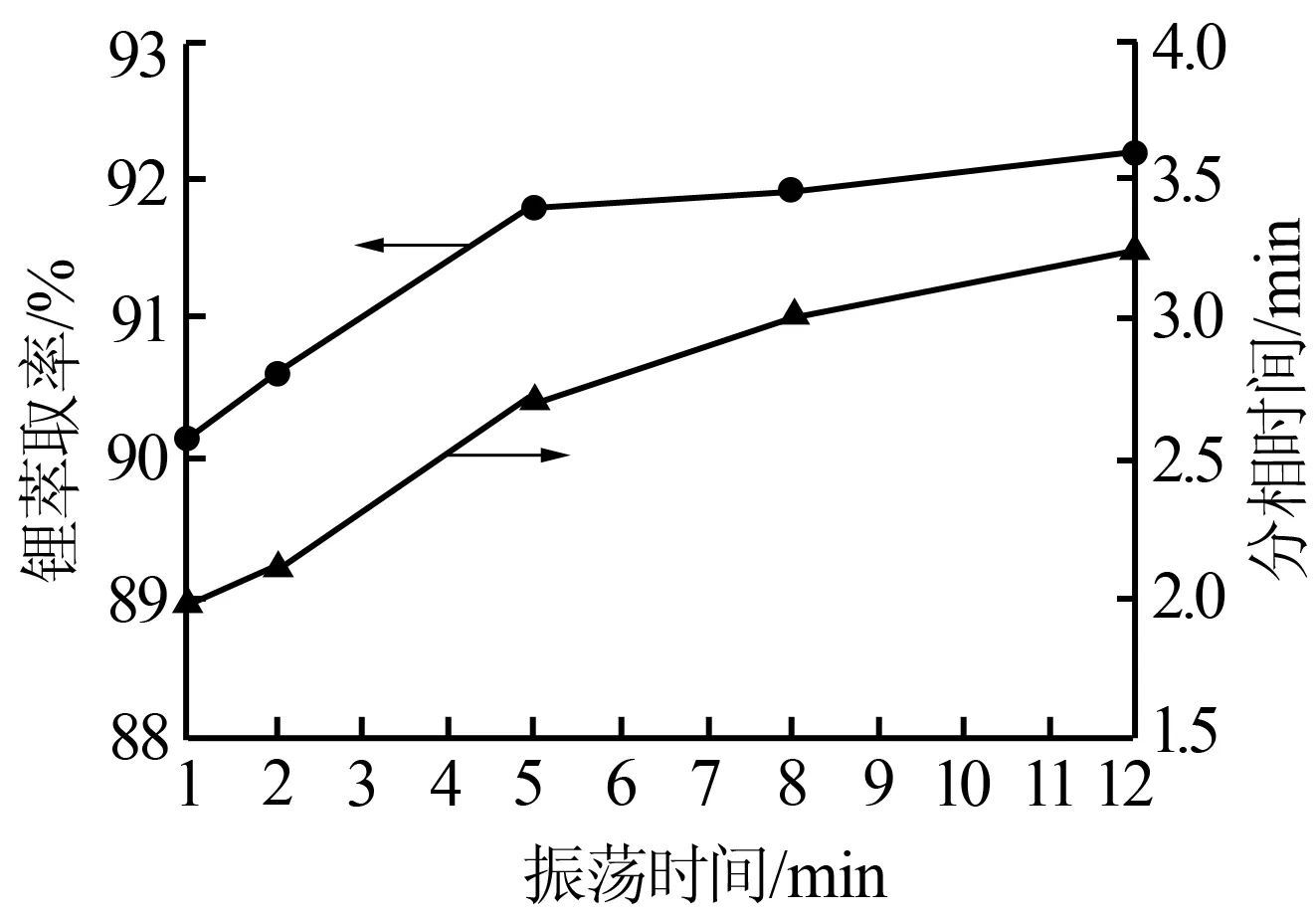
圖5 振蕩時間對鋰萃取率及分相時間的影響
2.2 萃取正交實驗分析
2.2.1 正交實驗及直觀分析
以TBP的體積分數、相比、鐵鋰物質的量比作為影響因素,選擇4個水平,以鋰萃取率為考察指標;采用L16(45)正交表進行正交實驗。正交實驗中水相c(H+)=0.05 mol/L,振蕩時間為5 min。考察因素水平如表2所示,實驗方案及結果見表3。

表2 因素水平表

表3 正交實驗方案及結果
由表3實驗結果可知,相比B為影響實驗指標鋰萃取率最主要的因素,鐵鋰比C次之,TBP含量A的影響最小。以因素B的各水平為橫坐標、各水平下鋰萃取率的平均值為縱坐標作圖(如圖6所示)。由圖6可知,鋰平均萃取率隨相比增大而增大,并在相比為1.5后增速明顯減緩,在相比超過2.0后幾乎無增長。為了兼顧實驗成本和萃取效率,選擇最佳相比為2.0(B3)。又因為因素A對實驗指標影響很小,且同樣需要兼顧實驗成本,故因素A采用2水平。因此,實驗最終選擇的最優方案為A2B3C3,即φ(TBP)=80%、相比為2.0、鐵鋰物質的量比1.5,該結果與單因素實驗所得結果相一致。

圖6 相比各水平與平均萃取率的關系
2.2.2 正交實驗結果的驗證及其穩定性測試
為了驗證正交實驗所選擇出的最優方案并測試其穩定性,需要按照最優方案的條件進行重復實驗。實驗條件固定為:φ(TBP)=80%、相比為2.0、n(Fe)∶n(Li)=1.5,c(H+)=0.05 mol/L、振蕩時間為5 min。進行3個平行實驗,其結果如表4所示。由表4可知,平行實驗的鋰平均萃取率約為91.4%,波動范圍<0.6%,實驗結果非常穩定。

表4 平行實驗結果
3 結論
1)TBP-磺化煤油萃取體系在高鎂含量的鹽湖鹵水中萃取鋰效果較好,單級鋰萃取率可達91.4%。
2)考察了TBP體積分數、相比(O/A)、鐵鋰物質的量比、H+濃度和振蕩時間等因素對鋰萃取率的影響,得到最佳實驗條件為:φ(TBP)=80%、相比為2.0、n(Fe)∶n(Li)=1.5、c(H+)=0.05 mol/L、振蕩時間為5 min。通過比較,各因素對鋰萃取率的影響從大到小依次為相比、鐵鋰比、TBP體積分數。正交實驗的結果與單因素實驗結果一致。
3)該萃取工藝的實驗結果具有良好的穩定性和重現性,可為工業擴大化生產提供可靠的參考依據。
[1] 童兆達,李發金,黃師強,等.從大柴旦鹽湖脫硼鹵水中用TBP連續萃取分離氯化鋰[J].稀有金屬,1987(1):66-69.
[2] 黃師強,催榮旦,張淑珍,等.磷酸三丁酯從大柴旦鹽湖鹵水萃取鋰的研究[J].鹽湖科技資料,1980(1/2):14-23.
[3] 徐徽,孫錫良,侯立松.從鹽湖鹵水萃取鋰的影響因素分析[J].湖南有色金屬,2005,21(1):9-10,35.

