聚乙二醇修飾多壁碳納米管對質粒DNA的影響
勞文艷, 商迎輝, 焦 正, 勞鳳學
(1.北京聯合大學北苑校區,北京100012;2.上海大學環境與化學工程學院,上海200444)
隨著納米技術的發展,碳納米管(carbon nanotubes,CNTs)的用途越來越廣[1-6],與科研人員和普通大眾的接觸也越來越多.因此,在CNTs基材料廣泛應用之前,深入徹底地研究其健康與安全問題非常有必要.CNTs或含CNTs復合材料的生物相容性研究已經成為CNTs研究領域的一個新熱點.Webster等[7]研究了一系列復合材料 polyurethane (PU)/CNTs和星狀細胞的關系,并發現隨著CNTs含量的提高,材料中的星狀細胞量減少,并且阻礙了星狀細胞的增殖.Hu等[8]和Gabay等[9]的研究結果顯示,經聚乙烯亞胺化學修飾后的CNTs對神經細胞生長有促進作用.Supronowicz等[10]發現,導電復合材料polylactic acid(PLA)/MWNTs通過交流電擊能夠明顯提高造骨細胞的增殖速度.
DNA是生物體中一類最基本的大分子,是遺傳信息的原初載體,是細胞生長、發育、繁殖和遺傳的重要物質基礎.研究由納米材料所導致的DNA結構和功能的變化,有利于從微觀角度理解納米材料的生物相容性本質,從而為探討和解決宏觀領域中的實際問題提供依據.本研究通過電泳實驗和原子力顯微鏡觀測,分析多壁碳納米管(MWNTs)和PEG修飾MWNTs與質粒DNA的作用情況,并從二者對質粒DNA損傷的角度考察了MWNTs的生物相容性.
1 實驗
本實驗中使用的MWNTs直徑為10~30 nm,長度為5~50 μm,購自深圳市納米港公司.本實驗采用混酸氧化法純化MWNTs,用V(濃硝酸)∶V(濃硫酸)=1∶3的混合酸超聲處理MWNTs,通過離心分離和真空干燥,得到的黑色固體為純化MWNTs.PEG修飾MWNTs的合成方法為如下:取干燥的50 mg純化MWNTs,加入15 mL pH=7.0的磷酸鹽緩沖液中,超聲分散均勻,加入 200 mg的碳二亞胺與250 mg N-羥基琥珀酰亞胺,超聲30 min,再加入500 mg PEG-1500,置于磁力攪拌器上室溫攪拌24 h,反應后的溶液用水洗滌,12 000 r/min離心分離30 min,得到的固體用去離子水洗滌后再用0.22 μm的纖維素微孔濾膜真空過濾,得到PEG修飾MWNTs.原始MWNTs、純化MWNTs和PEG修飾MWNTs的透射電子顯微鏡(transmission electron microscope,TEM)照片如圖1所示.
本實驗中所使用的其他試劑均為分析純.實驗采用堿法抽提質粒DNA,所用質粒為pGBKT7,大小約為7.3 kb.MWNTs經超聲振蕩后與DNA混合形成混合溶液,然后進行凝膠電泳實驗.取9 μL樣品加入1 μL的loading buffer(染色劑)混合均勻,按照由高到低的濃度順序,用移液槍依次在每個孔中注入樣品、質粒和loading buffer的混合物,最后加入水、質粒和loading buffer的混合物作為對照.電泳實驗電壓設定為120 V,時間設定為50 min.
使用天能凝膠成像系統對電泳結果進行凝膠成像,應用凝膠成像系統的分析軟件對凝膠中不同形態DNA的光密度進行定量分析,從而得到不同質量濃度下MWNTs對質粒DNA的損傷情況.
使用島津公司的SPM-9600AFM觀察MWNTs對DNA的作用.對質粒DNA進行成像時,AFM采用如下的制樣方法.在室溫下,將250 μg/mL的原始WMNTs、純化WMNTs和PEG修飾MWNTs與DNA溶液混合(質粒DNA終質量濃度控制在250 ng/mL左右),渦旋震蕩器上恒溫(25℃)輕輕震蕩24 h.用移液槍吸取5 mL的MWNTs與質粒DNA的混合液,緩緩滴于3-氨基丙基三乙氧基硅烷-云母襯底上,隨后用干凈平整的封口膜輕輕覆蓋在液滴上,并使溶液均勻地平鋪在襯底上.將襯底靜置幾分鐘后揭去封口膜,吸取少量的去離子重蒸水沖洗襯底面,重復沖洗若干次以便去除未吸附的質粒.最后,將沖洗后的襯底置于陰涼干燥處,使殘留在襯底上的水分自然風干,樣品制備完畢.由于是測試生物樣品,掃描速率要盡量放慢在0.5 Hz左右,振源幅度要盡量調低,設置點調高,確保在成像時,AFM的針尖以較小的力拍擊樣品表面,從而不會對樣品產生破壞.
2 結果與討論
2.1 電泳實驗結果與討論

圖1 MWNTs的TEM圖Fig.1 TEM images of MWNTs
本實驗選擇體外評價方法(plasmid DNA assay)對MWNTs以及PEG修飾MWNTs的生物活性進行研究.在納米材料對DNA的損傷過程中,最初的損傷表現為超螺旋DNA松弛(relaxed),進一步的損傷表現為DNA的線化(linearized).正常的質粒DNA在瓊脂糖凝膠中的電泳速度比松弛和線化的DNA快,故在智能凝膠成像系統所生成的圖像中能夠得到3條明顯分開的條帶(見圖2).通過對圖2進行分析,可以定量檢測不同的納米材料對質粒DNA超螺旋部分的損傷程度[11],并由此對納米材料的生物相容性作出相應的評價.

圖2 不同質量濃度的MWNTs對質粒DNA損傷的凝膠成像結果(μg/mL)Fig.2 Gel images of plasmid DNA damage by various concentration of MWNTs(μg/mL)
圖3為不同質量濃度的CNTs對質粒DNA損傷情況的定量分析結果.可以看出,當原始單壁碳納米管 (single-walled CNTs,SWCNTs)質量濃度為125 μg/mL時便開始損傷質粒DNA,并且隨著質量濃度的增加,損傷程度也逐漸增加;當質量濃度達到2 000 μg/mL時,對質粒DNA的損傷已非常明顯,可達48.6%.純化MWNTs對質粒DNA的損傷較原始SWCNTs稍有減弱,低質量濃度范圍內的純化MWNTs對質粒DNA超螺旋部分的損傷百分比處于一個較低的水平;但當質量濃度達到2 000 μg/mL時,純化MWNTs對質粒DNA超螺旋部分的損傷也達到了21.1%,表明原始SWCNTs和純化MWNTs在達到一定質量濃度時,對質粒DNA都有較為明顯的損傷.而PEG修飾MWNTs對質粒DNA的損傷明顯減弱,其損傷百分比一直處于一個非常低的水平;當質量濃度達到2 000 μg/mL時,PEG修飾MWNTs對質粒DNA超螺旋部分的損傷也只有13.6%.
2.2 AFM實驗結果與討論
AFM在生物結構的研究中具有如下獨特的優勢:①可在納米水平上分辨生物大分子的結構信息;②具有直觀的三維表面信息;③樣品制備相對簡單,無需進行染色、包埋等復雜處理過程;④可深入了解單個生物分子的三維結構變化.越來越多的研究者利用AFM來研究DNA的結構變化.Pang等[12]利用AFM研究了電子輻射導致水溶液中DNA斷裂的情況.Zhu等利用AFM觀測了Zn2+導致DNA扭曲的現象.本實驗利用 AFM分別觀測了純pGBKT7質粒結構以及原始MWNTs、純化MWNTs和PEG修飾MWNTs對質粒DNA結構的影響,結果如圖4~圖7所示.

圖3 不同質量濃度的CNTs溶液中質粒DNA超螺旋部分的損傷情況Fig.3 Percentage of supercoiled DNA damage in CNTs solution at different mass concentration
圖4為純pGBKT7質粒DNA的AFM圖像,可以清晰地看到,其完整的環狀結構均勻地分布在云母片上,每個環狀質粒的外徑約為85 nm,高度約為2 nm.

圖4 pGBKT7質粒DNA的AFM圖像Fig.4 AFM images of pGBKT7 plasmid DNA
圖5為質粒DNA與原始MWNTs混合培養后的AFM圖像.可以看出,未經純化的原始MWNTs對質粒DNA的損傷非常嚴重,絕大多數質粒DNA失去了其完整的環狀結構,即共價閉合環狀質粒DNA發生鏈斷裂變成了開環的質粒(open circular DNA,ocDNA),還有一些質粒DNA發生了更為嚴重的斷裂現象,即斷裂成小段并形成線化 DNA(linear DNA,lDNA).

圖5 pGBKT7質粒DNA與原始MWNTs混合培養后的AFM圖像Fig.5 AFM images of pGBKT7 plasmid DNA after incubated with pristine MWNTs
圖6為質粒DNA與純化MWNTs混合培養后的AFM圖像.可以看出,大部分質粒DNA保持了原有的完整環狀結構,在與原始MWNTs共同培養過程中出現的共價閉合環斷裂現象已經得到了明顯的改善,線化的質粒DNA較少,但質粒DNA出現了扭曲現象,DNA間的糾結、纏繞現象也較為嚴重.由圖6可以明顯地看到,質粒DNA在云母片上的分布不均勻,大量的質粒DNA團聚成一簇.
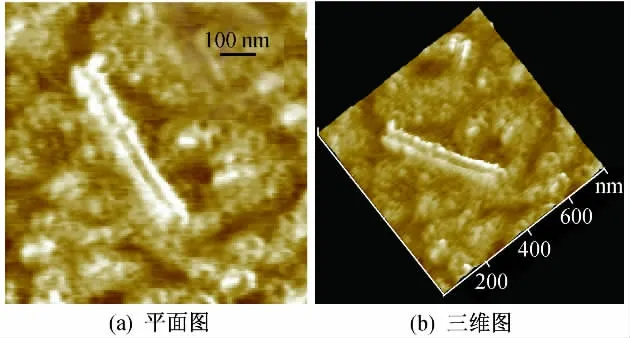
圖6 pGBKT7質粒DNA與純化MWNTs混合培養后的AFM圖像Fig.6 AFM images of pGBKT7 plasmid DNA after incubated with purified MWNTs
圖7為質粒DNA與PEG修飾MWNTs混合培養后的AFM圖像.可以明顯地看出,大部分的質粒DNA完整地保存了其環狀結構,基本上未出現開環、線化和團聚的現象,絕大多數環狀質粒DNA均勻地分布在云母片上.AFM圖像中出現的管狀結構為PEG修飾MWNTs,點狀結構為質粒DNA,它們均勻地分布在云母片上,結構非常完整.

圖7 pGBKT7質粒DNA與PEG修飾MWNTs混合培養后的AFM圖像Fig.7 AFM images of pGBKT7 plasmid DNA after incubated with PEG-MWNTs
通過AFM的剖面分析觀測,可以發現與各種MWNTs混合培養之后,質粒DNA的外徑都有不同程度的收縮,純的質粒DNA的直徑為80~90 nm,平均直徑約為85 nm.純化MWNTs與質粒DNA共同培養后,質粒DNA的收縮情況比較明顯,平均直徑收縮至50 nm左右.PEG修飾MWNTs與質粒DNA共同培養后,質粒DNA的收縮情況不明顯,平均直徑在75 nm左右.利用AFM中的長度分析軟件,對每種外徑的縮小情況統計40個質粒DNA,結果如表1所示.

表1 pGBKT7質粒DNA與純化后的MWNTs,PEG修飾WMNTs混合培養后外徑測量Table 1 Outer mean diameters for ringlike plasmid DNA incubated with purified-MWNTs and PEG-MWNTs measured by AFM
AFM觀測得到的結果與電泳實驗所得到的結論非常吻合.未經純化處理的原始MWNTs對質粒DNA的損傷較為嚴重,原因可能是原始MWNTs中含有的包括鐵、鈷、鎳等金屬顆粒雜質對質粒DNA產生了損傷.經過純化的MWNTs,由于金屬催化劑和大部分的雜質顆粒被除去,因而對質粒DNA的損傷有所減弱,不會造成質粒DNA的斷裂,但質粒DNA發生了收縮和扭曲現象.經過 PEG修飾的MWNTs,由于其表面包裹了一層溶解性良好的高分子材料,體現出較好的生物相容性.其對質粒DNA的損傷非常小,不會造成質粒DNA的斷裂和扭曲,基本完好地保持了原有的形態.
3 結束語
Plasmid DNA assay的研究結果表明,就對質粒DNA的損傷程度而言,原始MWNTs>純化MWNTs>PEG修飾MWNTs.PEG修飾MWNTs具有較好的生物相容性,當質量濃度達到2 000 μg/mL時,PEG修飾MWNTs對質粒DNA超螺旋部分的損傷也只有13.6%;而在相同質量濃度下,原始MWNTs和純化MWNTs對質粒 DNA超螺旋部分的損傷分別為48.6%和21.1%.
AFM觀察的結果和plasmid DNA assay的結果非常吻合.原始MWNTs能夠造成大量的質粒DNA分解、斷裂成線狀.純化MWNTs對質粒DNA的形貌損傷有所減弱,大部分質粒DNA保持了原有的環狀結構,但質粒DNA的收縮、團聚和纏繞現象非常明顯.PEG修飾MWNTs對質粒DNA形貌的影響最弱,絕大多數質粒DNA完好地保持了原有的環狀結構,質粒的收縮現象不明顯.
[1] KROTOH W,HEATHJ R,O’BRIENS C,et al.C60:buckminsterfullerene[J].Nature,1985,318:162-163.
[2] IIJIMAS.Helical microtubules of graphitic carbon[J].Nature,1991,354:56-58.
[3] SALVETATJ P,BONARDJ M,KULIKA J,et al.Mechanical properties of carbon nanotube[J].Appl Phys A Mater,1999,69(3):255-260.
[4] TERSOFFJ,RUOFFR S.Structural properties of a carbon-nanotube crystal[J].Phys Rev Lett,1994,73 (5):676-679.
[5] DALTONA B,COLLINSS,MUNOZE,et al.Supertough carbon-nanotube fibres—these extraordinary composite fibres can be woven into electronic textiles[J].Nature,2003,423:703-705.
[6] SENR,ZHAOB,PEREAD,et al.Preparation of singlewall carbon nanotube reinforced polystyrene and polyurethane nanofibers and membranes by electrospinning[J].Nano Lett,2004,4:459-464.
[7] WEBSTERJ J,WAIDM C,MCKENZIEJ L,et al.Nanobiotechnology: carbon nano-fibers as improved neural and orthopedic implants[J].Nanotech,2004,15:48-54.
[8] HUH,NIY,MONTANAV,etal.Chemically functionalized carbon nanotubes as substrates for neuronal growth[J].Nano Lett,2004,4(3):507-511.
[9] GABAYT,JAKOBSE,BEN-JACOBEY,etal.Engineered selforganisation of neural networks using carbon nanotube clusters[J].Physica,2005,350:611-621.
[10] SUPRONOWIZP R,AJAYANP M,ULLMANK R,et al.Novel-current conducting composite substrates for exposing osetoblasts to alternating current stimulation[J].J Biomed Mater Res,2002,59:499-506.
[11] JIAG,WANGH,YANL,et al.Cytotoxicity of carbon nano materials: single-wall nanotube, multi-wall nanotube,and fullerene[J].Environ Sci&Technol,2005,39(5):1378-1383.
[12] PANGD,POPESCUG,RODGERSJ.Atomic force microscopy investigation of radiation-induced DNA double strand breaks[J].Scanning Microscopy,1996,10(4):1105-1110.

