鼠IL-2基因的克隆及其桿狀病毒表達載體的構建
黃大林,袁桂峰,王 鑫,李彬彬,鐘 江*
(1桂林醫學院,廣西桂林541004;2復旦大學)
桿狀病毒是一類雙鏈DNA大型病毒,能夠感染600多種昆蟲,可在感染的昆蟲細胞中形成特征性的病毒包涵體。苜蓿銀紋夜蛾多角體病毒(AcMNPV)是昆蟲桿狀病毒科核多角體病毒屬的模式種,也是研究最多的桿狀病毒。桿狀病毒由于其自身的獨特性使它成為一種新型的哺乳動物細胞基因表達和基因治療的載體[1]。上世紀80年代建立的桿狀病毒—昆蟲細胞表達系統已經成為一種最常用的真核細胞表達系統。但是感染病毒作為哺乳動物細胞基因轉移載體也有一些缺點:在體內會引起補體反應;帶入的表達框在哺乳動物細胞中可能被沉默;對不同細胞的基因轉移效率有很大差別。2009年11月~2010年6月,我們使用Bac-to-Bac系統成功構建鼠IL-2基因桿狀病毒表達載體。現報告如下。
1 材料與方法
1.1 實驗動物 采用SPF級40日齡的昆明小鼠進行試驗,體質量(22.08±3.00)g。采用拉頸法處死小鼠,無菌打開腹腔取出小鼠脾臟,使用100目細胞篩網制備脾細胞懸液,采用淋巴細胞分離液分離出淋巴細胞。
1.2 菌種和質粒 大腸桿菌JF1125;昆蟲細胞草地夜蛾卵巢組織細胞系Sf9;苜蓿銀紋夜蛾核型多角體病毒(AcMNPV)、質粒pFastBacDual及T-CMVp等由復旦大學微生物學與微生物工程系鐘江課題組實驗室保存。
1.3 試劑 限制性內切酶、T4 DNA連接酶和堿性
磷酸酶購自TaKaRa大連寶生物工程公司;TNM-FH培養液由購自Sigma公司的粉劑配制,加10%的小牛血清使用。轉染試劑CellFectin購自Invitrogen公司;DNA凝膠回收試劑盒以及PCR產物回收試劑盒購自上海杰瑞生物科技有限公司;細胞總RNA抽提試劑盒和反轉錄試劑盒購自上海生工生物工程技術服務有限公司。DNA標準分子量:λDNA/EcoRⅠ+ HindⅢ購自 MBI Fermentas公司;DL2000購自物TaKaRa公司;RNase A購自上海華舜生物工程有限公司;Taq DNA polymerase購自北京天根公司,蛋白酶K購自Roche公司。
1.4 方法
1.4.1 小鼠IL-2基因的獲得及鑒定 將鼠脾淋巴細胞在刀豆球蛋白A(Con A)的刺激下體外培養27 h后,提取激活淋巴細胞總RNA;參照GenBank發表的鼠IL-2 cDNA基因序列設計一對引物,逆轉錄得到cDNA,以此為模板進行PCR擴增。設計引物IL-2 F:5'-ATATCTAGAATACAGCAGCATGCAGCTCGC-3',R:5'-TCTGCTACCTTAGTCGTCGTGGTCTTTGTAGTCTTGAGGGCTTGTTGAGATG-3',引物由上海捷瑞生物工程有限公司合成。反應條件:94℃預變性5 min,94℃變性30 s,58℃退火30 s,72℃延伸30 s,共30個循環,最后72℃延伸5 min。PCR產物經1%瓊脂糖凝膠電泳初步鑒定。
1.4.2 重組含有小鼠IL-2基因質粒載體 用XbaⅠ/KpnⅠ雙酶分別切pFastBac質粒和IL-2的PCR產物,1%瓊脂糖凝膠電泳割膠回收DNA,分別作為載體和供體片段,通過T4連接酶連接得到pFBIL2,經過轉化大腸桿菌JF1125得到pFB-IL2質粒,提取質粒進行酶切和PCR鑒定。
1.4.3 載體加入真核細胞啟動子CMV 用EcoRⅠ酶切pFB-IL2(需CIAP去磷酸化處理)和T-CMVp上切下CMV啟動子片段,分別作為載體和供體片段,通過T4連接酶在16℃連接12 h,CMV啟動子插入pFB-IL2的EcoRⅠ位點,經過轉化大腸桿菌JF1125得到pFB-CMV-IL2質粒,提取質粒DNA。
1.4.4 重組小鼠IL-2基因質粒載體的酶切鑒定和序列分析驗證 pFB-CMV-IL2質粒用KpnⅠ、XbaⅠ和BgⅡ分別進行酶切鑒定,結果正確后并將構建的pFB-CMV-IL2質粒轉化JF1125,將菌液進行質粒序列分析測定。
1.4.5 重組Bacmid-pFB-CMV-IL2質粒轉染Sf9細胞 利用Invitrogen公司的產品Bac-to-Bac系統來構建重組桿狀病毒,挑取轉化DH10Bac感受態細胞生長的白色菌落,提取Bacmid,脂質體轉染法將
Bacmid-pFB-CMV-IL2轉染 Sf9細胞包裝病毒,Sf9細胞培養于Sf 900Ⅱ培養液中培養3 d,收獲上清獲取完整重組桿狀病毒,反復感染Sf9細胞擴增病毒。提取病毒基因組,抽病毒基因組的步驟為:①500 μl病毒液中加入500 μl 20%的PEG8000和1.6 mmol/ L NaCl的混合液,室溫放置30 min,12 000 r/min離心15 min。②棄上清,沉淀加入20 μl水,80 μl裂解液和5 μl蛋白酶并混勻,50℃保溫1 h。③用苯酚—氯仿—異戊醇抽提直至上下兩相分明,兩相間無明顯雜質。④加入兩倍體積的無水乙醇,-20℃放置10 min,離心10 min,棄上清后烘干沉淀,加入16 μl無菌水-20℃保存備用。用PCR驗證重組桿狀病毒的正確性。
2 結果
2.1 PCR產物瓊脂糖凝膠電泳結果 擴增產物片段大小為500 bp,與陽性對照IL-2吻合,表明已經成功擴出IL-2目的片段。
2.2 PCR技術鑒定pFB-IL-2質粒結果 表明目的片段IL-2已經成功重組入載體中,見圖1。
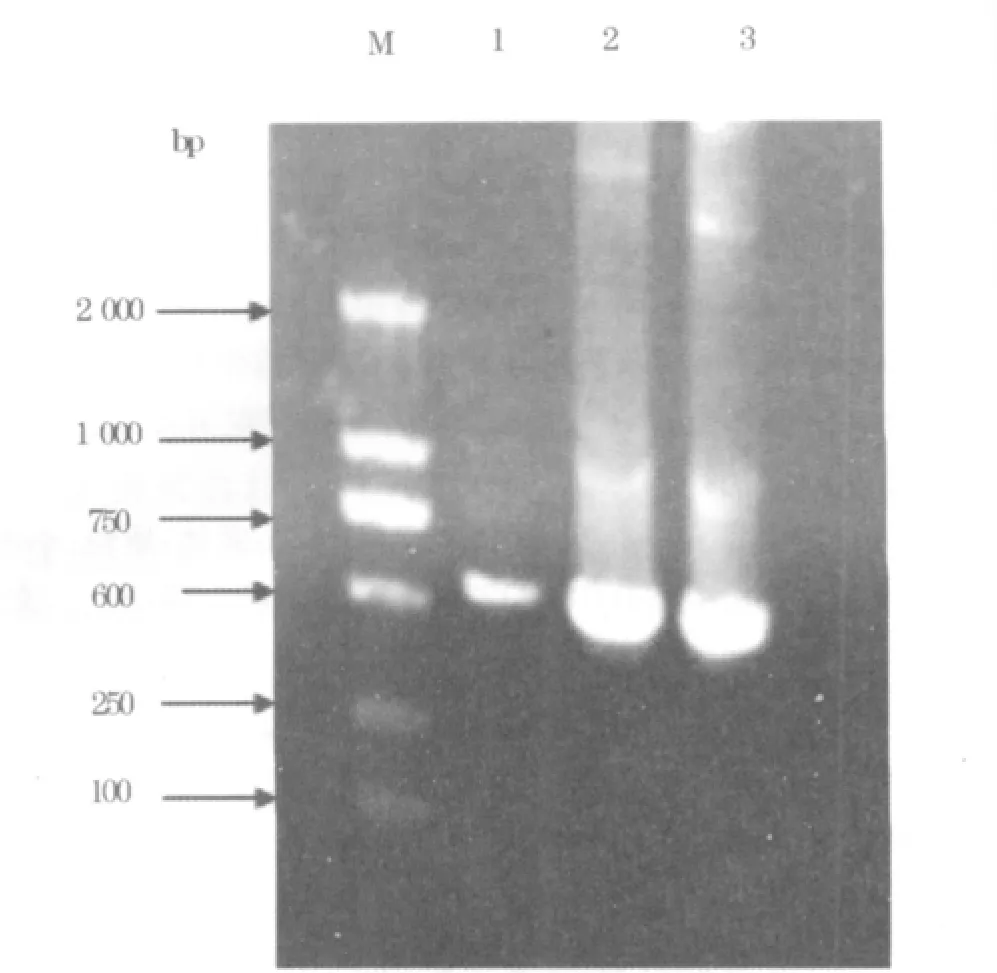
圖1 PCR檢測PFB-IL-2質粒
2.3 酶切pFB-CMV-IL2質粒結果 用KpnⅠ酶切PFB-CMV-IL-2分別得到0.5 kb、0.7 kb和4.7 kb 3個片段;用XbaⅠ酶切得到0.7 kb和5.2 kb 2個片段;用BglⅡ酶切得到0.5 kb、1.8 kb和3.6 kb 3個片段,與預期結果吻合,表明成功重組構建PFBCMV-IL-2載體。
2.4 菌液測序結果 利用Blast軟件在GenBank進行序列比對,菌液測序結果與GenBank鼠IL-2相吻合,成功構建含鼠IL-2的載體質粒,驗證實驗結果正確。
2.5 重組桿狀病毒穿梭載體的PCR驗證 提取病毒DNA基因組,用IL-2特異性引物進行PCR擴增,成功擴出了一條約500 bp的條帶,與預期結果相符,證明重組桿狀病毒穿梭載體Bacmid-IL-2重組成功。見圖2。
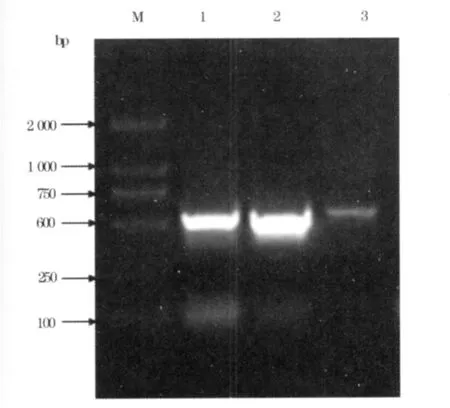
圖2 PCR鑒定重組桿狀病毒基因組
3 討論
桿狀病毒載體重組桿狀病毒構建方便,易于擴大培養規模及獲得高滴度的病毒,桿狀病毒的基因組和棒狀的核衣殼可以容納100 kb的DNA,最大可插入約40 kb的外源基因;能轉染末端分化細胞和原代培養細胞;當以高感染復數感染哺乳動物細胞,沒有細胞毒性,安全性好,在哺乳動物細胞內不會整合到基因組中,不能自行復制,自身啟動子在哺乳動物細胞內也沒有活性[2]。Bac-to-Bac系統將桿狀病毒—昆蟲細胞表達系統變為了一個具有廣泛應用前景的系統,這個系統將外源基因通過定向重組克隆到桿狀病毒基因組上多角體啟動子后,成功構建桿狀病毒的穿梭質粒,整個重組過程都在大腸桿菌中完成,重組子可以通過抗生素和lacZ標記方便挑選。只要將大腸桿菌中的穿梭質粒即病毒基因組提取出來,轉染昆蟲細胞就可以得到重組病毒。隨著桿狀病毒—昆蟲表達系統的應用范圍越來越廣,現在已經發展出一系列用于定向轉座的供體質粒,甚至能利用桿狀病毒在昆蟲細胞中同時表達多個蛋白。由于有高效表達啟動子(多角體啟動子和p10啟動子),表達外源蛋白效率高[3];可對表達的蛋白進行糖基化修飾;容易擴大規模達到生產要求。迄今已經通過桿狀病毒—昆蟲細胞表達系統成功表達了許多外源基因,例如雞胃酶解肌球蛋白、視紫質激酶、人類β-干擾素等。
IL-2主要是由激活T淋巴細胞產生的一類Th1型細胞因子,在抗腫瘤、抗毒素、免疫調節及治療感染性疾病中具有重要作用,具有十分重要的免疫生理調節效應[4,5]。自 Taniguchi等[6]從人體細胞中首次克隆出IL-2全長cDNA并報道其全序列以來,已從30多種動物中克隆出此基因,重組IL-2也在提高機體免疫力、抗感染和治療癌癥等方面獲得了廣泛的應用[7]。
本試驗首先通過RT-PCR擴增出IL-2基因,通過構建鼠 IL-2的轉移質粒,通過克隆將其插入pFastBacDual,成功構建了桿狀病毒表達系統的轉移載體pFB-CMV-IL2質粒,通過轉染Sf9昆蟲細胞,成功獲得含IL-2的重組桿狀病毒,為進一步研究該蛋白的最佳表達、生物學活性、動物實驗等奠定了良好的基礎,同時亦為其他蛋白質的真核表達提供了方法學的參考。
[1]Kost TA,Condreay JP.Recombinant baculoviruses as mammalian cell gene delivery vectors[J].Trends biotechnol,2002,20(4): 173-180.
[2]Hüser A,Hofmann C.Baculovirus vectors:novel mammalian cell gene-delivery vehicles and their applications[J].Am J Pharmacogenomics,2003,3(1):53-63.
[3]Maeda S.Expression of foreign genes in insects using baculovirus vector[J].Annu Rev Entomol,1989,34:351-372.
[4]Allen EM,Weir JP,Martin S,et al.Role of coexpression of IL-2 and herpes simplex virus proteins in recombinant vaccini a virus vectors on levels of induced immunity[J].Virol Immunol,1990,3 (3):207-215.
[5]Kogut M,Roothwell L,Kacser P.Differential effect of age on chicken heterophil futional activation by recombinant chicken interleukin-2[J].Dev Comp Immunol,2002,26(9):817-830.
[6]Taniguchi T,Matsui H,Fujita T,et al.Structure and expression of a cloned cDNA for human interleukin-2[J].Nature,1983,302 (5906):302-305.
[7]Zelus D,Robinson-Rechavi M,Delacre M,et al.Fast evolution of interleukin-2 in mammals and positive selection in ruminants[J].J Mol Evol,2000,51(3):234-244.

