煅燒制度對Li4Ti5O12材料結構與電化學性能的影響
李劼,王姣麗,張治安,賴延清
(中南大學 冶金科學與工程學院,湖南 長沙,410083)
煅燒制度對Li4Ti5O12材料結構與電化學性能的影響
李劼,王姣麗,張治安,賴延清
(中南大學 冶金科學與工程學院,湖南 長沙,410083)
研究高溫固相合成Li4Ti5O12的煅燒制度,探討Li2CO3與TiO2反應生成Li4Ti5O12的機理。分別采用一段煅燒(于800 ℃保溫10 h)、兩段煅燒(于800 ℃保溫2 h,于650 ℃保溫8 h)、低溫預燒(于650 ℃保溫8 h,于800℃分別保溫2,4,6和8 h)3種高溫固相煅燒制度合成Li4Ti5O12。研究結果表明:與一段煅燒和兩段煅燒制度相比,在低溫預燒制度下,隨著高溫階段保溫時間延長,合成產物中TiO2雜相含量逐漸減少直至消失;原料經650℃低溫預燒8 h,再于800 ℃保溫6 h條件下所得產物純度達95%,僅含有少量富鋰雜相Li2TiO3,材料首次放電比容量高達 170.1 mA·h·g?1。
電化學儲能;電極材料;Li4Ti5O12;煅燒制度
Li4Ti5O12(LTO)是一種具尖晶石結構的可嵌鋰材料,其嵌鋰性能具有顯著優點:理論嵌鋰比容量高,約為 175 mA·h·g?1;鋰離子脫嵌可逆性好,不易發生晶體結構改變,循環性能優良;高鋰電位也不易析出金屬鋰,安全性好;因此,Li4Ti5O12被認為是鋰離子二次電池碳負極的替代材料[1-5]和非對稱電化學電容器理想的負極備選材料[6?8]。Li4Ti5O12的制備方法總體上可分為固相反應和液相反應 2大類。劉東強等[9]研究了凝膠法制備納米Li4Ti5O12,但是該方法工藝十分復雜。固相合成是目前制備Li4Ti5O12的主要方法,已具備規模化生產應用優勢。為探索Li4Ti5O12的最佳合成工藝條件,通過對比和正交實驗分析影響材料性能的因素,許江楓等[10]考察了燒結溫度、燒結時間以及鋰源對Li4Ti5O12性能的影響,阮艷莉等[11]分析了不同原料混合方式對產物性能的影響。煅燒制度也是影響材料性能的一個重要因素。固相合成Li4Ti5O12的煅燒制度主要有3種[12?13]:低溫預燒一定時間后,再高溫(800~900 ℃)保溫;高溫(800~900 ℃)下保溫較長時間;先高溫(800 ℃)煅燒,再在較低溫度下保溫。高溫煅燒是固相合成Li4Ti5O12的主要過程,也是其他合成方法的一個重要階段,因此,研究煅燒制度對Li4Ti5O12結構與電化學性能的影響具有重要意義。在此,本文作者采用固相法,以上述3種煅燒制度下合成Li4Ti5O12,并通過比較產物的形貌、結構與電化學性能,分析Li2CO3與TiO2反應生成尖晶石Li4Ti5O12的機理。
1 實驗
1.1 Li4Ti5O12的制備
按 Li正常含量過量 8%(質量分數),準確稱取Li2CO3(分析純)與TiO2(分析純),將原料混合在無水乙醇(分析純)中球磨2 h,取出后于120 ℃真空干燥約12 h,經研磨后,在坩堝內按以下3種制度在空氣中煅燒:(1) 一段煅燒(于800 ℃保溫10 h),所得樣品標記為O;(2) 兩段煅燒(于800 ℃保溫2 h,取出研磨后維持在650 ℃保溫8 h),所得樣品標記為T;(3) 低溫預燒(650℃保溫8 h,繼續升溫至800 ℃,分別保溫0,2,4,6和8 h),所得樣品分別標記為L0,L2,L4,L6和L8。用日本理學(Rigaku)D/Max-RB X線衍射儀分析材料的晶體結構,測試條件為:Cu Kα線,管電壓40 kV,管電流150 mA,步寬0.02°;使用日本產JSM?5600LV掃描電子顯微鏡觀察材料的形貌。
1.2 電化學性能測試
首先制備對鋰半電池。將活性物質、導電劑(炭黑)和黏結劑(PVDF)按照質量比 8:1:1混合,加適量溶劑(NMP),經充分研磨后均勻涂覆于鋁箔集電極上,于120 ℃真空干燥12 h,裁取所需電極片。用電極片做正極, 金屬鋰為對電極,鋰離子電池用 LiPF6/EC?DMC為電解液,在充滿氬氣的手套箱中組裝成對鋰測試電池。使用 Land測試儀測試一定倍率時的恒流充放電循環,充放電電壓窗口為1.0~2.8 V。
2 結果與討論
2.1 TG曲線分析和反應溫度的確定
將混合均勻的Li2CO3與TiO2粉體進行差熱分析,圖1所示為示差掃描量熱分析與熱重分析圖。從圖1可看出,DSC曲線上有346,650和800 ℃ 3個吸熱峰,原料的質量損失主要發生在510~672 ℃之間,此后物料的質量基本沒有變化。與此對應的是于650 ℃時的吸熱峰最突出。這可能是進行反應的溫度段,在此期間Li2CO3中CO2脫離反應體系,揮發損失到空氣中造成物料質量損失。此外,在346 ℃與800 ℃左右各有一個較弱的吸熱峰,推測前者對應的是原料分子結構結晶水的分解[14],后者對應的是反應產物某種物相的相變。由此可推測:物料在650 ℃與800 ℃均發生了反應,因此,設置低溫反應溫度為650 ℃,高溫反應溫度為800 ℃。
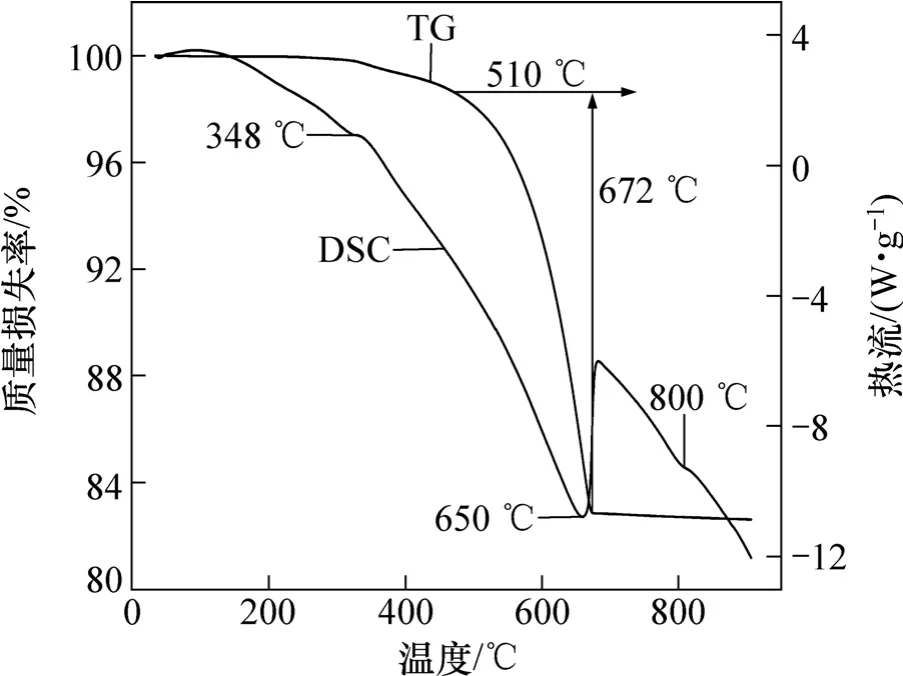
圖1 原料的DSC-TG圖Fig.1 DSC-TG profile of raw materials
2.2 樣品的物相分析
圖2所示為3種煅燒制度下所得樣品的XRD衍射圖譜。根據衍射峰強度對樣品中的各化合物進行半定量分析[15],結果見表1。由圖2和表1可看出:盡管原料中 Li2CO3對 TiO2過量,在一段與兩段煅燒制度下,產物中仍有TiO2存在;而在低溫預燒制度下,隨著高溫階段保溫時間延長,TiO2含量逐漸減少直至消失。這可能是因為Li2CO3熔解溫度約為650 ℃,在一段與兩段煅燒過程中,溫度迅速升至800 ℃,且高溫保持時間較長,鋰鹽有揮發損失[10?11,13?14];而在低溫預燒過程中,Li2CO3以熔融狀態與TiO2充分反應且時間充分,因此,L6與L8中不含TiO2。
在低溫預燒制度下,出現富鋰雜相Li2TiO3,隨著高溫階段保溫時間的延長,其含量逐漸減少,L6與L8樣品中含量相近。初步推斷Li2CO3與TiO2反應生成Li4Ti5O12的機理可表示為:

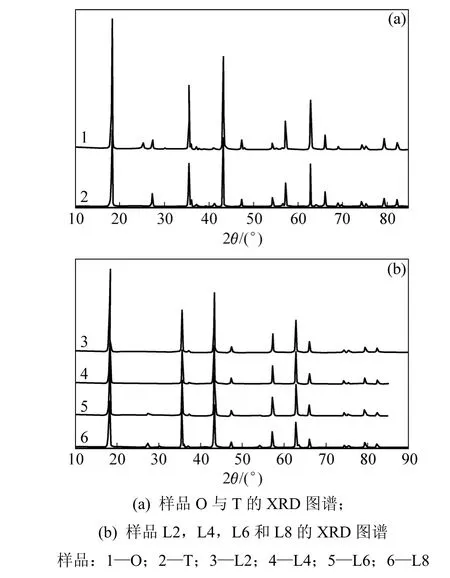
圖2 各樣品的XRD圖譜Fig.2 XRD patterns of each sample’s

表1 各樣品的雜質種類和含量(質量分數)Table 1 Category and content of impurities in each sample %
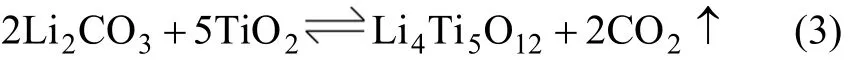
一段與兩段煅燒時,雖然原料中Li2CO3過量,但Li2CO3揮發較多,以致反應式(1)中反應原料 TiO2過量,生成 Li2TiO3量相對較少;在反應式(2)中反應完全,因此O樣品中含金紅石相的TiO2;而T樣品在高溫下保溫時間較短,由原料中無定形TiO2轉變成的銳鈦礦未能全部轉換為金紅石相,因此,T樣品中同時含有金紅石相的TiO2和銳鈦礦。對于低溫預燒制度,反應式(1)中的反應發生在低溫預燒階段,在這個過程中,Li2CO3揮發少,且以熔融狀態在反應式(1)中反應進行完全,同時由于原料中Li2CO3過量,產物Li2TiO3在反應式(2)中過量。L2與L4由于反應時間不夠,樣品中同時含有Li2TiO3和TiO22種雜質,L6與L8則反應充分,因此產物中只含有Li2TiO3,且含量幾乎一致。這個推理與Abe等[15]的推測相似。
圖3所示為樣品L0的XRD衍射圖譜。從圖3中的衍射峰強度半定量分析得知:L0中含38.1%的銳鈦礦、14.5%的LiTi2O4和47.8%的Li2TiO3,并沒有生成Li4Ti5O12。說明反應過程中在650 ℃和低于這個溫度時還生成了中間相LiTi2O4;隨著反應時間的延長和反應溫度的提高,LiTi2O4逐漸轉化為 Li2TiO3,溫度高于650 ℃后Li2TiO3再與TiO2反應得到Li4Ti5O12。在反應過程中,當中間產物全部轉化為Li2TiO3后,不再生成其他中間物相,而是從 Li2TiO3直接向 Li4Ti5O12轉化。樣品L2~L8中含有的Li-Ti-O三元系雜相只有Li2TiO3可以說明這一點。Kleykamp[16]的偽Li2O-TiO2二元系相圖也可以證明,在溫度為 600~950 ℃時,Li2TiO3相與Li4Ti5O12相之間不存在其他Li-Ti-O化合物,這兩相有1條共熔線。于650 ℃反應8 h中間物相已基本轉化為Li2TiO3,說明預燒溫度和時間的選擇較合理。
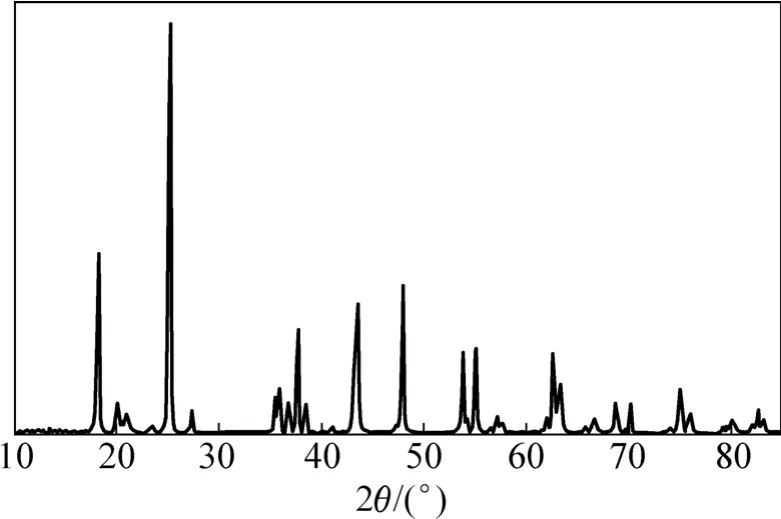
圖3 L0的XRD圖譜Fig.3 XRD pattern of L0
2.3 樣品的形貌分析
圖4所示為各樣品的SEM圖。各種制度煅燒都形成顆粒分散均勻的Li4Ti5O12,顆粒粒徑為2~3 μm,顆粒間存在不規則融合團聚,可能與TiO2原料的形貌有關。
2.4 樣品的電化學性能分析
圖5所示為各樣品在0.1C恒流充放電下的首次充放電曲線。表2列出了各樣品在0.1C充放電循環時的放電比容量(其中,C為充放電倍率)。從表 2可見:樣品O和T首次放電比容量相近,約155 mA·h·g?1,樣品T循環性能比樣品O的優;低溫預燒制度下所制備的樣品首次放電比容量比樣品O和T的都要高,在156~170 mA·h·g?1之間,循環性能也較好。樣品 O 和T為8%~10%金紅石相TiO2,因而金紅石相TiO2比容量僅為 20~50 mA·h·g?1[17],因此,樣品 O 與 T 的首次放電比容量較低。
進一步比較低溫煅燒制度下制備的各樣品在0.5C充放電時的電化學性能。圖6所示為樣品L2,L4,L6,L8在0.5C恒流充放電下的循環性能。由圖6 可知:L6 首次放電比容量較低,為 117.0 mA·h·g?1,但是循環性能很好,10次循環后其比容量為 117.6 mA·h·g?1,保持的比容量超過了首次放電比容量較高的L2與L4。低溫煅燒制度下制備的各樣品所含的主要雜相是單斜晶系的Li2TiO3。在這種鋰鈦氧化合物晶體結構中,Li原子占據了八面體的每個位置,因此,這是一種電導率和鋰離子傳導率都極低的鋰鈦氧化合物。在 20℃時,Li4Ti5O12的電導率比 Li2TiO3的電導率高5個數量級[18]。隨著 Li2TiO3含量的減少,樣品電導率相對較高,有利于較高倍率下的充放電。而L8樣品則由于高溫反應時間較 L6的長,雖然樣品成分相近,但是顆粒晶體較L6的晶體大。因此,在0.5C充放電時,L6樣品電化學性能最優。
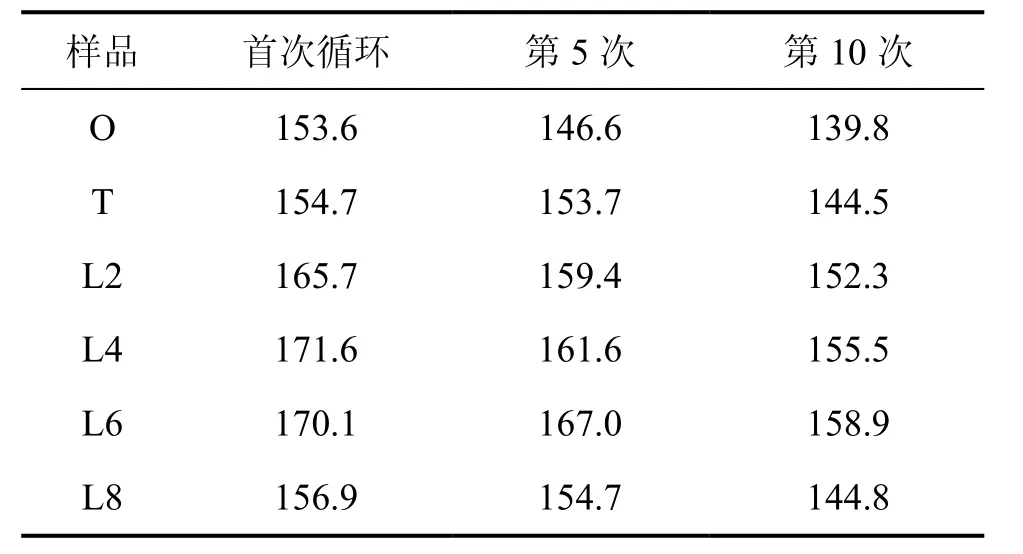
表2 各樣品0.1C下循環放電比容量Table 2 Cycle specific discharge-capacity of each sample’s at 0.1C rate mA·h·g?1
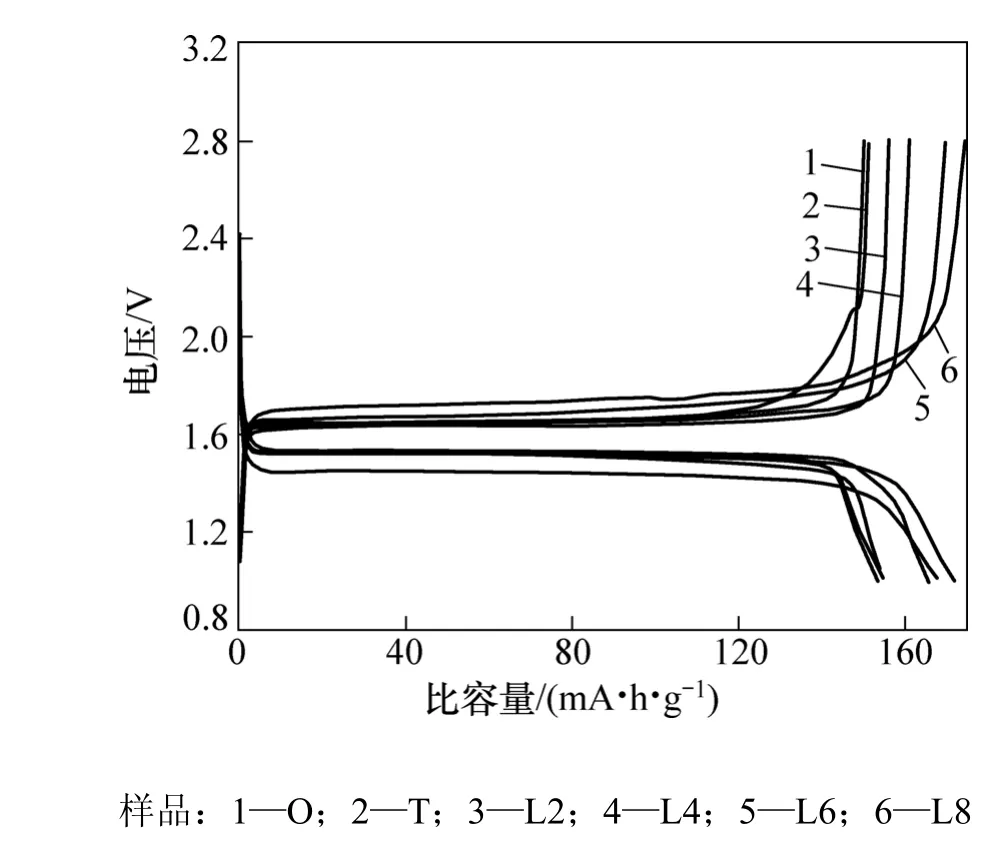
圖5 各樣品在0.1C恒流充放電下的首次充放電曲線Fig.5 First charge-discharge curve of each sample at 0.1C rate
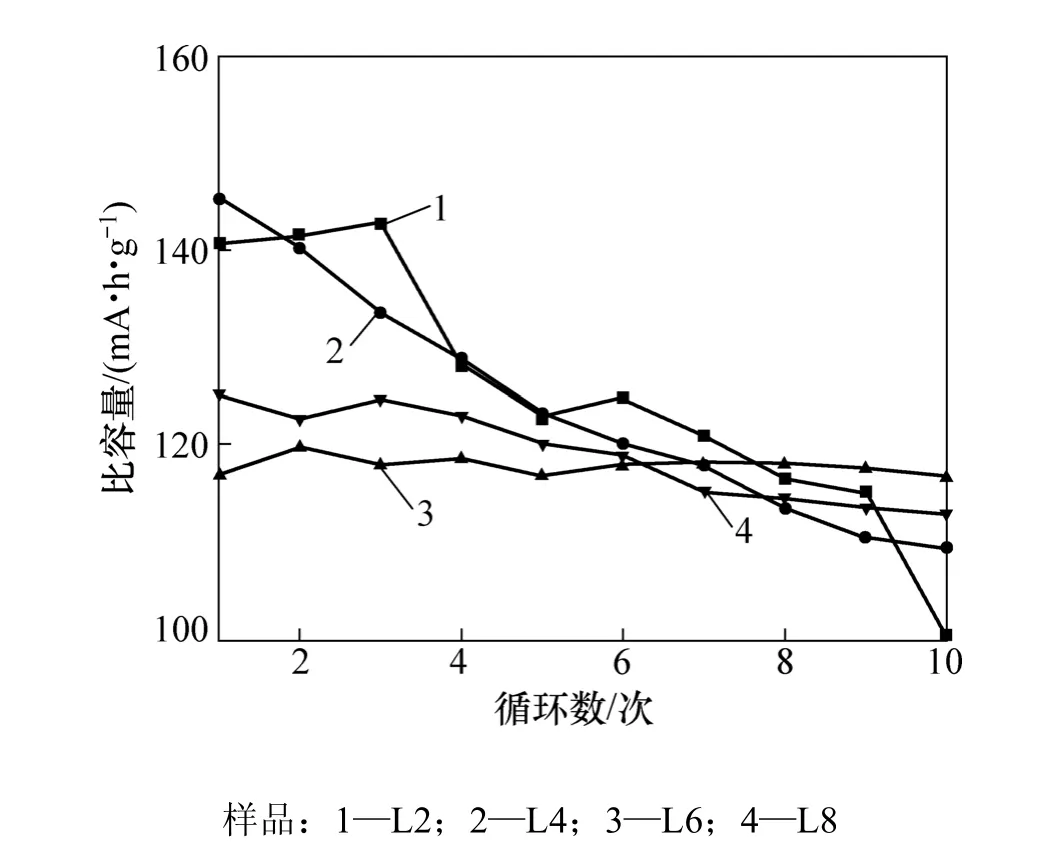
圖6 各樣品在0.5C循環放電比容量曲線Fig.6 Discharge specific capacity cycle curves of each sample at 0.5C rate
3 結論
(1) 在 3種煅燒制度下合成具尖晶石結構的Li4Ti5O12,其中于650 ℃保溫8 h后再升溫至800 ℃保溫6 h的低溫煅燒制度所得產物純度高,Li4Ti5O12含量達95%;電化學比容量高,0.1C首次放電比容量達170.1 mA·h·g-1;循環性能較好,0.5C充放電時10次循環后放電比容量幾乎未損失;倍率性能也較其他煅燒制度下所得產物優異。
(2) Li4Ti5O12的合成過程復雜,存在很多中間反應及產物,其中單斜晶系Li2TiO3是典型的中間產物。尖晶石 Li4Ti5O12的生成反應不僅與反應溫度和時間有關,而且與原料類型以及Li與Ti的物質的量比有關,其合成機理還需要進一步研究。
(3)低溫預燒制度為節約反應原料以及對Li4Ti5O12的改性提供了試驗和理論依據。
[1]GAO Jian, YING Jie-rong, JIANG Chang-yin, et al.High-density spherical Li4Ti5O12/C anode material with good rate capability for lithium ion batteries[J]. Journal of Power Sources, 2007, 166(1): 255?259.
[2]Seo H J, YUN C K. Characteristics of spherical- shaped Li4Ti5O12anode powders prepared by spray pyrolysis[J]. Journal of Physics and Chemistry of Solids, 2009, 70(1): 40?44.
[3]Pasquier A D, Huang C C, Timothy S. Nano Li4Ti5O12-LiMn2O4batteries with high power capability and improved cycle-life[J].Journal of Power Sources, 2009, 186(2): 508?514.
[4]Takada K, Ohta N, ZhANG Lian-qi. Interfacial modification for high-power solid-state lithium batteries[J]. Solid State Ionics,2008, 179(27/32): 1333?1337.
[5]于海英, 謝海明, 楊桂玲, 等. 鋰離子電池新型快充負極材料Li4Ti5O12的改性研究[J]. 高等學校化學學報, 2007, 28(8):1556?1560.
YU Hai-ying, XIE Hai-ming, YANG Gui-ling, et al.Modification studies on the novel anode material Li4Ti5O12with characteristic of fleetly charging for lithium ion batteries[J].Chemical Journal of Chinese University, 2007, 28(8):1556?1560.
[6]Amatucci G G, Badway F, Pasquier A D, et al. An asymmetric hybrid nonaqueous energy storage cell[J]. Journal of the Electrochemical Society, 2001, 148(8): 930?939.
[7]CHENG Liang, LIU Hai-jing, ZHANG Jin-jun, et al. Nanosized Li4Ti5O12prepared by molten salt as an electrode material for hybrid electrochemical supercar-pacitor[J]. Journal of the Electrochemical Society, 2006, 153(8): 1472?1477.
[8]臧戈, 包麗穎, 蘇岳峰, 等. 非對稱電化學電容器用新型Li4Ti5O12的制備與研究[J]. 功能材料, 2008, 39(5): 817?820.
ZANG Ge, BAO Li-ying, SU Yue-feng, et al. Preparation study on novel Li4Ti5O12for hybrid capacitor[J]. Journal of Functional Materials, 2008, 39(5): 817?820.
[9]劉東強, 賴瓊鈺, 郝艷靜, 等. Li4Ti5O12溶膠-凝膠法合成及其機理研究[J]. 無機化學學報, 2004, 20(7): 829?832.
LIU Dong-qiang, LAI Qiong-yu, HAO Yan-jing, et al. Study on synthesis and mechanism of Li4Ti5O12by Sol-Gel method[J].Chinese Journal of Inorganic Chemistry, 2004, 20(7): 829?832.
[10]許江楓, 李建玲, 李文生, 等. 電極活性材料Li4Ti5O12的制備及其主要影響因素[J]. 無機材料學報, 2007, 22(5): 879?884.
XU Jiang-feng, LI Jian-ling, LI Wen-sheng, et al. Preparation and key influencing factors of Li4Ti5O12as elctrode material[J].Journal of Inorganic Materials, 2007, 22(5): 879?884.
[11]阮艷莉, 唐致遠, 彭慶文, 等. 尖晶石型Li4Ti5O12電極材料的合成與電化學性能研究[J]. 無機材料學報, 2006, 21(4):873?879.
RUAN Yan-li, TANG Zhi-yuan, PENG Qing-wen, et al.Synthesis and electrochemical performance of spinel Li4Ti5O12electrode material[J]. Journal of Inorganic Materials, 2006, 21(4):873?879.
[12]Zaghib K, Simoneau M, Armand M, et al. Electrochemical study of Li4Ti5O12as negative electrode for Li-ion polymer rechargeable batteries[J]. Journal of Power Sources, 1999,81/82(3): 300?305.
[13]吳可, 仇衛華, 曹高萍, 等. Li4Ti5O12作為混合電化學電容器負極材料的電化學性能[J]. 北京科技大學學報, 2006, 28(10):951?955.
WU Ke, QIU Wei-hua, CAO Gao-ping, et al. Electrochemical properties of Li4Ti5O12as cathode material for a hybrid elect rochemical capacitor[J]. Journal of University of Science and Technology Beijing, 2006, 28(10): 951?955.
[14]高玲, 仇衛華, 趙海雷, 等. Li4Ti5O12作為鋰離子電池負極材料電化學性能[J]. 北京科技大學學報, 2005, 27(1): 82?85.
GAO Ling, QIU Wei-hua, ZHAO Hai-lei, et al. Lithiated titanuim complec oxcide as negtive electrode[J]. Journal of University of Science and Technology Beijing, 2005, 27(1):82?85.
[15]Abe Y, Matsui E, Senna M. Preparation of phase pure and well-crystallized Li4Ti5O12nanoparticles by precision control of starting mixture and calcining at lowest possible temperatures[J].Journal of Physics and Chemistry of Solids, 2007, 68(5/6):681?686.
[16]Kleykamp H. Phase equilibria in the Li–Ti–O system and physical properties of Li2TiO3[J]. Fusion Engineering and Design, 2002, 61/62(7): 361?366.
[17]Hu Y S, Kienle L, Guo Y G. High lithium electroactivity of nanometer-sized rutile TiO2[J]. Advanced Materials, 2006,18(11): 1421?1426.
[18]Vintins G, Kizane G, Lusis A. Electrical conductivity studies in the system Li2TiO3-Li1.33Ti1.7O4[J]. Journal of Solid State Electrochemistry, 2002, 6(5): 311?319.
(編輯 張曾榮)
Effect of calcined system on Li4Ti5O12material structure and electrochemical properties
LI Jie, WANG Jiao-li, ZHANG Zhi-an, LAI Yan-qing
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
The effects of three types of calcined system on structure and electrochemical performance of Li4Ti5O12prepared by solid state reaction at high temperature were investigated at three schemes: (1) 800 ℃(10 h), (2) 800 ℃(2 h)and 650 ℃(8 h); (3) 650 ℃(8 h) and 800 ℃(2 h, 4 h, 6 h, 8 h). The structure and morphology of the products were characterized by XRD and SEM. Though the ratio of Li/Ti in raw material is excessive by 8%, and there is still the persistence of TiO2for the scheme (1) and scheme (2) calcined system, while under the scheme (3) system, the persistence of TiO2decreases even disappears with prolonging time at 800 ℃. When the holding time at 800 ℃ exceeds by 6 h for scheme (3), the impurity phase is only little Li2TiO3, and the purity of Li4Ti5O12is high to 95%. The first discharge specific capacity of Li4Ti5O12in scheme (3) is 170.1 mA·h·g?1.
electrochemical energy storage; electrode material; Li4Ti5O12; calcined system
TM912
A
1672?7207(2011)02?0294?06
2010?03?01;
2010?05?25
國家科技支撐計劃項目(2007BAE12B01);中央高校基本科研業務費項目(2010QZZD0101)
李劼(1963?),男,湖南汩羅人,教授, 從事新能源材料研究;電話:0731-88830649;E-mail:13808488404@163.com

