早期腦損傷新生大鼠腦白質神經蛋白聚糖和多功能蛋白聚糖表達及意義
覃海茂, 姜志梅, 郭嵐敏, 張虎
宮內感染是絨毛膜羊膜炎及胎膜早破的最主要原因,也是腦室周圍白質軟化(periventricular leukom alacia,PV L)和腦性癱瘓(cerebral palsy,CP)發生的主要原因之一。伴隨炎癥反應的神經膠質增生中存在幾種化學介質,通過破裂的血腦屏障刺激了局部硫酸軟骨素糖蛋白多糖(chond roitin sulfate proteoglycans,CSPGs)表達增多。神經蛋白聚糖(Neurocan)和多功能蛋白聚糖(Versican)是CSPGs的兩個大亞類分子。本研究采用實時熒光定量RTPCR檢測宮內感染致腦損傷新生大鼠腦白質區Neurocan和Versican在不同時間點的表達,探討Neurocan和Versican在中樞神經損傷與修復、神經元相互作用和功能重組的機制,有助于中樞神經系統損傷后的康復治療。
1 材料與方法
1.1 實驗動物 清潔級成熟W istar雌性大鼠40只,雄性大鼠10只,體質量180~240 g,由佳木斯大學實驗動物中心提供(黑動字第99102001)。
1.2 藥品與試劑 Neurocan引物、Versican引物、溴乙錠(上海生物工程有限公司),Co lum n A nimal RNAOUT(北京天恩澤公司),PrimeScriptTMRT reagent Kit、SYBR Premix Ex TaqTM II、Rnase 抑制劑(TAKARA公司),瓊脂糖(美國Sigm a公司),Taq DNA聚合酶、100 bp M arker(寶生物工程(大連)有限公司)。
1.3 模型制作與分組 于17時以4∶1合籠,次日上午8時查陰道涂片,以查得精子為妊娠第0天,孕鼠另籠飼養。40只受孕母鼠隨機分為對照組(n=10)和脂多糖組(n=30),給予受孕18 d的脂多糖組孕鼠脂多糖(血清型055)380μg/kg,連續2 d腹腔注射,對照組孕鼠腹腔注射同等劑量的生理鹽水。觀察兩組孕鼠的分娩時間,去除早產鼠(孕22 d前分娩)。仔鼠出生后,取胎盤做蘇木精-伊紅(HE)染色觀察宮內感染情況。
1.4 觀察指標
1.4.1 HE染色觀察新生大鼠腦白質病理學改變 大鼠腦白質經固定、脫水、石蠟包埋后,將蠟塊行冠狀切片(5μm)置于經APES防脫片劑處理的載玻片上,經脫蠟、HE染色、二甲苯透明,光鏡觀察病理改變。
1.4.2 熒光定量RT-PCR檢測Neurocan m RNA和Versican mRNA Neurocan(77 bp)上游引物:5'-ACC TGG TAA CCC TGG AAG TGA-3'下游引物:5'-AGCGAA GGT CAA CGC ATA GC-3';Versican(90 bp)上游引物:5'-GCC ATC GAC AGC CTT CAC AG-3'下游引物:5'-CTC ACT GGG CTC CTTCTC AAA G-3';β-actin(150 bp)上游引物:5'-GGA GAT TAC TGC CCT GGC TCC TA-3',下游引物:5'-GAC TCA TCG TAC TCC TGC TTG CTG-3'。取500 ng cDNA依次梯度稀釋1倍、10倍、102倍、103倍、104倍,分別作為模板按照以下反應體系和反應條件進行擴增,7300 PCR儀自動生成標準曲線,通過R2值檢驗標準曲線的可行性。每一個待測指標對應一條標準曲線,且標準曲線的模板來自同一管cDNA。
1.5 統計學方法 采用SPSS 17.0統計軟件,數據資料以 x±s表示,兩樣本均數比較采用t檢驗;對所有結果進行正態性及方差齊性檢驗后,進行方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 孕鼠分娩及仔鼠的一般情況 對照組孕鼠均順利生產,孕鼠無死亡及提前分娩,共娩出活產足月仔鼠124只;脂多糖組中孕鼠5只死亡,6只提前分娩,剩余19只共娩出活產足月仔鼠132只,死亡24只。足月仔鼠出生后顏色淡紅,體質量正常。早產仔鼠顏色青紫、精神萎靡、進食減少、行動遲緩、活動減少、體質量低。
2.2 仔鼠腦白質病理學改變 各時間點對照組腦白質區神經細胞形態正常,輪廓清晰,核仁核膜明顯,大小無變化,未見明顯損傷性改變。脂多糖組0 d可見腦白質區內細胞胞體腫脹、細胞稀疏、間隙增寬,1 d毛細血管擴張,神經細胞排列紊亂、結構不清,7 d出現少量神經細胞腫脹、數量略有減少,細胞皺縮,14 d可見明顯的毛細血管擴張,腦室內出血,壞死灶中可見較多的膠質細胞,細胞核固縮、核碎裂明顯,21 d可見神經細胞大多數壞死,周邊有膠質細胞增生,28 d腦室旁白質呈篩網狀壞死。
2.3 兩組不同時間點Neurocan和Versican m RNA比較 脂多糖組0,1,7,14,21,28 d Neurocan m RNA相對表達量均較對照組高,差異有統計學意義(均P<0.05)。脂多糖組Neurocan m RNA相對表達在1 d升高顯著,7 d達高峰,28 d仍高于對照組(P<0.05)。脂多糖組0,1,7,14,21,28 d Versican m RNA相對表達量均較對照組高,差異有統計學意義(P均<0.05)。脂多糖組Versican m RNA相對表達在7~14 d達高峰,21~28 d逐漸下降,但仍高于對照組(P<0.05),見表1。
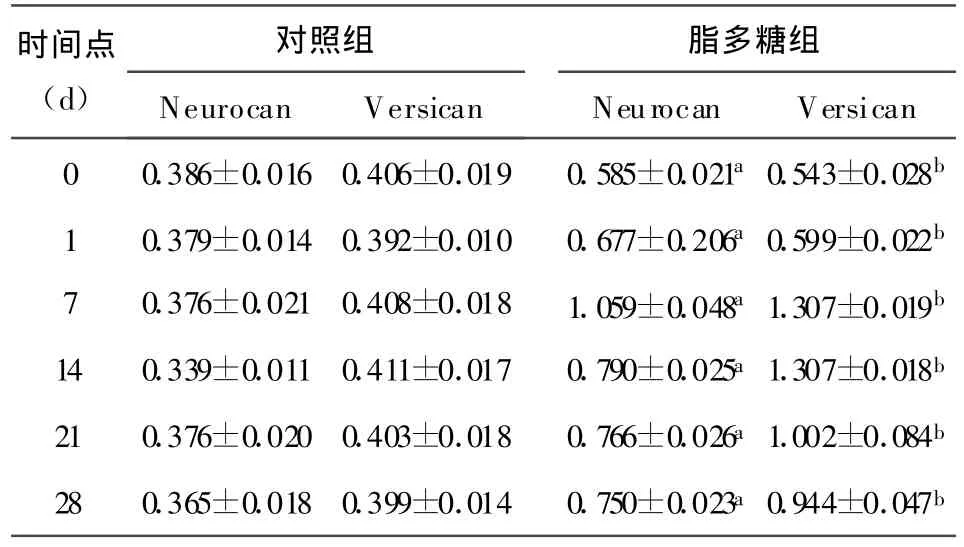
表1 不同時間點兩組Neurocan和Versican mRNA相對表達量比較( x±s,n=10)
表 1結果表明,兩組 Neurocan和 Versican mRNA表達不同時間點間比較,差異有統計學意義(P<0.05)。脂多糖組Neurocan mRNA表達0,1,14,21 d時間點比較差異有統計學意義(P<0.05);Versican mRNA表達0 d與1 d,1 d與7 d,14 d與21 d,21 d與28 d比較差異有統計學意義(P<0.05)。
3 討論
大量的動物實驗和臨床資料均證明感染、炎癥反應是導致腦白質損傷的重要因素。Dammann等[1]發現胎盤感染的新生兒發生PVL和腦室擴大的危險性增加60%~70%。此后,研究人員 Bell等[2]通過在受孕大鼠注射脂多糖建立的動物模型發現宮內感染能導致仔鼠腦白質損傷。外傷性腦損傷和高血壓腦卒中也會引起腦白質發生改變,但這類損傷機制在時間和空間上與腦性癱瘓發病機制截然不同。本實驗HE染色結果示脂多糖組0 d可見腦白質區內細胞胞體腫脹、細胞稀疏、間隙增寬;1 d腦白質區內毛細血管擴張,神經細胞排列紊亂、結構不清、核固縮變圓;7 d腦白質區內出現少量神經細胞腫脹、淡染,神經細胞的數量略有減少,細胞皺縮;14 d可見明顯的毛細血管擴張,腦室內出血,壞死灶中可見較多的少突膠質細胞及小膠質細胞,細胞核固縮、碎裂明顯;21 d可見部分細胞核濃縮、碎裂結構消失,神經細胞大多數壞死,嗜伊紅深染,周邊有膠質細胞增生;28 d腦室旁白質呈篩網狀壞死。
Neurocan是神經組織中硫酸軟骨素蛋白聚糖中一種重要物質,主要來源于神經膠質細胞。Neurocan與神經細胞黏附分子、細胞外基質和生長因子相互作用,參與細胞轉移和細胞增殖。大量證據表明,從kainite誘發癲癇開始,外傷性病變、局灶性腦缺血性發作等各種中樞神經損傷后出現Neurocan重現和積累[3]。Versican也是CSPGs家族成員之一,主要來源于少突膠質細胞前體細胞。通過免疫組化發現,用單面刀缺損大腦皮質后7 d凍存標本Versican在損傷周圍顯著增加;采用Western blot分析比較損傷與未損傷組織,發現損傷組織中有大量Versican。人體中樞神經系統中Neurocan表達在胎兒期達到高峰,在兒童期有全段和部分片段的神經蛋白聚糖鏈,而在成年期只有部分片段的糖鏈。當成熟的中樞神經系統損傷后,又可有全長的糖鏈出現,由此可見,中樞神經系統(central nerve system,CNS)損傷后,損傷位點蛋白表達上調[4]。由于受到發育調節,Neurocan在胚胎發育晚期表達增多但在出生后1個月內出現顯著下降[5]。也有研究認為,在正常CNS發育過程中,在出生時Neurocan表達達到最高[6]。本實驗結果顯示,對照組Neurocan表達在0 d達到最高水平,而脂多糖組Neurocan相對表達在1 d升高顯著,14 d達高峰,28 d仍高于對照組(P<0.05)。脂多糖組Versican相對表達在7~14 d達高峰,21~28 d逐漸下降,但仍高于對照組(P<0.05)。其一,在成年哺乳動物中樞損傷部位及炎癥反應區,組織損傷和血腦屏障破壞引起局部炎癥細胞入侵和炎癥因子的釋放導致細胞外基質分子上調,膠質活化啟動,從而使CSPGs長時間大量表達[7];而這些物質與細胞生物行為密切相關,影響細胞黏附,調節軸突生長,在中樞神經系統損傷后的修復過程中發揮著重要作用[8]。CSPGs具有調節細胞外基質和黏附分子以及細胞支架的組成,參與細胞與細胞基質信號傳導和物質交流,與生長因子共同影響神經元和軸突的生長,以及通過神經元周圍網絡調整神經細胞的可塑性[9]。隨著中樞神經系統發育成熟,可塑性也隨著降低。可塑性的關鍵窗口期通常在生后早期。在發育早期階段,CSPGs在神經元胞體及突觸周圍逐漸形成神經元周圍網絡,引起腦的可塑性機制停止[10]。其二,實驗發現在局灶型PV L的早期,腦白質區可見一些炎癥細胞聚集在壞死區的周圍,其中大量出現雙核特征的反應性膠質細胞;在 PVL后期,主要以腦室周圍白質囊腔存在為特征,神經膠質增殖及纖維化形成膠質瘢痕組織[11]。其三,CSPGs既可以在腦損傷早期由一系列炎癥因子和神經介質等刺激反應性膠質細胞表達,又可以在損傷后修復期存在于膠質瘢痕中。其四,正常發育的腦組織也存在CSPGs兩個亞型,但中樞神經生長的微環境處于平衡狀態,其表達會受到控制,不會阻礙神經元生長。因此,在中樞神經發育早期出現的一系列炎癥和免疫反應將逐步激活大量反應性膠質細胞表達CSPGs,出現一個高峰;隨后出現下降,可能與神經細胞損傷后凋亡壞死有關;之后維持在一定水平,可能由于損傷后修復形成膠質瘢痕所致。本實驗通過脂多糖制備宮內感染模型,從不同時間點動態了解CSPGs表達變化,根據CSPGs表達情況間接說明CNS損傷的內在機制,為臨床早期干預和治療找到一個恰當的“時間窗”。
CNS損傷后,神經元及軸突再生失敗主要由于神經再生抑制物質的存在。為了建立一個適合CNS生長的微環境,研究人員致力于從CSPGs降解藥物和信號通路方面探討新的途徑。目前研究比較熱門的幾點如下:采用單劑量到多次注射或使用微泵給硫酸軟骨素ABC降解CSPGs的抑制作用,促使損傷的神經元軸突生長[12];采用金屬硫蛋白誘導星型膠質細胞,導致CSPGs表達下調,此過程是由JAK/STAT和Rho信號通路調控;并且也有人認為CSPGs表達上調,是由MAPK信號通路介導[13];研究發現CSPG的信號通路與Rho/ROCK通路有關,例如小雞的背根神經節神經元含有神經蛋白聚糖底物,可以刺激 GTPase家族的 Rho/ROCK通路[14];除了 Rho-或ROCK-抑制劑,非甾體抗炎藥如布洛芬、消炎痛,通過抑制RhoA促進軸突再生也能顯示出類似的作用。動物實驗將布洛芬注射到脊髓損傷區,發現非甾體抗炎藥能阻止RhoA激活,刺激軸突生長[15]。此外,CSPGs還可以通過integrin信號通路調節多功能的神經母細胞生長、分化、轉移[16]。
[1] Dammann O,Leviton A.M aternal in trauterine infection,cytokines,and b rain damage in the preterm new born[J].Pediatr Res,1997,42(1):1-8.
[2] Bell M J,Hallenbeck JM.Effects of intrau terine inflamm ation on developing rat brain[J].JNeurosci Res,2002,70(4):570-579.
[3] Shen LH,Li Y,Gao Q,et al.Dow n-regu lation of neurocan expression in reactive astrocy tes promotes axonal regeneration and facilitates the neurorestorative effects of bone m ar row strom al cells in the ischemic rat b rain[J].Glia,2008,56(16):1747-1754.
[4] Tang X,Davies JE,Davies SJ.Changes in distribution cell associations,and protein exp ression levels of NG2,neu rocan,phosphacan,b revican,versican V2,and tenascin-C during acute to ch ronic maturation of spinal cord scar tissue[J].J Neu rosci Res,2003,71(3):427-444.
[5] Meyer-Puttlitz B,Junker E,Margolis RU,et al.Chondroitin sulfate proteoglycans in the developing central nervous system.II.Imm unocytochem ical localization of neu rocan and phosphacan[J].JCom p Neurol 1996,366(1):44-54.
[6] Inatani M,H on jo M,O tori Y,et al.Inhibitory effects of neurocan and phosphacan on neurite outgrow th from retinal ganglion cells in culture[J].Invest Ophthalmol V is Sci,2001,42(8):1930-1938.
[7] Li M,Shibata A,Li C,et al.M yelin-associated glycoprotein inhibits neu rite/axon g row th and causes cone collapse[J].J Neu rosci Res,1996,46(4):404-414.
[8] 李華,范玉華,曹進勝.硫酸軟骨素蛋白多糖與中樞神經系統損傷后修復[J].現代康復,2001,5(11):68-69.
[9] Snow DM,Sm ith JD,Cunningham A T,et al.Neu rite elongation on chond roitin sulfate proteoglycans is characterized by axonal fasciculation[J].Exp Neurol,2003,182(2):310-321.
[10] Pizzorusso T,M edini P,Berardi N,et al.Reactivation of ocular dom inancep lasticity in the adult visual cortex[J].Science,2002,298(5596):1248-1251.
[11] Kadhim H,Tabarki B,Verellen G,et al.Inflammatory cytokines in the pathogenesis of periventricular leukomalacia[J].Neu rology,2001,56(10):1278-1284.
[12] Yick LW,W u W,So KF,et al.Chondroitinase ABC promotes axonal regeneration of Clarke'sneurons after spinal cord injury[J].Neu roreport,2000,11(5):1063-1067.
[13] Leung YK,Pankhu rst M,Dunlop SA.M etallothionein indu ces a regenerative reactive astrocy te phenotype via JAK/STAT and RhoA signalling pathw ays[J].Exp Neu rol,2010,221(1):98-106.
[14] Monnier PP,Sierra A,Schw ab JM,et al.The Rho/ROCK pathway mediates neu rite grow th-inhibitory activity associated w ith the chond roitin su lfate proteoglycans of the CNSg lial scar[J].M ol Cell Neu rosci,2003,22(3):319-330.
[15] Fu Q,Hue J,LiS.Nonsteroidal an ti-inflammatory drugs p romote axon regeneration via RhoA inhibition[J].JNeurosci,2007,27(15):4145-4164.
[16] Gu W L,Fu SL,W ang YX,et al.Chondroitin sulfate p roteoglycans regu late the grow th,differentiation and migration of multipotent neural precu rsor cells through the integrin signaling pathw ay[J].Neuroscience,2009,10(128):1471-2202.

