HER2基因RNA干擾質粒對SK-BR-3細胞增殖及凋亡的影響
韓 冬,徐 煌,李文浩,張成文
(嘉興學院醫學院,浙江 嘉興 314001)
HER2是一種腫瘤表面抗原,正常成年人的組織中不表達而在多種腫瘤組織中表達[1]。而且HER2的表達與腫瘤的惡性程度及腫瘤患者的預后密切相關。目前已有針對HER2蛋白的單克隆抗體藥物上市,用作HER2過表達的乳腺癌的治療手段,并展現出良好的臨床療效。人們意識到抑制HER2蛋白,可以抑制其下游的細胞信號轉導途徑,起到控制腫瘤的發生發展的作用,將成為理想的腫瘤治療策略[2]。由于RNAi技術在實現基因沉默的過程中簡便易行,給人們操縱基因提供了強有力的工具,大大地提升了基因治療的可行性[3]。運用 RNAi技術,在既往的研究中我們構建了三個針對HER2基因的 RNA干擾質粒,通過實時定量PCR技術和western blot方法篩選出了HER2基因沉默效率最高的干擾質粒HER2-shRNA2。在本研究中我們將進一步研究干擾質粒HER2-shRNA2對乳腺癌細胞SKBR-3的HER2基因干擾的生物學效應,主要探討其對腫瘤細胞增殖和凋亡是否存在影響,為進一步研究乳腺癌的基因治療提供實驗資料。
1 材料與方法
1.1 材料 乳腺癌細胞系SK-BR-3購自中科院上海細胞庫,RNAi干擾質粒HER2-shRNA2由本室構建并保存,Lipofectamine2000購自invitrogen公司,RPMI1640細胞培養液購自GIBCO公司,RNase購自TAKARA公司,MTT、胰酶、PBS購自碧云天生物技術研究所。
1.2 方法
1.2.1 轉染 人乳腺癌細胞SK-BR-3在RPMI1640 37℃5%CO2條件下培養,在細胞長滿80%時進行轉染,實驗分三組HER2-shRNA2組(轉染高效干擾質粒HER2-shRNA2)、RNAi陰性對照組(negative control,轉染不針對任何基因的干擾質粒)、空白對照組(blank control,不采取任何措施,直接培養)。轉染使用Lipofectam ine2000,具體操作步驟按試劑說明書進行。
1.2.2 繪制細胞增殖曲線 分別取生長良好的HER2-shRNA2組、RNAi陰性對照組和空白對照組的三組細胞,用胰酶消化,用細胞培養液懸浮細胞并調整細胞的數量為1.0×104/ml,均勻接種于63個培養瓶中;每隔24 h每組進行一次細胞計數,每次每組取三瓶細胞分別計數取平均值。根據計數結果以時間為橫坐標,以單位細胞數為縱坐標繪制生長曲線。
1.2.3 MTT比色法測定轉染后細胞的生長抑制率取對數生長期的乳腺癌細胞SK-BR-3采用胰酶消化后,調整細胞的濃度為1×105/ml,接種于96孔板中,細胞分為三組,分別為HER2-shRNA2組、RNAi陰性對照組和空白對照組,三組質粒各0.2μg分別加Lipofectamine 500μl。各孔加入濃度為5 g/LMTT 20μl,繼續培養 4 h,吸去上清,每孔加入 DMSO 100 μl,緩慢震蕩10min。每組設三個復孔,分別測定24 h、48 h、72 h、96 h 4個時間點。用酶標儀檢測各孔的吸光度值(OD490),按照公式細胞生長抑制率(%)=(1-實驗組/對照組)×100%,計算細胞的生長抑制率。
1.2.4 流式細胞儀檢測凋亡細胞 分別收集各組轉染后的細胞1×106個,離心后用PBS懸浮細胞,1 000 rpm離心10min,再清洗兩遍去上清,用70%冷乙醇迅速固定,4℃放置12 h以上后用PBS洗2次,調整細胞濃度為1×106/ml,用 RNase消化,加入1.5m l PI(5 mg/100 ml)對DNA進行染色。混勻后在流式細胞儀分析,G1期峰之前出現的亞峰為凋亡細胞峰,結果以凋亡細胞的百分率表示。
1.2.5 western blot檢測乳腺癌細胞SK-BR-3中PCNA的表達量 將轉染48小時后的HER2-shRNA 2組 、negative control、blank control組分別用 PBS 洗三次,用細胞裂解液裂解細胞提取總蛋白,取100μg上樣進行SDS-PAGE電泳,電泳結束后,將膠上的蛋白用電轉化的方法轉移至PVDF膜上,封閉過夜,依次加入PCNA單克隆抗體、β-actin抗體為一抗和辣根過氧化酶標二抗,用DAB顯色,拍照。
1.2.6 統計分析 實驗結果應用SPSS 11.0統計學軟件處理數據。
2 結果
2.1 熒光顯微鏡下觀察細胞轉染狀態 HER2-shRNA2和Negative control組質粒中含有的綠色熒光蛋白基因與干擾序列共表達,可作為轉染成功的報告蛋白。在轉染24小時后觀察到HER2-shRNA2和Negative control組中可見綠色熒光蛋白的表達,說明干擾質粒已經成功的轉到細胞當中。而空白對照組,由于不轉染含有表達GFP綠色熒光蛋白的質粒,在熒光顯微鏡下沒有觀察到綠色熒光。見圖1。

圖1 培養48 h后各組細胞熒光顯微鏡下形態(×100)
2.2 計數法繪制細胞增殖曲線 HER2-shRNA2組細胞增殖速度明顯比RNAi陰性對照組和空白對照組的增殖速度慢,抑制細胞增殖的現象出現的比較早。在培養的第3天出現了顯著差異(P<0.05)。見圖2 、3。
2.3 MTT檢測細胞生長抑制率 MTT結果顯示HER2-shRNA2組在490 nm處的吸光度顯著降低,而RNAi陰性對照組和空白對照組吸光度沒有明顯改變,說明沉默HER2基因后在一定程度上抑制了SKBR-3細胞的增殖。由表1中可以看出HER2-shRNA2轉染后48 h、72 h、96 h細胞生長抑制率分別為 16.53%、39.03%、65.47%。
2.4 流式細胞儀檢測細胞凋亡 以空白對照組作為對照HER2-shRNA2組在72 h和96 h的凋亡率分別為10.29%,17.36%,HER2-shRNA2組在72h后出現了明顯的細胞凋亡峰。而blank control組和negative control組相比無顯著性差異。見表2。
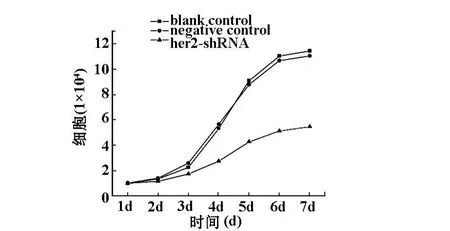
圖2 各組細胞增殖曲線

圖3 各組細胞增殖第96h細胞形態(×100)

表1 MTT法檢測HER2-shRNA2對SK-BR-3細胞增殖的抑制作用

表2 流式細胞檢測細胞凋亡
2.5 western b lot檢測PCNA的表達 增殖細胞核抗原(PCNA)是反映細胞增殖狀態的良好指標。當細胞增殖旺盛時,細胞中的PCNA表達量會很高;而當細胞增殖受到抑制的時候,PCNA的表達量也會相應下降。western blot的結果可知HER2-shRNA 2干擾質粒組的PCNA表達量下降,表明干擾質粒抑制了腫瘤細胞的增殖。見圖4。
3 討論
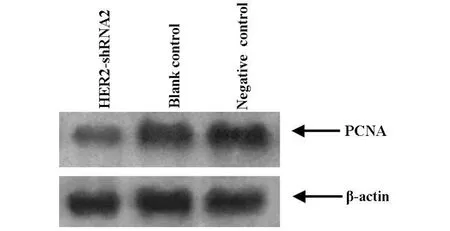
圖4 western blot檢測不同實驗組PCNA的表達
原癌基因HER2其編碼產物是具有受體酪氨酸激酶活性的跨膜蛋白,屬于表皮生長因子受體家族的成員。HER2激活后會引起一系列細胞信號轉導反應,促進腫瘤細胞的增殖,抑制腫瘤細胞的凋亡以及對多種化療藥物產生耐藥性[4,5]。HER2的過表達常常提示腫瘤的惡性度高及其預后不良[6]。目前已有針對HER2蛋白的單克隆抗體藥物上市,用作HER2過表達的乳腺癌的治療手段,并展現出良好的臨床療效[7,8]。人們意識到抑制HER2在腫瘤發生發展過程中的作用,將成為理想的腫瘤治療策略。我們設想如果能通過RNAi的方法降低HER2在乳腺癌中的表達,將會控制腫瘤細胞的生長及其浸潤速度,為乳腺癌的治療提供新方法。
根據RNAi技術特點[9],shRNA和siRNA相比,shRNA在生物體內的穩定性大大提高。siRNA在體內的半衰期只有數天,而shRNA的半衰期可以達到數周甚至數月。因此研究RNAi的長期生物學效應,必須構建可在體內長期發揮作用的干擾質粒。我們在既往的研究中構建了三個針對HER2基因的RNA干擾質粒,并通過實時定量PCR技術和western blot方法篩選出了基因沉默效率最高的干擾質粒HER2-shRNA2。前期的實驗只是對shRNA干擾HER2基因的直接效果進行測試,將HER2-shRNA2轉染入SKBR-3乳腺癌細胞中出現了HER2mRNA和HER2蛋白表達水平的下降。而HER2基因被抑制后,會產生一系列的生物學反應,其中對細胞增殖和凋亡的影響則是我們關心的焦點。
在本次實驗中我們首先對細胞增殖速度進行了定量測定,采用了直接計數法和MTT比色測定兩種方法。通過直接計數的方法,我們可以直觀的看到shRNA的細胞增殖速度明顯比陰性對照和空白對照組慢。而通過MTT比色測定法計算的生長抑制率和直接計數法繪制生長曲線的結果是一致的。進一步的流式細胞儀檢測中我們發現,轉染HER2-shRNA2干擾質粒組的SK-BR-3細胞大多會停留在G0/G1期,我們知道停留在G0/G1期的細胞會進一步走向凋亡的途徑[10],所以最終檢測結果中HER2-shRNA2質粒干擾組的細胞凋亡率大大提高。增殖細胞核抗原(PCNA)是DNA聚合酶δ的輔助蛋白,它是反映細胞增殖狀態的良好指標。當細胞增殖旺盛時,細胞中的PCNA表達量會很;而當細胞增殖受到抑制的時候,PCNA的表達量也會一定程度的下降。本實驗對PCNA進行了western blot檢測,western blot的結果可知HER2-shRNA2干擾質粒組的PCNA表達量下降,而在生長旺盛的陰性對照和空白對照組的細胞中PCNA的表達大大增強。PCNA的測定結果解釋了,為什么干擾質粒組的細胞生長速度比較慢,而RNAi陰性對照和空白對照組腫瘤細胞生長速度較快。
HER2是一系列信號轉導途徑的起始分子,它會發動一系列的生物學反應促進腫瘤的生長。本研究結果顯示HER2-shRNA2干擾質粒在細胞水平可以抑制HER2基因和HER2蛋白的表達,并促進乳腺癌細胞凋亡,最終控制乳腺癌細胞的增殖速度,可以做為活體動物水平抗腫瘤實驗的優選載體,有望開發為新一代抗腫瘤基因藥物。
[1]Subik K,Lee JF,Baxter L,et al.The Expression Patterns of ER,PP,HER2,CK5/6,EGFR,Ki-67 and AR by immunohistochem ical analysis in BreastCancer Cell Lines[J].BreastCancer,2010,20(4):35.
[2]ScaltritiM,Baselga J.The epidermal growth factor receptor pathway:a model for targeted therapy[J].Clin Cancer Res,2006,12:5268.
[3]Dykxhoorn DM,Palliser D,Lieberman J.The silent treatment:siRNAsas smallmolecule drugs[J].Gene Ther,2006,13:541.
[4]Engelsen IB,Stefansson IM,Beroukhim R,et al.HER-2/neu expression is associated with high tumor cellproliferation and aggressive phenotype in a population based patient seriesofendometrialcarcinomas[J].Int JOncol,2008,32(2):307.
[5]Mittendorf EA,Liu Y,Tucker SL,et al.A novel interaction between HER2/neu and cyclin E in breast cancer[J].Oncogene,2010,29(27):3896.
[6]TsutsuiS,Ohno S,Murakami S,etal.Prognostic value of C-erbB2 expression in breast cancer[J].JSurg Oncol,2002,79(4):216.
[7]Piccart-Gebhart MJ,Proctor M,Leyland-Jones B,Goldhirsch A,et al.Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J].N Engl JMed,2005,353:1659.
[8]ScheueW,Friess T,BurtscherH,et al.Strongly enhanced antitumor activity of trastuzumab and pertuzumab combination treatment on HER2-positive human xenograft tumormodel[J].Cancer Res,2009,69(24):9330.
[9]Aigner A.Application of RNA interference:current state and prospects for siRNA-base strategies in vivo[J].JAppl Microbiol Biotechnol,2007,76(1):9.
[10]Spidlen J,Shooshtari P,Kollmann TR,et al.Flow cytometry data standards[J].BMC Res Notes,2011,4(1):50.

