人剪切修復基因XPD對p52和p21基因的影響*
馬果果 張吉翔
腫瘤屬于基因疾病,其生物學基礎是基因的異常。DNA損傷若不能得到及時有效地修復,積累到一定程度可導致基因組不穩定性升高,從而引起細胞增殖和分化失控,導致腫瘤的發生[1]。XPD是哺乳動物基本轉錄因子ⅡH(TFⅡH)的核心亞單位之一,參與基因轉錄、核苷酸切除修復及細胞周期調控,并影響多種抑癌基因和癌基因的表達[2]。XPD過表達對腫瘤生長的影響已成為近年來研究的熱點。本研究將野生型XPD基因轉染入人肝癌細胞HepG2中,并檢測XPD、p52及p21的表達,觀察轉染前后肝癌細胞的生物學變化。
1 材料與方法
1.1 材料 人肝癌細胞HepG2購自美國模式菌種收集中心。重組質粒pEGFP-N2-XPD(XPD質粒)及胎中血清Fetal Bovin Serum(pEGFP-N2,N2質粒)由本實驗室構建[3]。MEM培養基購自美國Gibco公司。胎牛血清(FBS)購自澳大利亞Hy?clone公司。Lipofectamine 2000TM、Trizol購自美國Invitrogen公司。M-MLV Reverse Transcriptase、Rnasin、dNTP、Oligo(dT)及N,N,N,N-四甲基乙二胺(TEMED)購自美國Promega公司。PCR引物購自上海生工生物工程有限公司。Tag PCR Master?Mix、Markr I購自北京天根生化科技有限公司。總蛋白提取試劑盒購自北京普利萊基因技術有限公司。單克隆抗體XPD、p52、p21購自美國Santa Cruz公司。異丙醇、氯仿、無水乙醇購自上海振華化工廠。DMSO(Dimethyl sulfide)、DEPC(Diethyl pyrocarbonate)購自美國Ameresco公司。Tris購自美國Roche公司。MTT購自上海普飛生物技術有限公司。
1.2 細胞培養及轉染 HepG2細胞在含10%胎牛血清的DMEM培養基中,于37℃、5%CO2孵箱中培養,以0.25%胰蛋白酶消化,2~3 d傳代1次。根據細胞處理情況的不同分為3組:肝癌細胞無轉染空白對照組HepG2、空載質粒轉染細胞HepG2-pEGFP-N2組(N2組)以及重組質粒轉染細胞HepG2-pEGFP-N2-XPD組(XPD組)。以2×105/孔的密度鋪于6孔板內,24 h細胞鋪滿50%~80%,用脂質體2000進行瞬時轉染。Trizol法提取細胞總RNA,合成cDNA。PCR擴增XPD、p52以及p21。根據GenBank上公布的人類XPD、p52及p21 mRNA序列,應用Primer Primier 5軟件設計引物,由上海生工生物工程公司合成,見表1。同一標本擴增β-actin作為內參照。PCR通過94℃預變性5 min,94℃45 s,54℃60 s,72℃45 s,35個循環后72℃終末延伸10 min。PCR產物經15 g/L瓊脂糖凝膠電泳(含5 mg/L溴化乙錠)后,在紫外燈下觀察結果。通過Quantity One圖像分析軟件(Bio-Rad公司)讀取目的電泳條帶的斑點密度掃描值,以各組β-actin條帶的掃描值標化其相應組的XPD、p52及p21的密度掃描值,獲得其mRNA相對表達量。

表1 XPD、p52及p21引物序列
1.3 Western blot檢測 使用蛋白抽提液分別提取3組細胞的總蛋白,全自動生化分析儀(Beckman,USA)測定蛋白濃度。取同量蛋白上樣于8%聚丙烯酰胺凝膠進行電泳,繼而轉移蛋白于硝酸纖維素膜;將膜置于含5%脫脂奶粉的TBST中4℃封閉過夜,加封閉液稀釋的一抗(1∶200)過夜,用TBST洗膜3次,15 min/次,加封閉液稀釋HRP標記二抗(1∶2 000),4℃過夜,TBST洗膜3次,30 min/次,最后ECL顯色,經曝光、顯影、定影后,觀察結果。通過Quantity One圖像分析軟件(Bio-Rad公司)讀取目的電泳條帶的斑點密度掃描值,以各組β-actin條帶的掃描值標化其相應組的XPD、p52、以及p21的密度掃描值,獲得其蛋白相對表達量。
1.4 MTT法檢測細胞增殖力 上述3組細胞于對數期分別接種于96孔板中,每孔1×103個細胞,以培養基為對照組,于37℃、5%CO2的條件下培養24 h后每孔加入5 g/L MTT 10 μL,繼續培養4 h,棄上清,加入100 μL DMSO,振蕩10 min,酶標儀測定492 nm處各孔光密度(OD)值,取每孔平均值。
1.5 統計學方法 采用SPSS 11.5統計軟件進行分析,符合正態分布的計量資料用±s表示,組間比較用單因素方差分析,進一步兩兩比較采用SNK-q檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 pEGFP-N2-XPD轉染結果 通過脂質體轉染方式將pEGFP-N2和pEGFP-N2-XPD重組質粒轉染入HepG2細胞40 h后,熒光顯微鏡下可見XPD組和N2組細胞中均有綠色熒光蛋白的表達,未轉染的HepG2細胞則未見表達,見圖1。

2.2 各組細胞內XPD、p52及p21 mRNAs表達量情況 XPD組中XPD mRNA、p21 mRNA表達量高于相應N2組和空白對照組,而p52 mRNA表達量低于N2組和空白對照組,差異均有統計學意義(均P<0.05),見表2、圖2。
表2 各組細胞XPD、p52、p21 mRNA的表達比較(±s)
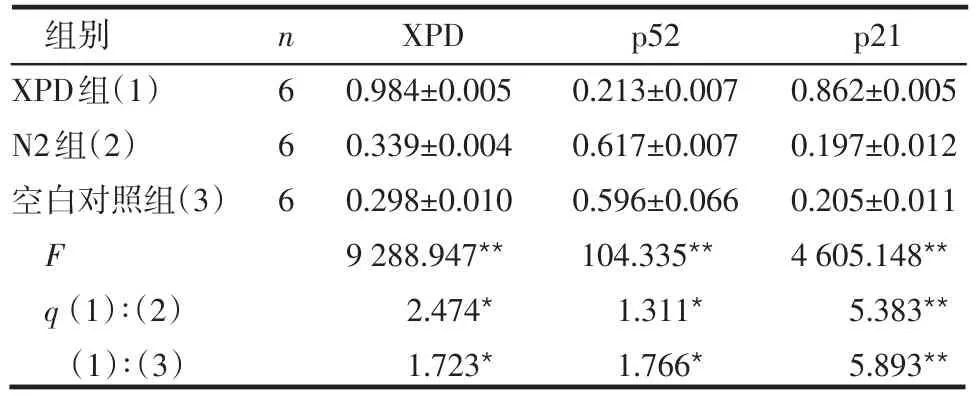
表2 各組細胞XPD、p52、p21 mRNA的表達比較(±s)
*P<0.05,**P<0.01;表3同
組別XPD組(1)N2組(2)空白對照組(3)F q(1)∶(2)(1)∶(3)n666 XPD 0.984±0.005 0.339±0.004 0.298±0.010 9 288.947**2.474*1.723*p52 0.213±0.007 0.617±0.007 0.596±0.066 104.335**1.311*1.766*p21 0.862±0.005 0.197±0.012 0.205±0.011 4 605.148**5.383**5.893**

2.3 各組細胞XPD、p52及p21蛋白的表達情況比較 XPD組中XPD、p21蛋白表達量高于N2組和空白對照組,而p52低于其他2組,差異均有統計學意義(均P<0.01),見表3、圖3。
表3 各組細胞XPD、p52、p21蛋白的表達情況(±s)
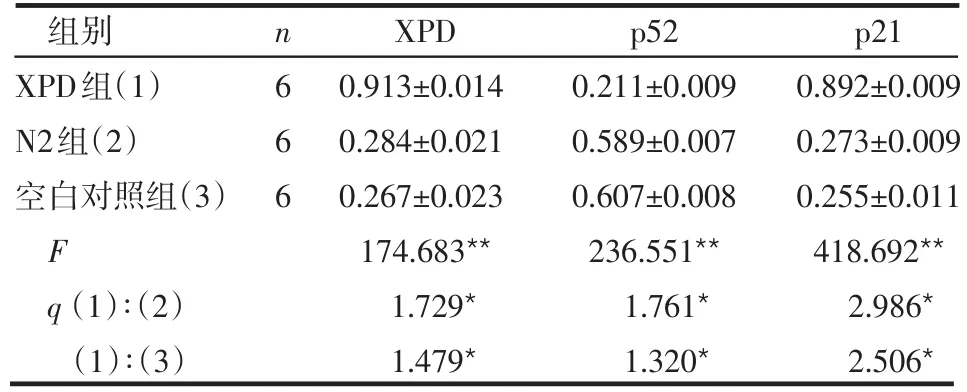
表3 各組細胞XPD、p52、p21蛋白的表達情況(±s)
組別XPD組(1)N2組(2)空白對照組(3)F q(1)∶(2)(1)∶(3)n666 XPD 0.913±0.014 0.284±0.021 0.267±0.023 174.683**1.729*1.479*p52 0.211±0.009 0.589±0.007 0.607±0.008 236.551**1.761*1.320*p21 0.892±0.009 0.273±0.009 0.255±0.011 418.692**2.986*2.506*

2.4 pEGFP-N2-XPD重組質粒對HepG2細胞增殖活力的影響 XPD組、N2組、空白對照組的OD值分別為0.475±0.010、0.927±0.016、0.934±0.010,3組比較差異有統計學意義(F=1 213.506,P<0.01)。XPD組與其他2組比較,差異均有統計學意義(均P<0.01)。
3 討論
TFⅡH是一個多酶復合物,通過XPD的橋梁作用把核心亞復合物(由XPB、p62、p52、p44、p34及p8組成)和CAK亞復合物(由cdk7、cyclin H和MAT1組成)聯系起來。XPD作為TFⅡH的支架,在核苷酸切除修復過程中負責從5→3方向打開受損位置的DNA雙鏈。XPD基因發生突變時,核苷酸剪切修復受到影響,發生腫瘤的概率更高。最近研究發現,XPD及環境因素共同作用,與肝癌的發生有密切關系[4]。
目前國內外對XPD基因與p52基因間的關系研究報道尚少。p52又稱核因子(NF)-kappa B2,活化的NF-kappa B復合物是Rel多肽家族不同形式二聚體的組合,包括p50(NF-kappa B1)、p52(NF-kappa B2)、CRel、VRel、Rel(ALPG)和RelB。NF-kappa B信號傳導通路在不同腫瘤的演進和發展過程中均起著關鍵的作用[5]。Ras具有誘導細胞調亡的作用,而NF-kap?pa B可以抑制這一作用,從而促進腫瘤生長[6]。在大部分肝癌中都有Bcl-3的異常表達,Bcl-3與NF-kappaB p50和p52相互作用,Bcl-3/p50或者Bcl-3/p52的相互作用對肝癌的發生有重要影響[7]。已有研究表明,XPD基因可激活p53[8],而p53可以選擇性下調Bcl-3蛋白水平,抑制cyclin D1啟動子活性,降低cyclin D1蛋白和mRNA的表達水平,進而導致細胞在G1期阻滯,抑制細胞增殖。本研究結果顯示,將XPD轉染入HepG2肝癌細胞后,p52在mRNA和蛋白水平的表達量均有明顯下降,表明XPD對p52基因的表達可能有抑制作用,從而起到了抑制癌細胞生長的作用。
p21又稱細胞周期調控基因,可以通過2條途徑發揮作用,一是p53介導的途徑,p21WAFl/C1P1基因是p53基因最重要的下游特異性基因之一,當細胞受到來自體外或體內的各種損傷后,野生型p53蛋白作用于p21基因,使其迅速表達,從而發揮p21生物學功能。二是非p53依賴途徑,近年研究發現,在腫瘤壞死因子、組織型纖溶酶原激活劑等因素的作用下,p21基因可以脫離p53的作用快速發生反應,使受損的細胞發生G1、G2期的細胞周期阻滯[9]。p21作為細胞周期負性調節因子,p21蛋白表達減弱,可導致細胞增殖失去有效監控及瘤細胞惡性表型增加,從而參與腫瘤的形成和發展。本研究顯示轉染XPD后,p21的表達量上調,肝癌細胞生長受到抑制,進一步證實了p21基因發揮的抑癌作用。
野生型p53是公認的抑癌基因。研究表明,XPD基因可激活p53,并且影響其生物活性[8],而p21是p53的下游激活產物,XPD可以通過p53間接上調p21。另一方面,p52又能抑制細胞周期蛋白依賴激酶抑制劑p21的表達[10]。所以筆者推測轉染后p52表達量的降低可能導致對p21抑制作用減弱,p21表達量增加。
綜上,XPD可與p21協同作用對肝癌細胞的生長產生抑制,XPD通過抑制促癌基因p52表達,降低HepG2肝癌細胞的增殖能力。所以,XPD基因的轉染可通過對相關基因的影響有效地抑制HepG2細胞的生長,可為臨床治療肝癌提供新的思路。
[1]Cazaux C.Genetic instability as a driver for oncogenesis[J].Bull Can?cer,2010,97(11):1241-1251.
[2]Lehmann AR.XPD structure reveals its secrets[J].DNA Repair (Amst),2008,7(11):1912-1915.
[3]湯蕾,張吉翔,熊瑛.人著色性干皮病D組基因的克隆及其真核表達[J].生物醫學工程學雜志,2008,25(3):668-672.
[4]曾小云,仇小強,紀龍,等.DNA修復基因XPD單核苷酸多態性和環境因素的交互作用與肝細胞癌的關聯研究[J].中華流行病學雜志,2009,30(7):702-705.
[5]Saito T,Sasaki CY,Rezanka L,et al.p52-Independent nuclear trans?location of RelB promotes LPS-induced attachment[J].Biochem Bio?phys Res Commun,2010,391(1):235-241.
[6]Mayo MW,Wang CY,Congswell PC,et al.Requirement of NF-kap?paB activation to suppress p53 independent apoptosis indced by on?cogenic Ras[J].Science,1997,278(5344):1812-1815.
[7]O’Neil BH,Buzkova P,Farrah H,et al.Expression of nuclear fac?tor-kappaB family proteins in hepatocell Ularcarcinomas[J].Oncolo?gy,2007,72(1):97-104.
[8]Dumaz N,Drougard C,Quilliet X,et al.Recovery of the normal p53 response after UV treatment in DNA repair-deficient fibroblasts by retroviral-mediated correction with the XPD gene[J].Carcinogene?sis,1998,19(9):1701-1704.
[9] Satyanarayana A,Hilton MB,Kaldis P.p21 Inhibits Cdkl in the ab?sence of Cdk2 to maintain the G1/S phase DNA damage checkpoint [J].Mol Biol Cel1,2008,19(1):65-77.
[10]Schumm K,Rocha S,Caamano J,et al.Regulation of p53 tumour suppressor target gene expression by the p52 NF-kappaB subunit [J].Embo J,2006,25(20):4820-4832.

