小鼠腎集合管發育中的細胞凋亡與水通道蛋白2的表達
田鶴,王旭,李曉明,郭敏
(1.遼寧醫學院組織學與胚胎學教研室,遼寧 錦州 121001;2.遼寧中醫藥大學組織學與胚胎學教研室,沈陽 110032)
機體從胚胎到發育成熟不僅經歷細胞增殖的過程,同時也伴隨著細胞凋亡。細胞凋亡又稱程序性細胞死亡,在胚胎器官發育中起著重要作用[1]。在細胞凋亡過程中,多種基因家族及其產物起著關鍵性的作用。研究報道,水的轉運在細胞凋亡過程中發揮一定的作用,在集合管中水的轉運主要是通過水通道蛋白 2(aquaporin-2,AQP-2)來完成的[2]。為了進一步探討AQP-2與細胞凋亡及集合管發育的關系,本研究通過免疫組織化學、體視學、電鏡和TUNEL染色法觀察小鼠腎集合管發育過程中AQP-2的表達和細胞凋亡情況,探討兩者的關系及在腎集合管發育過程中的作用。
1 材料與方法
1.1 實驗動物和光、電鏡標本制備
昆明小鼠,按雌雄比例1∶1同窩飼養,采用檢查陰道栓脫落的方法確定雌鼠受孕時間,以觀察到陰道栓脫落的最早時間計為胚齡(embryonic,E)0 d。記錄受孕時間,然后將孕鼠分籠飼養,每日早8:00和晚5:00觀察生產情況,以觀察到仔鼠出生的最早時間計為生后日齡(neonatal,N)0 d,記錄出生日期。選取 E16、17、18 d 的胎鼠和 N1、3、7、14、21、40 d 的仔鼠,每組取5只鼠。將孕鼠用乙醚麻醉后剖腹取胎鼠,E16,E17,E18 d 的胎鼠剖腹取腎,N1,N3,N7,N14,N21,N40 d仔鼠處死后取腎。左腎入10%中性甲醛固定,常規石蠟包埋切片,厚5μm,用作免疫組化和TUNEL染色。右腎以2.5﹪戊二醛固定,仔鼠腎臟的髓質、胚胎全腎進行樹脂包埋,取樹脂包埋塊,LKB-V型超薄切片機先切半薄切片,經光鏡觀察選擇后進行超薄切片,厚度為50~70 nm。醋酸鈾、枸櫞酸鉛染色,1200EX(JEOL)透射電鏡觀察。
1.2 免疫組織化學方法檢測AQP-2(SABC法)
石蠟切片脫蠟后,經微波修復10 min后滴加3%H2O2室溫孵育10 min,滴加山羊血清封閉液室溫孵育 5 min,加一抗(濃度 1∶100)37℃孵育 1 h,滴加生物素標記的二抗37℃孵育30 min,滴加SABC 37℃孵育30 min,DAB顯色5 min,蘇木精復染、脫水、透明、封片,光鏡下觀察。用PBS代替一抗作陰性對照。抗體稀釋均用pH7.4的PBS。
1.3 檢測細胞凋亡(TUNEL法)
石蠟切片脫蠟后,滴加蛋白酶K(20 mg/L溶于三羥甲基氨基甲烷/鹽酸中)室溫孵育15 min,滴加TUNEL混合溶液(50μL/片),37℃孵育 60 min,滴加轉化劑 POD(50μL/片),37℃孵育 30 min,DAB顯色,蘇木精復染、脫水、透明、封片,光鏡下觀察。用不含末端脫氧核苷酸轉移酶的液體代替TUNEL混合溶液作陰性對照。
1.4 體視學測量
用SABC法染色的切片每個動物的腎隨機取5張,切片在油鏡下按“S”形選取視野,采用方格測試系統,交點計數法測算AQP-2在集合管管腔膜陽性表達的面密度值,公式為:Sv=2Ll=2 Ix/Lc(Lc=ΣPc·a),式中Ix為陽性表達的細胞膜與測試方格的交點數,Pc為落在參照系的測試點數,a為方格的兩點間距離,相當于實際長度的0.1 mm。用TUNEL法染色的切片每個動物的腎隨機取5張,切片在400倍光鏡下按“S”形選取視野,采用方格測試系統,至少計數1 000個細胞,計算陽性細胞所占的百分比。細胞凋亡指數=凋亡陽性細胞數/細胞總數×100%。
1.5 統計學處理
數據以x±s表示,采用單因素方差分析。統計分析用SPSS16.0軟件完成,P<0.05認為差異有統計學意義。
2 結果
2.1 TUNEL染色結果
細胞核中有棕色顆粒者為陽性細胞。N1 d小鼠的集合管上皮中可見陽性細胞(圖1),N7 d時陽性細胞數最多(圖2)。N14 d開始,陽性細胞數量逐漸減少。

圖1 N1 d小鼠腎集合管,可見少量凋亡細胞 TUNEL染色×1 000Fig.1 The apoptotic cells in collecting ducts of mice at N1 d TUNELstaining×1 000
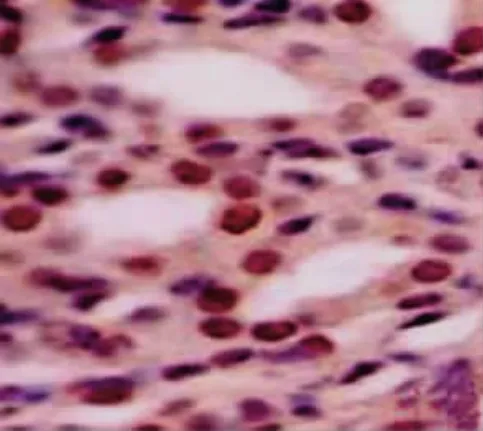
圖2 N7 d小鼠腎集合管,可見大量凋亡細胞 TUNEL染色×1 000Fig.2 The apoptotic cells in collecting ducts of mice at N7 d TUNELstaining×1 000
2.2 電鏡觀察結果(圖3,4)

圖3 N7 d小鼠腎集合管中的凋亡細胞 電鏡×6 500Fig.3 The apoptotic cells in collecting ducts of mice at N7 d Electron microscope×6 500
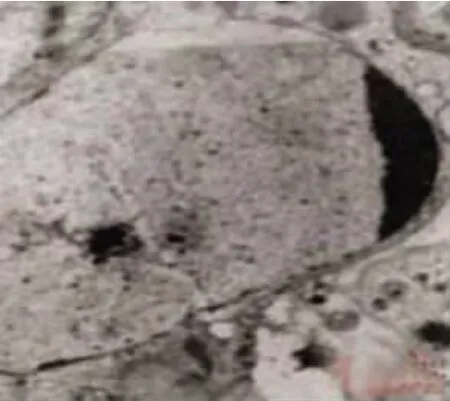
圖4 N7 d小鼠腎集合管中的凋亡細胞 電鏡×10 000Fig.4 The apoptotic cells in collecting ducts of mice at N7 d Electron microscope×10 000
N1 d即可見到凋亡細胞,N7 d的集合管中凋亡細胞明顯,凋亡細胞的主要表現為細胞體積縮小,核固縮,染色質凝聚成球形、半月狀、月牙狀。
2.3 免疫組織化學染色結果
免疫組織化學染色顯示,E17 d小鼠腎中出現集合管,此時可見AQP-2微弱表達,表達部位為集合管的管腔膜和胞質內,呈棕褐色(圖5)。隨后,在E18 d以及N1,3,7 d的集合管管腔膜和胞質內均有陽性表達的AQP-2,表達強度逐漸增強(圖6)。N14 d至N40 d的集合管中均可見陽性表達的AQP-2,但是表達強度無明顯變化。
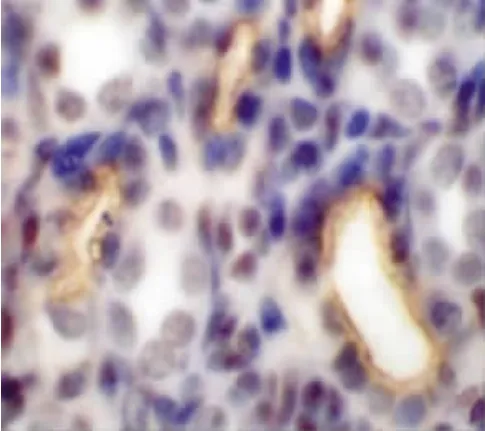
圖5 E17 d小鼠腎集合管,AQP-2弱表達 免疫組化×1 000Fig.5 The expression of AQP-2 in collecting ducts was faint at E17 d Immunohistochemistry staining×1 000
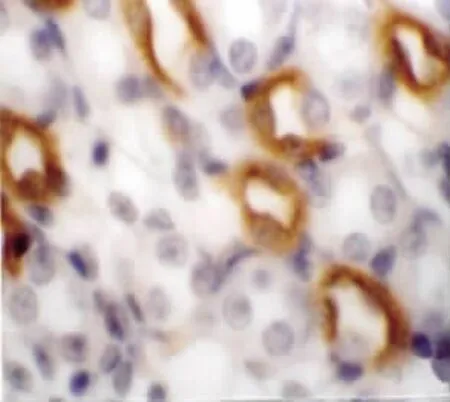
圖6 N7 d小鼠腎集合管,AQP-2強表達 免疫組化×650Fig.6 The expression of AQP-2 in collecting ducts was strong at N7 d Immunohistochemistry staining×650
2.4 體視學測量
對TUNEL染色陽性的細胞進行凋亡指數測量,結果顯示N1 d,集合管中細胞凋亡指數為(32.46±3.69)%,到N7 d達到高峰,細胞凋亡指數為(45.36±4.35)%,以后隨著日齡增加凋亡細胞逐漸減少。面密度值測量結果顯示,AQP-2從E17 d的胎鼠開始表達,至N7 d其表達量達最高峰,N7 d至N40 d,AQP-2的面密度值與前一時間點測量值比較無統計學差異(表1)。

表1 小鼠腎集合管不同發育階段細胞凋亡指數以及AQP-2在集合管表達的面密度值(x±s)Tab.1 The apoptosis index and surface area density of AQP-2 in the collecting ducts during development(x±s)
3 討論
細胞凋亡是機體為了維持內環境的穩定,由基因控制的一種自主有序的生理性死亡[3]。在組織、器官的發育過程中,細胞凋亡具有控制細胞數量,消除多余、衰老、異常細胞的作用[4]。凋亡的形態學特征之一是水的流失和細胞體積縮小,細胞體積的縮小會改變細胞內外的滲透梯度,使水通過單純擴散和借助水通道蛋白(如AQP-2)流出細胞,繼之啟動細胞凋亡過程[5,6]。
TUNEL是目前比較常用的探討細胞凋亡的形態學手段,本研究結果顯示,在N1 d的小鼠腎集合管中可見TUNEL陽性細胞,N7 d陽性細胞染色最強,凋亡指數最高,N7 d至N40 d凋亡細胞數量逐漸減少。這表明集合管在N1 d至N7 d是發育的主要階段,雖然細胞數量已夠,但是集合管需要通過細胞凋亡來不斷清除因增生而過剩的細胞,以利于管腔的形成及調控自身的發育速度。N7 d至N40 d,生長和成熟是集合管的主要特點,此期的集合管不再分支,進入發育完善時期[7]。為了鑒別TUNEL陽性細胞是否由于細胞自身分裂形成,本研究應用電鏡技術觀察了集合管中的細胞凋亡現象,結果與TUNEL染色一致。本研究結果顯示AQP-2在E17 d時開始出現表達,部位是集合管主細胞的管腔膜和細胞胞質內,至N7 d表達強度最強,隨后表達強度無明顯改變。對在主細胞管腔膜表達的AQP-2進行的面密度值測量顯示AQP-2表達的面密度值在N7 d達到最大值,之后無明顯變化。這些結果提示在集合管發育過程中,細胞凋亡與AQP-2有一定的相關性。Ma等[8]發現過度表達AQP-2促進細胞體積的縮小和凋亡過程的啟動。Jablonski等[9]也證實在細胞凋亡過程中,過度表達的AQP-2失去活性,喪失對水的轉運能力,使細胞內的離子環境有利于激活caspase等內切酶,進而啟動細胞凋亡,證實了AQP-2與細胞凋亡關系密切,與前人的結果相一致[10,11]。本研究認為N1 d至N7 d是集合管快速發育的時期,此期集合管的細胞數量已足夠其生長需要,為了適應自身的形態變化及有利于管腔的形成,需要以凋亡的形式來清除過剩的細胞。AQP-2的表達與此過程一致,即N1 d表達較強,至N7d達到最高峰,因此,我們推測小鼠腎集合管N1 d至N7 d快速發育期的細胞凋亡是由AQP-2介導的,AQP-2影響集合管的發育過程,關于此過程的分子機制還有待于進一步研究。
[1]Gumbiner BM.Cell adhesion:the molecular basis of tissue architectureand morphogenesis[J].Cell,1996,84(3):345-357.
[2]鞠曉靜,朱振龍,魏守禮.水通道蛋白對凋亡的影響[J].河北醫科大學學報,2008,29(1):118-120.
[3]Wyllie AH,Kerr JF,Currie AR.Cell death:thesignificanceof apoptosis[J].Int Revcytol,1980,68(6):251-306.
[4]Fierlbeck W,Liu A,Coyle R,et al.Endothelial cell apoptosis during glomerular capillary lumen formation in vivo[J].Soc Nephrol,2003,14(5):1349-1354.
[5]劉美菊,孫愛剛,郭敏.水通道蛋白-2、4在小鼠集合管發生發育中的表達[J].解剖學報,2006,37(5):588-591.
[6]Agre P,Sasaki S,Chrispeels MJ.Aquaporins:a family of water channel proteins[J].Physiol,1993,265(2):463-476.
[7]朱平,姜敘誠.人胚胎腎小體和腎小管的發育[J].解剖學報,1995,26(4):414.
[8]Ma T,Yang B,Verkman AS.Cloningof anovel water and ureapermeable aquaporin from mouse exprssed strongly in colon,placenta,liver,and heart[J].Biochem Biophys Res Commun,1997,240(2):324-328.
[9]Jablonski EM,Hughes FM.The potential role of caveolin-1 in inhibition of aquaporinsduringthe AVD[J].Biol Cell,2006,98(1):33-42.
[10]Flamenco P,Galizia L,Rivarola V,et al.Roll of AQP2 during apoptosisin cortical collectingduct cells[J].Biol Cell,2009,101(40):237-250.
[11]Rivarola V,Flamenco P,Melamud L,et al.Adaptation to alkalosis ind-uces cell cycledelay and apoptosis in cortical collecting cells:roleof Aquaporin-2[J].Cell Physicol,2010,224(20):405-413.

