聚乳酸靜電紡絲生物可降解材料的表面特征研究
孫樹東,徐 峰,齊 欣,劉建國
(1.吉林大學第二臨床醫院骨科,吉林長春130041;2.吉林大學第一臨床醫院骨關節科)
聚乳酸因為無毒性、細胞相容性和可降解性[1]成為最早作為骨、軟骨組織工程的支架材料,也是目前運用最為廣泛的骨組織工程材料[2],但由于其生物活性較差,限制了其在醫學生物材料方面的應用。本文嘗試通過靜電紡絲這種方法對聚乳酸材料進行改性,探討改性后材料的表面特征,并進一步探討通過靜電紡絲導致材料表面、空間結構的變化對材料的親水性和降解速度的影響。
1 材料與方法
1.1 主要的試劑和儀器
直流電高壓發生器(北京);電紡絲接受器;超聲粉碎儀(BS14-UH武漢);高分子材料接觸角測定儀(德國Dataphysics);掃描電鏡(JSM-6700F)(以上儀器由吉林大學高分子實驗室);收集紡絲載體為1 cm×1 cm大小的載玻片(自己制作);表面活性劑(C20 H37O7SNa);二氯甲烷;聚乳酸(PLA)(吉林大學高分子實驗室提供)
1.2 三種濃度聚乳酸(PLA)電紡構建具有超微結構生物材料
分別將濃度為6%、8%和10%PLA,在最佳的電紡條件[3]下進行電紡,將不同大小的硅片至于鋁箔之上,將聚乳酸電紡絲收集并通過掃描電鏡觀察形態。戊二醛交聯后備用。
1.3 三種濃度PLA電紡材料的表面形態觀察和分析
通過光鏡觀察,粗略觀察電紡絲直徑,形成的電紡絲膜情況。選擇液滴較少的樣本進行掃描電鏡觀察后,通過圖像軟件測量各種樣本的直徑。通過下述公式計算支架的密度和孔隙率。支架密度計算公式(g/cm3)=電紡材料質量(mg)÷(支架的厚度μ m×面積cm2);支架的孔隙率(%)=(1-支架密度(g/cm3))÷聚乳酸密度(g/cm3));聚乳酸的密度(Mr=300 000)=289.5 mg/cm3(計算)。
1.4 三種濃度PLA生物材料接觸角測量
將待測支架樣本放在試樣臺上。3 μ l的蒸餾水噴射在支架樣本上,使液體成液滴狀懸垂在支架樣本上。調準顯微鏡焦距,拍攝下液滴懸垂在支架表面的照片,通過計算機內程序計算出材料表面的接觸角。每個樣本取3組數據。
1.5 三種濃度PLA生物材料的降解率測定
①將無電紡絲支架的玻璃片載體(1 cm×1 cm)稱重(W);②將8%的聚乳酸在其最佳電紡條件下電紡2 h,用上述的玻璃片載體收集,戊二醛交聯,制備18個樣本;③將普通的8%聚乳酸溶液在玻璃片載體上涂片后戊二醛交聯,制備18個樣本;④將上述樣本低壓干燥后稱重(W0);⑤將上述的2組樣本經過紫外線中照射30min后,將樣本孵育在37攝氏度PBS(溶液中1M,PH7.2)一周一換;⑥分別在 1、2、3周更換PBS溶液時,每組取出6個樣本經過蒸餾水沖洗后三次 ,低壓干燥稱重(Wt、t=1、2、3w);⑦用重量丟失率表示材料的降解率D=[(W0-W)-(Wt-W)]/(W0-W)。
1.6 所有數據采用SPSS 13.0統計軟件分析
2 實驗結果
2.1 三種濃度PLA電紡材料在掃描電鏡和光鏡下觀察電紡結果
10%、8%、6%三種濃度的聚乳酸溶液都在相應的電紡條件下紡出電紡絲,電紡絲的直徑和濃度成反比。10%濃度的PLA電紡絲直徑最大,6%濃度的PLA電紡絲直徑最小。8%濃度的PLA電紡絲直徑較均勻,且表現出其特有的表面特征。
2.2 不同濃度的PLA靜電紡絲的支架的參數
將采集的掃描電鏡圖片經過圖像分析軟件測定其平均直徑、薄膜的厚度、用公式計算出相應的支架密度和孔隙率,得出在相同的電紡條件下,聚乳酸濃度對電紡支架纖維直徑、支架密度和孔隙率的影響,見表1。
通過組與組間T檢驗結果為:電紡材料的濃度對纖維直徑和支架密度影響有顯著的統計學差異:10%PLA>8%PLA>6%PLA(P<0.01);對支架材料的孔隙率影響有顯著的統計學差異:10%PLA<8%PLA<6%PLA(P<0.01)。
2.3 兩種聚乳酸材料接觸角測量結果
電紡聚乳酸接觸角小于相對應的普通材料組(t檢驗,P<0.01)。見表2。
表1 不同濃度的PLA電紡支架的參數(±s,n=6)
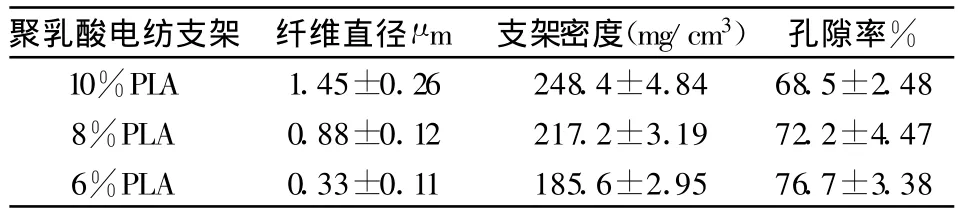
表1 不同濃度的PLA電紡支架的參數(±s,n=6)
?
表2 兩種材料的接觸角測量(±s,n=8)

表2 兩種材料的接觸角測量(±s,n=8)
1 2 3 4 5 6 7 8 ±s普通聚乳酸 82.2 79.8 79.5 88.9 87.0 85.1 89.1 83.3 84.36±1.34電紡聚乳酸 78.7 64.2 76.4 67.5 78.1 66.9 76.5 69.1 72.18±2.06
2.4 兩種材料降解率的測定
電紡聚乳酸的降解速度在1 W、2 W、3 W要低于普通聚乳酸的降解速度(P<0.01),尤其以第三周的降解速度進一步降低。見表3。
表3 不同支架在1W、2W、3W的重量(mg)丟失的測定(±s,n=6)

表3 不同支架在1W、2W、3W的重量(mg)丟失的測定(±s,n=6)
樣本降解率% 1 W 2 W 3 W PLA 0.60±0.01 1.47±0.01 2.22±0.03 PLA 電紡 0.54±0.01 1.40±0.01 1.96±0.02
3 討論
最近的研究表明天然的骨基質是一種復雜納米、微米結構的、三維立體多孔的細胞支持體[2],骨微結構的明確指明了骨組織工程材料設計發展的方向。骨組織工程構建理想生物材料的有效方法之一是仿生天然骨基質結構[4],為細胞粘附、增殖和分化提供最佳的環境。在天然的骨基質中結構特征方面是納米、微米級結構,并且細胞的分化和功能高度的依賴這種微結構[5]。聚合物及其混合物的納米、微米結構多孔材料被認為是生物工程中最前沿的生物材料應用在骨組織工程[6]。近10年來,靜電紡絲被認為是一種將聚合物和無機物制作成具有高面積體積比和高孔隙率的纖維材料的簡單、有效的方法[4],并適合多種聚合物[7]。更進一步的說,通過靜電紡絲構建的絲狀基質材料具有仿生天然骨基質納米、微米、多孔隙的形態學特征等特點。
聚乳酸(PLA)是目前運用最為廣泛的骨組織工程材料[2],已經成為電紡的熱門材料。本研究成功的應用靜電紡絲這種簡單、有效的方法,將生物活性較差的普通聚乳酸材料構建成仿生天然骨基質膠原纖維空間結構的新型生物材料,該組材料在空間結構上由微米級的聚乳酸纖維不規則排列構成,材料內部空間具有相會貫通的微米級空隙,可以為細胞、營養液的遷移提供通道。聚乳酸的濃度對聚乳酸纖維的直徑、支架的密度和材料的孔隙率均有影響:聚乳酸電紡絲的直徑和支架密度與溶液的濃度成正比關系;PLA靜電紡絲支架的孔隙率和電紡液的濃度成反比。其中8%聚乳酸電紡支架的纖維直徑、空隙較其他兩種濃度的材料均勻,0.88±0.12微米的纖維直徑和72%的孔隙率也較接近天然松質骨的纖維直徑和孔隙率80%[8],可以說我們的試驗實現了一部分天然骨基質結構仿生的關鍵。
另外,接觸角的測定是評估生物材料表面能和親水性的常用方法[9],而材料的表面能和親水性是影響和控制蛋白質和細胞與材料相互作用的重要因素,二者能夠影響蛋白的吸收和材料表面蛋白的結構重排[10],因此一直以來是生物材料科學領域內備受關注的課題。接觸角測量的結果看兩種材料的接觸角均<90°,從材料的親水和疏水的區分來看,所有的材料均屬于親水材料。通過我們對兩種材料接觸角的測量,電紡后聚乳酸材料的接觸角明顯小于普通聚乳酸,說明經過靜電紡絲可以明顯改善材料的親水性,為材料表面的改性提出新的思路。
骨組織工程對材料的要求要有一定的強度和體內存留的時間,來保證新生骨達到強度以前對骨的負重,因此材料的降解速度是影響材料生物材料應用的重要因素。本實驗研究表明電紡后的聚乳酸可以明顯降低材料的降解速度,為提高其他因降解速度過快而影響支架強度的材料改性提供新的契機。
[1]Dedai L.Synthesis,characterization and properties ofbiodegradable polylacticacid-b-cyclodextrin cross-linked copolymermicrogels[J].EuropeanPolymer Journal,2008,44:2140.
[2]Shieh S,Vacanti J.State of the art tissue engineer:From tissue engineer to organ building[J].Surgery,2005,137(1):1.
[3]徐 峰,齊 欣,劉建國.聚乳酸電紡構建仿生骨基質結構生物降解材料的體外細胞毒理研究[J].中國老年學雜志,2009,29(1):68.
[4]Joerg K,AchimM.Matrices and scaffolds for protein delivery in tissue engineering[J].Advanced Drug Delivery Reviews,2007,59(4-5):274.
[5]Liu X,Laura A.Biomimetic nanofibrous gelatin/apatite composite scaffolds for bone tissue engineering[J].Biomaterials,2009,30(12):2252.
[6]Oliva A,Salerno A,Locardi B,et al.Behaviour of human osteoblasts cultured on bioactive glass coatings[J].Biomaterials,1998,19(11-12):1019.
[7]Silveira.Harvest and characterization of mesenchymal canine stem cells fromadipose tissue and bone marrow[J].Veterinary Immunology and Immunopathology,2009(128):211.
[8]Zhong S,Teo W E,Zhu X,et al.An aligned nanofibrous collagen scaffoldby electrospinning and its effects on in vitro fibroblast culture[J].Journal of Biomedical Materials Research Part A,2006,79A(3):456.
[9]Lam C,Wu R,et al.Study of the advancing and receding contactangles:liquid sorption as a cause of contactangle hysteresis[J].Advances in Colloid and Interface Science,2002,96(1-3):169.
[10]Anselme K.Osteoblast adhesion on biomaterials[J].Biomaterials,2000,21(7):667.

