六水鋁酸三鈣(C3AH6)與CO2反應的研究
劉 偉,張海寶,周秋生,彭志宏,齊天貴,李小斌,劉桂華
(中南大學 冶金科學與工程學院,湖南 長沙,410083)
水合鋁酸鈣是堿法處理一水硬鋁石型鋁土礦生產氧化鋁過程中的一種重要化合物,很容易在氧化鋁生產的各個階段生成[1-3]。在拜耳法和燒結法產生的赤泥以及鈣硅渣中都含有大量的水合鋁酸鈣,造成氧化鋁含量減少。3CaO·Al2O3·6H2O(C3AH6)是眾多水合鋁酸鈣中最主要的一種,同時也是形成水化石榴石的中間產物,與水化石榴石的化學性質相似[4]。因此,從C3AH6中回收氧化鋁不僅可以減少氧化鋁含量損失,而且可以優化水化石榴石的處理工藝。目前,C3AH6的處理方法主要有酸法和堿法[5-9]。酸法一般用HCl,H2SO4和 HNO3等強酸處理 C3AH6,使其中氧化鋁以Al3+的形式進入溶液中,但難以與堿法生產氧化鋁工藝相結合。堿法包括苛性堿溶出和碳酸鈉溶出,使C3AH6中氧化鋁以Al(OH)4-形式進入溶液。從Na2OCaO-Al2O3-H2O系平衡狀態圖可知,C3AH6僅在溫度高于200 ℃和較高苛性堿濃度下才能與堿反應,反應條件苛刻[1];碳酸鈉與C3AH6的反應受內擴散控制[7],且在實際生產中為可逆反應[8],導致后期反應緩慢,氧化鋁也不能完全被回收。除酸法和堿法外,Smith等[10]用 CO2處理主要含 C3AH6的堿性泥漿,得到CaCO3和無定形Al(OH)3,但是,對CO2與C3AH6反應機理沒有具體說明。為此,本文作者提出在水中用CO2處理實驗室合成的 C3AH6,試圖生成 Al(OH)3和CaCO3,再用稀堿液溶出 Al(OH)3,使之與 CaCO3分離,從而實現C3AH6中氧化鋁的回收。
1 熱力學分析
C3AH6為堿性物質,CO2為酸性氧化物,兩者之間可能發生如下反應:
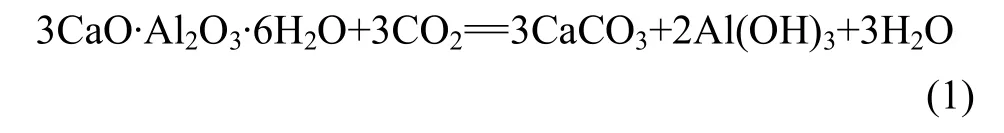
利用有關熱力學計算方法[11]與數據[12]計算反應(1)中的標準吉布斯自由能隨溫度的變化,結果如圖1所示。研究表明:在常壓和較大溫度范圍內,C3AH6能夠與 CO2發生反應,生成 CaCO3,Al(OH)3和H2O。
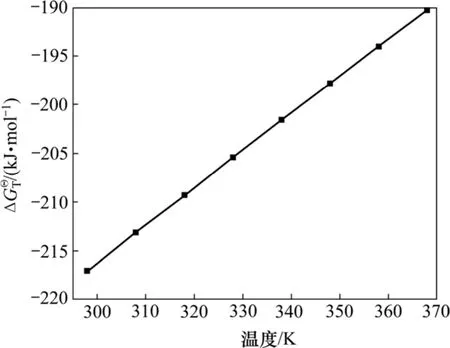
圖1 C3AH6與CO2反應的標準吉布斯自由能隨溫度的變化Fig.1 Relationship between Gibbs free energy change of reaction of C3AH6 and CO2 and temperature
2 實驗
2.1 實驗原料制備
2.1.1 C3AH6制備方法
用工業級NaOH和Al(OH)3配置成Na2O質量濃度為175 g/L,Na2O與Al2O3的物質的量比αk為1.78的鋁酸鈉溶液;用分析純Ca(OH)2在850 ℃煅燒2 h制得CaO。然后,將CaO與上述鋁酸鈉溶液在95 ℃時反應3 h,過濾,所得濾餅經洗滌烘干后研磨,粒度為46 μm。CO2為工業鋼瓶裝液體CO2。
2.1.2 實驗儀器與實驗方法
實驗儀器為:X線衍射儀(德國布魯克AXS有限公司制造);PHS-25C酸度計(上海理達儀器廠制造);LZB-6型玻璃轉子流量計(浙江余姚儀表廠制造);O2/CO2氣體濃度測定儀(上海嘉定學聯儀表廠制造);DY-8群釜低壓裝置(中南大學機械廠制造);空氣壓縮機(江蘇鹽城力霸通用機械有限公司制造)。
實驗方法:據圖2所示實驗流程,將反應器置于恒溫水浴槽中,液體CO2通過減壓閥經玻璃轉子流量計或與空氣混合后通入反應裝置底部,控制氣體流量使固體顆粒在溶液中呈懸浮狀態。用產物中 Al(OH)3折算成 Al2O3的質量與反應物中 Al2O3的質量的比值表示反應進度。產物中 Al2O3的質量用反應產物在Na2Ok質量濃度為19.05 g/L、溫度為80 ℃的氫氧化鈉溶液中溶出60 min時所溶出的Al2O3質量表示。
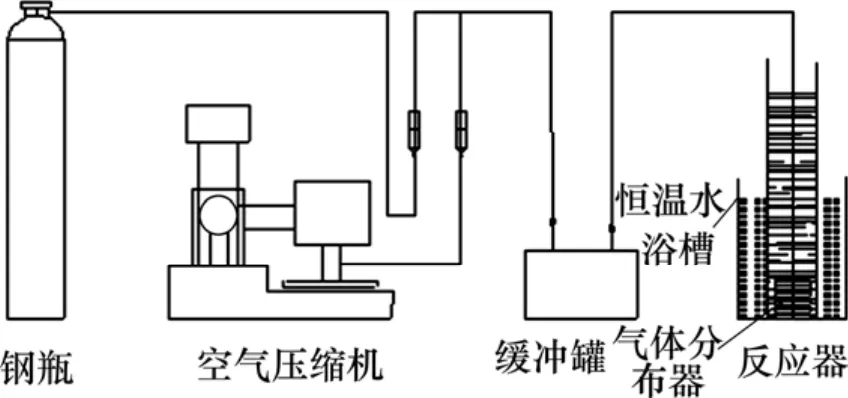
圖2 實驗流程示意圖Fig.2 Experimental flow chart
2.1.3 分析方法
用容量法[13]測定溶出液中氧化鋁的質量濃度。
3 結果與討論
3.1 溫度與時間對反應的影響
當 CO2體積分數為 100%時,分別在不同溫度下研究C3AH6與CO2在水中的反應,結果見圖3。從圖3可見:升高溫度能顯著提高C3AH6的反應率。從動力學角度講,溫度升高可使反應較易沖破反應能壘,提高反應速率。但溫度升高又不能無限制地提高反應速率,本實驗中溫度每升高10 ℃所引起的C3AH6反應率的增加值相應遞減,在65 ℃與75 ℃時C3AH6的反應率已相差很小。在反應前期,各溫度下C3AH6的反應率隨反應時間增加明顯;而反應進行10 min后,各溫度下C3AH6的反應率增長緩慢。這可能是由于生成的CaCO3和Al(OH)3包裹在未反應的C3AH6周圍,減慢了C3AH6與CO2的反應速率。
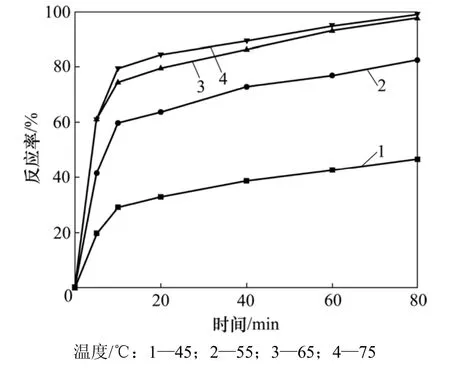
圖3 溫度與時間對C3AH6與CO2反應的影響Fig.3 Influence of temperature and time on reaction rate of C3AH6 and CO2
3.2 CO2體積分數對反應的影響
從質量作用定律來看,反應物的體積分數是影響反應速率的主要因素,通過改變反應物體積分數可以改變反應速率。本實驗測定不同體積分數CO2在水中與C3AH6的反應速率,實驗結果見表1。
從表1可見:C3AH6的反應率隨CO2體積分數的升高而增大;當CO2體積分數從8.40%增加到42.50%時,C3AH6的反應率增長很快;當 CO2體積分數從42.50%增加到 100.00%時,C3AH6的反應率增長趨勢變慢,而且隨著反應時間的延長,反應速率差值變小,在反應80 min后,CO2體積分數為42.50%和100.00%時C3AH6的反應率幾乎相等。這是因為在CO2體積分數較低時,CO2體積分數可能是限制反應速率的主要因素,所以,提高 CO2體積分數可明顯增大 C3AH6反應率;但當CO2體積分數提高到可以消除其對反應速率的限制時,再提高CO2體積分數對反應率的影響將會變小甚至影響不大。
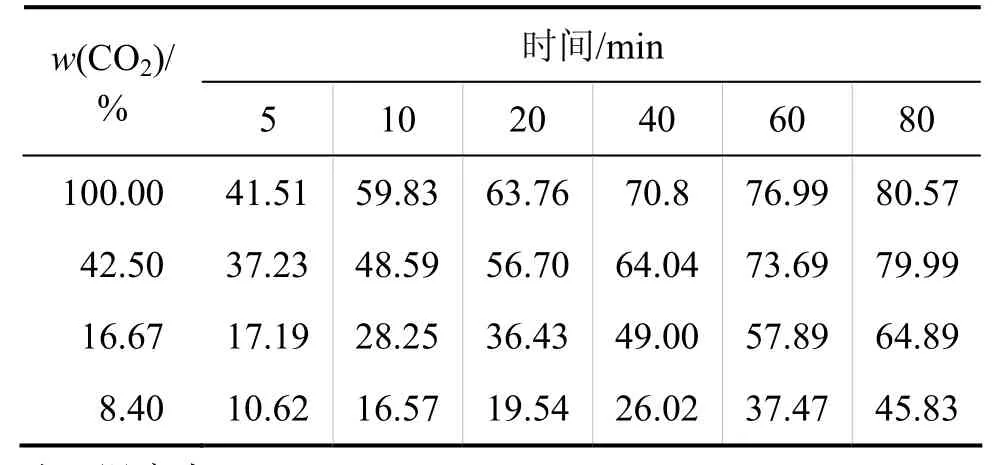
表1 CO2體積分數對C3AH6反應率的影響Table1 Influence of CO2 content on reaction rate of C3AH6 and CO2 %
3.3 渣相分析
圖4所示為C3AH6及其在溫度為75 ℃,CO2體積分數為100%條件下與CO2反應80 min后所得固體產物的X線衍射譜圖。從圖4可見:反應后固相產物的X線衍射譜圖(圖4(b))與反應前C3AH6的X線衍射譜圖(圖4(a))相比變化明顯;反應后固體產物中出現了CaCO3和Al(OH)3的特征衍射峰,并且C3AH6特征衍射峰消失,表明C3AH6在水中與CO2能夠發生反應并且反應能充分進行,固相產物為CaCO3和Al(OH)3。與標準Al(OH)3衍射圖譜相比,產物中 Al(OH)3的峰強較弱而半高寬較大,故認為其結晶不完善。

圖4 C3AH6及其與CO2反應后固相產物的X線衍射譜Fig.4 XRD patterns of C3AH6 and reaction product of C3AH6 and CO2
3.4 C3AH6在水中與CO2反應的機理
將C3AH6分別置于空氣、乙醇和水中與CO2氣體反應,3種介質對C3AH6與CO2反應速率的影響如表2所示。

表2 不同反應介質對C3AH6與CO2反應速率的影響Table2 Influence of different reaction mediums on reaction rate of C3AH6 and CO2
從表2可見:以空氣、乙醇為反應介質時,C3AH6與CO2的反應速率十分緩慢,在實驗條件下幾乎不反應;而以水為反應介質時,C3AH6與CO2幾乎能完全反應。這是因為以空氣為反應介質時,C3AH6與CO2的反應為氣固反應,發生的是分子與分子之間的作用,故在實驗條件下反應速率十分緩慢;以乙醇溶液為反應介質時,由于乙醇的介電常數較小,既不能使C3AH6水化,也不能與CO2反應形成H2CO3,C3AH6與CO2的反應還是分子與分子之間的作用,所以,反應速率在實驗條件下也十分緩慢;而水具有很大的介電常數,為強極性溶劑,不但可以使C3AH6水化[14],而且可以與CO2反應形成H2CO3,C3AH6水化和H2CO3電離的結果使C3AH6與CO2之間分子與分子的作用變為水溶液中眾多離子之間的作用,由此促使 C3AH6與 CO2的反應速率增大。
根據C3AH6的水化作用和H2CO3的電離作用并結合反應過程中水溶液pH隨反應時間的變化(圖5),推測反應過程中存在以下2種主要反應方式。
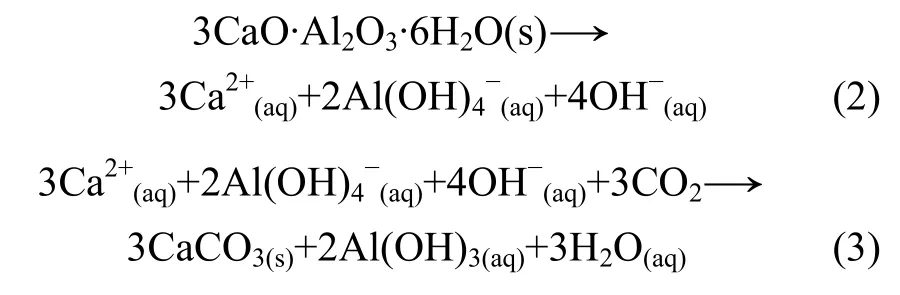
方式1:C3AH6的水化促進反應的發生。C3AH6在水中電離出,OH-和 Ca2+,使反應前期水溶液顯堿性[15];然后,CO2與上述離子反應生成 CaCO3,Al(OH)3和 H2O。熱力學計算結果表明:反應(3)的標準吉布斯自由能在298~373 K時小于-300 kJ/mol,該反應可能發生。
方式2:H2CO3電離促進反應的發生。
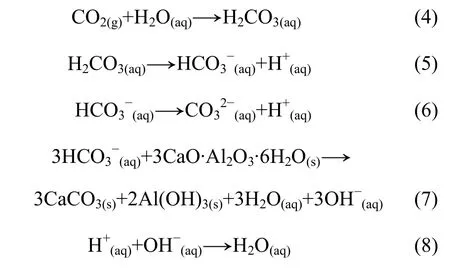
水與CO2形成H2CO3后發生一、二級電離反應,由于一次電離平衡常數遠大于二次電離平衡常數,所以,反應(6)及其反應(6)生成的和H+在此忽略不計。反應(5)電離出的與C3AH6反應生成CaCO3,Al(OH)3和OH-,OH-再與反應(5)電離出的H+發生中和反應。熱力學計算結果表明:反應(7)的標準吉布斯自由能在298~373 K時都為-100 kJ/mol左右,該反應亦可發生。
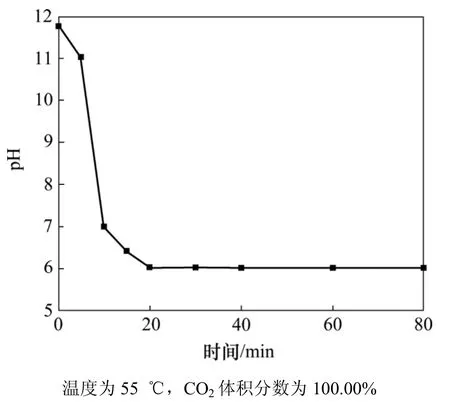
圖5 水溶液pH隨反應時間的變化Fig.5 pH variation of aqueous solution with reaction time
4 結論
(1) C3AH6固體與 CO2氣體直接發生反應的速率非常緩慢,而C3AH6在水中的水化與H2CO3的電離使C3AH6與CO2之間分子與分子的作用變為水溶液中眾多離子之間的作用,促進了C3AH6與CO2的反應速率,生成CaCO3、結晶不完善的Al(OH)3和H2O。
(2) 提高反應溫度、CO2濃度以及延長反應時間均能提高C3AH6在水中與CO2的反應速率。
(3) C3AH6在水中與CO2反應存在2種反應方式。在反應初期,由于C3AH6的水化產生大量的,OH-和 Ca2+, CO2再與這些離子發生反應生成最終產物;隨著反應的進行,溶液pH降低,,OH-和Ca2+含量變小,而此時H2CO3電離出大量,再與C3AH6發生反應生成最終產物。
[1] 楊重愚. 氧化鋁生產工藝學[M]. 北京: 冶金工業出版社,1993: 65-67.
YANG Zhong-yu. Technology of alumina production[M].Beijing: Metallurgical Industry Press, 1993: 65-67.
[2] 阿布拉莫夫V J. 堿法綜合處理含鋁原料的物理化學原理[M].長沙: 中南工業大學出版社, 1988: 32-36.
Abramov V J. The physical chemistry principle about comprehensive basic process for mineral containing aluminum[M]. Changsha: Central South University of Technology Press, 1988: 32-36.
[3] Xu B A, Giles D E, Ritchie I M. Reactions of lime with aluminate containing solutions[J]. Hydrometallurgy, 1997,44(1/2): 231-244.
[4] 彭志宏. 鋁酸鈉溶液添加水合碳鋁酸鈣脫硅的研究[D]. 長沙:中南工業大學冶金科學與工程學院, 1993: 15-17.
PENG Zhi-hong. A study of desilication of aluminate solution with HCAC[D]. Changsha: School of Metallurgical Science and Engineering. Central South University of Technology, 1993:15-17.
[5] 劉邦煜, 王寧, 石莉, 等. 工業稀鹽酸和鋁酸鈣制取結晶氯化鋁研究[J]. 地球與環境, 2008, 36(3): 226-229.
LIU Bang-yu, WANG Ning, SHI Li, et al. Study on the preparation of crystalline aluminum chloride from industrial dilute acid and calcium aluminate[J]. Earth and Environment,2008, 36(3): 226-229.
[6] Eremin N I, Durandina M S. Interaction of 12CaO·7Al2O3with sodium carbonate solutions[J]. Zh Prikl Khim, 1969, 42(12):2663-2668.
[7] 佟志芳, 畢詩文, 李慧莉, 等. 高爐鋁酸鈣爐渣浸出過程動力學[J]. 過程工程學報, 2005, 5(4): 399-402.
TONG Zhi-fang, BI Shi-wen, LI Hui-li, et al. Leaching kinetics of calcium aluminate slag[J]. The Chinese Journal of Process Engineering, 2005, 5(4): 399-402.
[8] 仇振琢. 苛化溶出鋁酸鈣[J]. 輕金屬, 1992(4): 18-21.
CHOU Zhen-zhuo. Digestion of calcium aluminate by caustic alkali[J]. Light Metals, 1992(4): 18-21.
[9] 鄺中, 李濤, 楊世干. 含鋁酸鈣的物料提取氧化鋁工藝: 中國,1562756[P]. 2005-01-12.
KUANG Zhong, LI Tao, YANG Shi-gan. A process extracting alumina from materials containing calcium aluminate: CN,1562756[P]. 2005-01-12.
[10] Smith P G, Pennifold R M, Daviess M G. Reactions of carbon dioxide with Tri-calcium aluminate[C]//Hydrometallurgy 2003-Fifth International Conference in Honor of Professor Ion Ritchie. Volume 2: Electromeallurgy and Environmental Hydrometallurgy, 2003: 1705-1715.
[11] Bunah A G. 礦物學中熱力學方法[M]. 北京: 地質出版社,1982: 136-142.Bunah A G. Thermodynamic method for mineral[M]. Beijing:Geology Press, 1982: 136-142.
[12] 李永芳. 氧化鋁生產數據庫的研究與開發[D]. 長沙: 中南大學冶金科學與工程學院, 2001: 47-55.
LI Yong-fang. Thermodynamic database of alumina production[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2001: 47-55.
[13] 李小斌, 張建, 劉桂華, 等. 原硅酸鈣在鋁酸鈉溶液中的反應行為[J]. 中南大學學報: 自然科學版, 2005, 40(2): 275-281.
LI Xiao-bin, ZHANG Jian, LIU Gui-hua, et al. Reactive behaviors of calcium silicate in aluminate solutions[J]. Journal of Central South University: Science and Technology, 2005, 40(2):275-281.
[14] 李以圭, 陸九芳. 電解質溶液理論[M]. 北京: 清華大學出版社, 2005: 110-112.
LI Yi-gui, LU Jiu-fang. Electrolyte solution theory[M]. Beijing:Tsinghua University Press, 2005: 110-112.
[15] 巴布什金V I, 馬特維耶夫 G M. 硅酸鹽熱力學[M]. 蒲新誠,曹建華, 譯. 北京: 中國建筑工業出版社, 1983: 254-262.
Babushkin V I, Matveev G M. Thermodynamics of silicates[M].PU Jian-cheng, CAO Jian-hua, trans. Beijing: China Architecture& Building Press, 1983: 254-262.

