腺病毒介導的鳥氨酸脫羧酶反義RNA對乳腺癌細胞生長侵襲的抑制作用
鄧文勝,萬小衛,盧 軍,孫金娥,馬 榕,劉賢錫,孫學英
(1山東省警官總醫院,濟南250002;2山東大學齊魯醫院;3山東大學醫學院分子生物學實驗中心;4新西蘭奧克蘭大學醫學院分子醫學系)
鳥氨酸脫羧酶(0DC)是多胺生物合成途徑中的關鍵酶和限速酶。據報道,ODC在多種腫瘤細胞中表達增高,與腫瘤轉移、復發有一定關系。2007年1月~2008年4月。我們檢測了ODC基因在乳腺癌MDA-MB-231細胞中的表達并觀察了腺病毒介導的ODC反義RNA(rAd-ODC/Ex3as)對乳腺癌細胞體外增殖的抑制作用。現報告如下。
1 材料與方法
1.1 材料 乳腺癌 MDA-MB-231細胞(以下簡稱乳腺癌細胞)和正常乳腺上皮MCF-10A細胞(以下簡稱正常乳腺細胞)由澳大利亞Monash大學分子生物學實驗室提供;羊抗人ODC多克隆抗體、鼠抗人Pan-actin單克隆抗體購于 Sant Cruz Biotechnology;BCA試劑盒購自碧云天公司;相關試劑分別購自Pierce公司、BD公司。rAd-ODC/Ex3as(以下簡稱反義RNA)和rAd-綠色熒光蛋白(GFP)由山東大學醫學院分子生物學實驗中心包裝完成。
1.2 乳腺癌細胞與正常細胞ODC蛋白表達檢測將兩種細胞株用0.15%的胰酶消化成單個細胞,2 700 r/min離心3min,去上清,加適量 DME/10%FBS重懸,配成5×105個/ml細胞懸液,接種細胞時根據不同細胞系生長速度的不同,分別接種不同的細胞數于直徑10cm的培養皿中。培養48 h后,觀察細胞達到對數生長期,開始收獲細胞,采用Western Blot法檢測。
1.2 細胞干預及相關指標測定 將乳腺癌細胞及正常乳腺細胞分別用0.15%的胰酶消化成單個細胞,2 700 r/min×3min離心,去上清,加適量DME/10%FBS重懸,配成5×105個/ml細胞懸液,接種于直徑10cm的培養皿中培養48 h。取對數生長期細胞按5×103個/孔接種于96孔培養板,于37℃、5%CO2培養箱中培養并24 h并分為三組,每組6個復孔。反義RNA組以50 MOI(=空斑形成單位/細胞數)反義RNA轉染細胞;空載體組以50 MOI的Ad-GFP感染細胞;對照組不干預。處理后24、48、72、96 h 加入 0.5%MTT(5 mg/ml),每孔 20 μl,孵育4 h再加入二甲基亞砜150 μl溶解紫藍色沉淀,觀察以下項目:①細胞增殖抑制率:酶標儀測定各組570 nm波長值,繪制細胞生長曲線。抑制率=(1-實驗組平均A值/對照組平均A值)×100%。②ODC蛋白表達:干預后各組細胞均于DME/10%FBS的培養基中繼續培養,48 h后裂解細胞。采用Western Blot法測定ODC蛋白表達。③細胞周期:細胞干預48 h后胰酶消化,PBS洗滌,加入預冷70%乙醇1 ml,4℃固定12 h;PBS洗滌,加入4 ug RNA酶,室溫保濕30min;加入終濃度為20 μl/ml的碘化丙啶(PI)孵育30min。流式細胞儀檢測細胞周期,計算G0-G1期細胞百分率。④細胞增殖、侵襲能力:各組均行基底膜侵襲試驗,Transwell小室(孔徑8 μm)表面覆蓋終濃度為0.7 mg/ml的基質膠,放入 6孔板中,下層加入 2.6 ml DME/10%FBS。細胞干預24 h后胰酶消化收集細胞,小室上層加入1.5 ml細胞懸液(濃度為5×105個/ml)。Transwell小室于37℃、5%CO2下孵育4 h,用棉簽抹去未穿過的細胞,固定小室底部的細胞并行HE染色。每孔選取5個不同的區域,于200×顯微鏡下計數穿過的細胞數。
1.4 統計學方法 采用SPSS10.0軟件行統計學處理,t檢驗;P≤0.05為差異有統計學意義。
2 結果
2.1 細胞生長抑制率 空載體組細胞生長迅速,反義RNA組細胞生長明顯減慢,細胞生長曲線更趨低平(圖2),細胞增殖最大抑制率為60%。
2.2 ODC蛋白表達 見圖1。
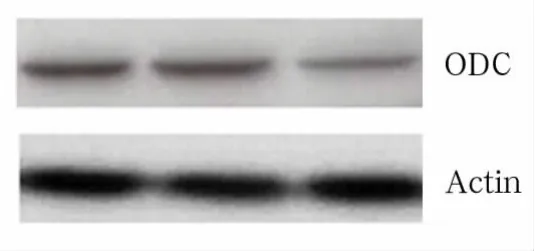
圖1 各組ODC蛋白表達
2.3 細胞周期 干預后48 h反義RNA組細胞周期停止于G1期,G1期細胞比例明顯高于對照組(表1),空載體組與對照組比較差異無統計學意義。
表1 各組細胞周期及穿膜細胞數(n=6,±s)

表1 各組細胞周期及穿膜細胞數(n=6,±s)
注:與對照組比較,*P<0.01;與空載體組及對照組比較,△P<0.01
組別 G0~G1細胞(%) 穿膜細胞(個)空載體組 31.94 ±5.81* 40.20 ±5.86*28.56 ±3.63 45.00 ±3.45反義 RNA組 76.15±5.13*△ 20.97±5.30*△對照組
3 討論
多胺是一類脂質陽離子,包括腐胺、精咪和精胺,鑒于其代謝、攝取和功能可作為腫瘤預防和治療的靶位[1,2],多胺生物合成抑制劑或多胺類似物理論上可阻斷腫瘤細胞生長與轉移 。ODC是多胺合成的關鍵酶,可催化鳥氨酸轉變為腐胺[3],眾多研究表明,多胺/ODC途徑與乳腺癌有密切關系。Mimori等[4]報道,ODC過表達與較年輕女性、腫瘤體積較大及預后較差者有顯著相關性。Glikman等[5]報道,正常乳腺組織和良性乳腺疾病組織中均檢測不到ODC表達,而表達較高水平ODC的惡性乳腺腫瘤細胞則具有較高的細胞質構成、核間變以及較低的組織分化。Kubotas等[6]則認為,ODC過表達不僅與乳腺癌細胞的轉化,而且與其侵襲性有關。本研究結果顯示,乳腺癌細胞ODC基因表達明顯高于正常乳腺細胞,與上述研究結果相符。
反義RNA技術是一種從核酸復制、轉錄和翻譯水平上高度特異性抑制靶基因表達的方法,可選擇性、序列特異性抑制基因表達。其主要包括反義RNA技術和反義寡核苷酸技術,是目前最常用的體細胞基因治療方法之一。腺病毒載體具有體內基因轉移能力,可有效感染非分裂期細胞,并攜帶大量的基因片段;重要的是其攜帶的基因不整合到宿主細胞染色體上,可大大降低由整合而帶來的危險性。腺病毒載體可有效轉染靜息期細胞,因此可將攜帶外源基因的重組腺病毒載體直接注入組織中,原位感染組織細胞;其表達時間較長,通過選擇病毒的分布方式,也可將基因轉移局限在某一靶器官中。
反義RNA是一種能表達ODC第三外顯子反義RNA的重組腺病毒,本研究結果顯示,乳腺癌細胞轉染反義RNA后ODC蛋白表達受抑,生長明顯減慢,提示抑制ODC表達可抑制乳腺癌細胞生長;反義RNA作用后停留于G1期的細胞增多,表明其可使乳腺癌細胞周期阻滯于G1期。其機制可能為反義RNA通過p53非依賴途徑誘導p21過表達,從而抑制 CDK 活性,致使細胞周期阻滯[7~9]。
侵襲和轉移是惡性腫瘤最顯著的特征,是一個多步驟的過程[10],研究證實,ODC活性與間質金屬蛋白酶2、絲裂原活化蛋白激酶活性(Erk磷酸化)有密切關系;抑制 ODC活性可能抑制 MMP-2及MAPK活性從而減慢對IV型膠原的降解,導致細胞侵襲能力降低[11]。本研究反義RNA組穿膜細胞數遠低于對照組,提示下調ODC活性有可能降低癌細胞的侵襲性。
總之,ODC活性升高與乳腺癌發生及侵襲有一定關系,ODC有可能作為一個乳腺癌的獨立預后指標;rAd-ODC能降低ODC蛋白表達從而抑制其活性,使細胞增殖停滯于G1期,并抑制乳腺癌細胞生長和侵襲。本研究為乳腺癌的基因治療研究提供了理論依據。
[1]J?nne J,P?s?o H,Raina A.Polyamines in rapid growth and cancer[J].Biochim Biophys Acta[J].1978,473(3-4):241-293.
[2]Pegg AE.Polyamine metabolism and its importance in neoplastic growth and as a target for chemotherapy[J].Cancer Res,1988,48(4):759-774.
[3]Russell DH.Ornithine decarboxylase:a key regulatory enzyme in normal and neoplastic growth[J].Drug Metab Rev,1985,16(1-2):1-88.
[4]Mimori K,Mori M,Shiraishi T,et al.Expression of ornithine decarboxylase mRNA and c-myc mRNA in breast tumours[J].Int J Oncol,1998,12(3):597-601.
[5]Glikman P,Vegh I,Pollina MA,et al.Levycm.Ornithine decarboxylase activity,prolactin blood levels,and estradiol and progesterone receptors in human breast cancer[J].Cancer,1987,60(9):2237-2243.
[6]Kubota S,Kiyosawa H,Nomura Y,et al.Ornithine decarboxylase overexpression in mouse 10T1/2 fibroblasts:cellular transformation and invasion[J].J Natl Cancer Inst,1997,89(8):533-537.
[7]Hui L,Zheng Y,Yan Y,et al.Mutant p53 in MDA-MB-231 breast cancer cells is stabilized by elevated phospholipase D activity and contributes to survival signals generated by phospholipase D[J].Oncogene,2006,25(55):7305-7310.
[8]Vogelstein B,Kinzler KW.p53 function and dysfunction[J].Cell,1992,70(4):523-526.
[9]El-Deiry WS,Kern SE,Pietenpol JA,et al.Definition of a consensus binding site for p53[J].Nat Genet,1992,1(1):45-49.
[10]Liotta LA.Tumor invasion and metastasis-role of the extracellular matrix:Rhodes Memorial Award Lecture[J].Cancer Res,1986,46(1):1-7.
[11]Takahiro Nemoto,Shunichiro Kubota,Hideyuki Ishida,et al.mitogen-activated protein kinase and matrix metalloproteinase-2 expressions in human colon tumors[J].World J Gastroenterol,2005,11(20):3065-3069.

