固定化微生物技術在大氣惡臭污染物處理中應用研究進展
萬順剛,李桂英,安太成*
1. 中國科學院廣州地球化學研究所有機地球化學國家重點實驗室,廣東 廣州 510640;2. 中國科學院研究生院,北京 100049
隨著經濟和科學技術的進步,在居民的物質和精神生活逐步得到提高的同時,常規污染物如粉塵、二氧化硫和氮氧化物等大氣污染物的控制以及去除已經不能滿足人們對大氣環境質量日益增長的要求,惡臭污染物所導致的環境空氣質量惡化的投訴問題逐漸增加。因此有關工農業生產和生活中排放的惡臭氣體污染物的控制標準以及污染治理技術的研究,正逐步得到重視[1]。通常提到的惡臭污染物(Odor pollutants),在我國惡臭污染物排放標準 GB14554-93中給出了明確的解釋,即一切刺激嗅覺器官引起人們不愉快感覺及損害生活環境的氣味統稱為惡臭,具有惡臭氣味的物質被稱為惡臭污染物。它們主要是通過刺激嗅覺細胞,經神經的傳遞作用而完成氣味的鑒別。由于惡臭污染物具有揮發性的特點,因此惡臭污染主要是通過大氣傳播和擴散,作用于人的嗅覺器官而被感知的一種嗅覺污染。本文主要對惡臭有機污染物的固定化微生物處理技術的應用狀況進行了綜述,并對今后的研究方向和發展前景進行了展望。
1 惡臭有機物的來源、分類和危害
首先農牧業是惡臭污染的一個重要來源,農牧業的生產過程中產生的大量含有機物的各種廢物在微生物的作用下分解,會排放出具有不同惡臭氣味的空氣污染物[2-5],特別是隨著農業生產的發展及農產品加工規模經營不斷擴大,與農業相關的惡臭污染已成為大氣惡臭污染不可忽視的因素。其次,工業生產過程排放的惡臭污染物也是造成惡臭污染的最重要來源之一,這些工廠產生的惡臭污染物主要包括揮發性有機物(VOCs),尤其是揮發性有機硫化合物(Volatile Organic Sulfur Compounds,VOSCs)等[6-8]。再次,城市垃圾處理公共設施也是一個不容忽視的惡臭污染源,垃圾廢物在通過城市垃圾廠、污水處理廠、堆肥廠等的處理過程中,排放出各種惡臭污染物[9-11]。所有這些惡臭污染物會對其周邊的空氣質量產生不良影響,甚至可以通過大氣擴散作用到幾公里以外的居民區。除了上述的惡臭污染來源以外,在工業生產和居民生活中燃燒煤炭,石油,煤氣等燃料也會產生含硫和含氮惡臭污染物以及由于個人生活衛生不潔或者患有某種疾病所導致的惡臭污染,如腋臭和口臭等[12,13]。惡臭污染物作為一類重要的空氣污染物,主要包括烴類、含氧有機物、含硫有機物、含氮有機物以及鹵素及其衍生物等[14,15]。目前,種類繁多的惡臭污染物作為世界環境公害之一,具有自身的獨特污染特點: 具有極低的嗅閾值低(臭味的最低嗅覺濃度)、排放強度大、污染源多、為點源和區域性污染以及以心理影響為主等。表1為部分典型的惡臭污染物的嗅閾值及污染特性。
由于惡臭污染物具有上述獨特的污染特點,不僅會對惡臭污染源附近居住及工作人群的心理及感官產生影響,使人產生不愉快,煩躁和厭惡的情緒,降低工作效率和生活的質量[18],而且嚴重危害呼吸系統、消化系統、血液循環系統以及神經系統,同時有些惡臭污染物還具有干擾人體的內分泌系統,影響機體的代謝活動,甚至具有“三致作用”等[19,20],因此有必要采取適當的技術手段對大氣中的惡臭污染物進行有效去除。
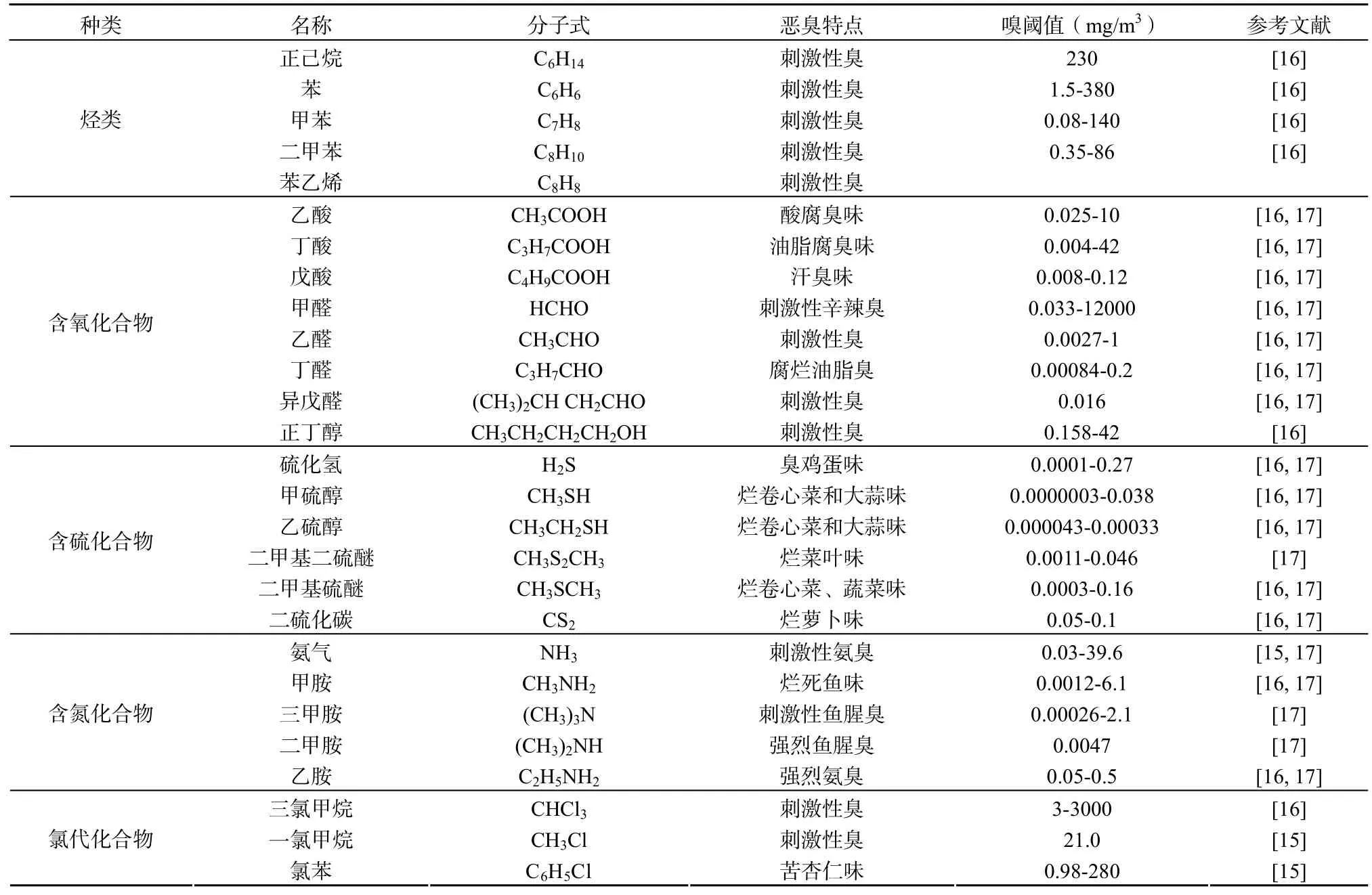
表1 典型惡臭污染物的名稱、分子式、臭味性質、嗅閾值Table 1 The designation, molecular formulas, odor character and threshold of typical odorous pollutants
2 大氣惡臭處理反應器類型及其應用現狀
由于處理惡臭的生物技術種類較多,本文僅針對其中的固定化微生物技術在大氣惡臭處理方面的應用進行介紹。固定化微生物技術是指利用將微生物接種到特定的生物反應器內的載體上,利用微生物自身代謝活動降解惡臭物質,使之降解礦化為CO2和H2O等最終產物,同時微生物利用污染物合成自身所需要的營養物質而進行生長和繁殖,從而達到無臭化、無害化的一種方法[21]。與常規的方法相比,它擁有物理和化學方法所不具有的特點:工藝簡單、操作方便、運行穩定、處理效果好、無二次污染等,同時固定化微生物反應器通常在常溫、常壓下運行,運行時所需要的能耗低也比較低,尤其對于工農業生產過程所排放的大量、低濃度、無回收價值的惡臭污染物治理,固定化微生物技術具有明顯的優勢,具有廣闊的應用前景。常用的能夠應用于大氣惡臭處理的固定化微生物技術主要包括生物過濾池、生物滴濾塔和生物膜反應器等。
2.1 生物過濾池(Biofilter)
生物過濾池是最早用于去除大氣惡臭污染物的一種固定化微生物方法,目前主要用于去除氣液分配系數小于1.0的惡臭污染物廢氣[22]。由于生物過濾池所用的載體通常為含有豐富微生物的土壤、堆肥以及泥炭等天然有機填料,天然有機載體本身能夠為微生物生長提供所需要的營養元素,無需額外添加營養成分。因此,生物過濾池具有結構簡單,投資少、運行費用低等優點。Hartikaine等[23]采用接種泥炭的生物過濾池處理濃度為 14 mg/m3的氨氣,獲得了較好的處理效果,去除能力可達 1.8 g/m3/d。Shah等[24]采用堆肥添加CaO的形式,研究去除養雞場的氨氣,在濃度為27 ppm時,去除率可以達到 97%。生物過濾池可以對 NH3、H2S和VOCs如甲苯等三種混合污染物進行有效降解,最高去除率可以達到100%[25]。同時,Chou和 Shiu[26]采用泥炭作為填料,在泥炭濕度為55-60%,pH在7.5-8.5的條件下,對容積負荷高達160 g/m3/h的甲胺可以有效降解。Tang等[27]采用堆肥和稻殼混合物作為填料,可以對濃度為78~841 ppmv的三乙胺有效降解,最高去除負荷可達140 g/m3/h,但高于140 g/m3/h時,發現底物具有明顯的抑制作用。同國外相比,目前國內開展氣相含氮惡臭有機污染物的研究還比較少,殷俊等[28]、丁穎[29]和胡芳等[30]采用接種堆肥或者活性污泥的生物過濾池對氣相三甲胺的生物降解方面開展了凈化研究工作,去除率可以達到99%以上。但是,生物過濾池在降解有機物時會產生酸性物質,會遇到填料的酸化以及設備腐蝕的問題,因此,需要在操作的過程中對pH進行控制才能更好地發揮其特性[31]。
2.2 生物滴濾塔(Biotrickling filter)
生物滴濾塔是在生物過濾池基礎上進一步工藝改進的固定化微生物技術,不僅適合處理氣液分配系數小于1.0的惡臭污染物,也適合小于0.1的惡臭污染物[22]。這是由于生物滴濾塔所采用的填料載體多為機械強度很高的無機或者有機物質,其本身不含有微生物并且不能為吸附在其表面的生物提供營養元素。因此,生物滴濾塔運行初期一般需要進行微生物接種,同時需要通過連續或者間歇噴淋微生物生長所需要的營養液促進微生物的生長與固定化。與生物過濾池相比,生物滴濾塔具有較高的空隙率和較小的床層壓降。同時通過噴淋循環液進而可以有效控制反應器內微生物的生長環境(如pH、營養物濃度),避免反應產物在床層內的積累。這些改進使生物滴濾塔具有可操控性強等優點。目前已成為近年來固定化微生物技術方面的研究熱點之一。有文獻報道,采用活性炭作為填料,接種活性污泥等菌種,能夠在停留時間為4 s時對濃度為20 ppmv的H2S有效去除,去除率可達98%[32]。甚至有文獻報道在堿性(pH=10)的條件下,接種微生物的滴濾塔在停留時間為1~6 s的條件下,可以對濃度范圍為2.5~18 ppmv的H2S進行有效地去除,去除率高達98%以上[33]。同國外相比,國內采用PVC彈性立體填料的生物滴濾塔研究結果表明,在H2S質量濃度小于1200 mg/m3時的去除率可以達到90%以上[34];黃樹杰[35]采用滴濾塔處理硫化氫濃度為712.80-948.80 mg/m3的效率同樣可以達到90%以上。此外,王京剛和張雅旎[36]采用改進聚乙烯醇法制成的固定化活性污泥顆粒填充生物滴濾塔在流量低于0.1 m3/h時,生物滴濾塔對乙硫醇的凈化效率可達99.9%以上,當高于此流量時去除率明顯降低。
此外,Kalingan等[37]采用接種微生物的泥炭和無機填料的生物滴濾塔,在室溫下處理濃度為200 ppmv的含氨廢氣,去除率高達100%。有文獻報道采用活性炭為填料,接種Paracoccussp.CP2可以對濃度為10~250 ppm的三甲胺(>85%)、二甲胺(>90%)和甲胺(>93%)等三種污染物進行有效去除,而三甲胺的生物降解性最差;而在添加菌種Parthrobactersp.CP1的情況下,三甲胺則可以被完全降解[38]。目前,生物滴濾塔技術也已經應用于甲苯[39,40]、苯乙烯[41,42]、甲醛和甲醇[43]、酚類[44]、酮類[45]以及揮發性脂肪酸[46]等的降解。同時也有文獻報道了生物滴濾塔降解親水性甲醇和非親水化合物蒎烯的混合物[47]以及甲苯和三氯乙烯的混合物等[48]。
2.3 膜生物反應器(Membrane Bioreactor)
膜生物反應器是一類新型的用于廢氣處理的固定化微生物技術,主要是受到新材料的研制開發以及膜生物技術在廢水處理中的成功應用的啟示,人們開始關注膜技術在廢氣處理中的應用。膜生物反應器通常采用致密膜、多孔膜或者微孔材料膜作為載體,其中比較常用的膜為微孔膜[49]。用于接種的微生物在膜載體上生長并形成生物膜或者采取微生物懸浮在營養液中,通過膜的選擇性滲透,污染物通過濃度的梯度擴散作用到達生物膜,并隨后由微生物降解[50,51]。同生物過濾池和滴濾塔相比,在膜生物反應器內由于氣體和生物膜分別位于纖維膜的兩側,因此氣、液流量可分別控制,同時膜生物反應器可清除過量的生物量以防堵塞,并且可以提供一個大的氣液接觸界面提高質量傳遞的速率[51]。目前,膜生物生物反應器已經廣泛用于烷烴等有機物的生物降解,并取得了較好的效果[49,51]。如采用接種Burkholderia vietnamiensisG4的多孔聚丙烯腈和聚二甲基硅氧烷膜作為載體的膜生物反應器可以在停留時間 2-28 s的條件下對濃度0.21-4.1 g/m3的甲苯凈化,去除率可達78-99%[52]。在停留時間為 8-24 s時可以對廢氣中濃度為 38 mg/m3二甲基硫醚進行有效降解,去除率可以達到85-99%[53]。但是總體而言膜生物反應器的缺點是投資高,而且隨著時間的增加,生物膜的活性可能有所下降。因此,同其他的固定微生物技術,如生物過濾池和生物滴濾塔相比,膜生物反應器降解惡臭有機物污染物的研究目前還僅限于實驗室階段,未見有工業應用的報道。
3 固定化微生物技術的主要影響因素
3.1 底物的影響
固定化微生物反應器內都裝載有用于固定微生物的載體填料,在載體表面接種具有降解特定污染物的微生物菌種時,含有惡臭污染物的氣體通過生物反應器內的填料層時,污染物從氣相擴散到載體表面的液相或者生物膜,然后被微生物吸附、吸收和降解[10]。因此底物的物理化學性質將會決定生物反應器處理惡臭污染物的效果。有研究表明,污染物的分子組成會影響底物的可生物降解性,如在苯、甲苯、乙苯和二甲苯這四種物質中,最難降解的是鄰二甲苯,降解率只有30%,其次為苯(45%),最容易降解的甲苯可以得到完全降解[54]。此外也有研究表明,在苯環上引入取代基團或者取代基團種類的增加會導致生物可降解性變差,如苯環上氯原子的數目增加到4個以上或者氯原子和羧基共同存在時[55]。此外,Ho等[38]的研究也表明,空間結構比較復雜的三甲胺的可生化降解性明顯差于二甲胺和甲胺。由于大多惡臭氣體污染物在降解過程主要受制于污染物從氣相到生物膜的擴散速率控制,而對于水溶性好的惡臭污染物則受控于生物膜內微生物的降解速率。因此,醇類比醛類易于降解、酮類比酯類易于降解,但是所有這些化合物都要比長鏈烷烴容易降解,而芳香烴則是最難降解的[56]。所有這些結果都說明降解底物的物理化學性質會影響到其可生物降解性。因此,針對不同的物理化學性質的污染物可以有針對性地選擇合適的固定化微生物反應器進行有效處理。
3.2 微生物的影響
固定化微生物法降解惡臭污染物,主要是利用固定在填料載體表面的微生物將惡臭污染物作為碳源和能源,同時通過新陳代謝活動來降解惡臭污染物。因此,微生物被認為是影響惡臭污染物降解效果的最重要因素。目前已經分離出的大量可以利用典型惡臭有機污染物作為單一碳源和能源而生長的優勢菌種多為細菌,如含硫惡臭有機物降解菌、含氮化合物降解菌以及含氯化合物降解菌等,具體總結如表2所示,這些細菌大多數都屬于桿狀菌、絲狀菌以及球菌等。大量研究表明將這些通過不同手段獲得的微生物作為固定化微生物反應器所用的優勢菌種,就可以針對含有特定目標污染物的廢氣進行有效降解。例如采用固定化單一菌種RG-1的生物滴濾塔可以對含硫惡臭有機氣體污染物進行100%凈化[57],固定化Paracoccussp.CP2的生物反應器可以對含三甲胺(去除率>85%)、二甲胺(去除率>85%)以及甲胺(去除率>85%)氣體污染物進行凈化等[38]。
與細菌相比,真菌具有對干燥、酸性等環境具有更強的適應性,所以真菌也被廣泛用于氣相中惡臭有機物的去除[90],特別是在苯系物的去除方面具有明顯的優勢(表3)。盡管朱國營等[91]對高效降解乙硫醇的生物過濾池中的微生物初步鑒定發現其優勢菌種主要為真菌,但是他們并沒有具體的優勢真菌進行詳細的鑒定。總之,我們也可以看出真菌也是處理惡臭污染物的一個重要生物資源,如何更有效地發揮真菌在固定化微生物技術處理惡臭污染物方面的應用是目前微生物資源研究的一個重要內容。
3.3 填料的影響
對于固定化微生物技術,固定微生物所用的載體是除了微生物菌種以外最重要的因素。固定化載體不但對惡臭污染物具有吸附作用,而且還能夠為微生物的生長提供一個局部生態微環境和保留微生物生長所需要的營養等。由于傳統富含微生物的天然填料如堆肥等在使用過程中容易壓實引起壓降的增加等缺點,并不太適合用于作為固定化微生物所用的載體。因此,目前大多采用機械性能好的有機和無機材質的合成材料作為固定化微生物的載體。表4總結了部分典型的固定化微生物所用的載體材料以及在處理各種惡臭污染物的效果比較。這些填料具有共同的特點,即大比表面積、合適的空隙率以及機械性能好,可以使固定化微生物反應器長期穩定運行,尤其是采用無機填料陶粒作為固定化微生物載體的生物滴濾塔可以長期穩定運行處理含硫惡臭氣體污染物[101]。但是,關于選用什么樣合適的載體用于那種固定化微生物反應器是最適合的,目前還沒有一個比較一致的結論。所有這些都需要開展大量的工程實踐的探索,以及設計加工更加具有通用性能的新型多功能填料才能充分發揮固定化微生物技術在惡臭污染物去除方面的應用優勢。

表2 降解不同惡臭污染物的優勢菌種Table 2 List of microorganisms for degrading representative odors pollutants

表3 降解不同惡臭污染物的優勢真菌Table 3 List of fungus for degrading representative odorous pollutants
3.4 微生物固定化方法的影響
總體而言,處理大氣惡臭污染物的微生物固定化方法與用于廢水處理方面的微生物固定化方法基本上是一樣,其固定化方法均主要包括[115-117]:吸附與附著法、包埋法、共價鍵合法、交聯法和復合固定化法等等。而正是由于微生物的固定化方法及其固定化微生物技術在水處理領域的應用方面已經具有了很多非常不錯的綜述[115-117],因此本文并不想在該部分進行不必要的贅述。
3.5 pH值的影響
固定化微生物最佳降解惡臭污染物的能力一般都在其最佳的pH值范圍(7~8之間)內,即大部分細菌和放線菌的最適宜生長范圍[118]。而對于絕大多數的惡臭污染物在好氧生物降解過程中將會產生酸類物質,如含硫和含氮污染物中的硫元素和氮元素降解的最終產物為H2SO4和HNO3,繼而會使固定化微生物反應器內pH下降,導致微生物自身的活性受到影響,進而影響到對惡臭污染物的去除效果[22]。比如在采用生物滴濾塔降解H2S過程中,當pH從2.0增加到7.0的過程中,雖然生物反應器對H2S的去除率基本都在95%以上,但是去除能力從13.35 g/m3/h增加到31.12 g/m3/h[119]。因此,如果要持續有效地發揮固定化微生物反應器的效率,有必要對固定化微生物反應器內pH進行調控。通常的方法主要是在固定化微生物反應器運行初期的固定化載體中添加固體緩沖物質來調節pH的變化,如在處理易產生酸性物質的惡臭污染物時,添加石灰和白云石可以有效地減緩固定化載體的酸化過程并提高污染物的去除能力[58,120]。當然也可以采用在固定化生物反應器內的循環液中添加適量的堿性或者酸性物質來實現中和反應,使反應器內的環境恢復到微生物生長所需要的適宜pH值范圍。而對于處理不同特性的混合污染物時,如處理NH3和H2S混合惡臭氣體時,H2S降解生成的酸就可以中和NH3引起的pH上升[121],因此就不需要采取額外的措施。
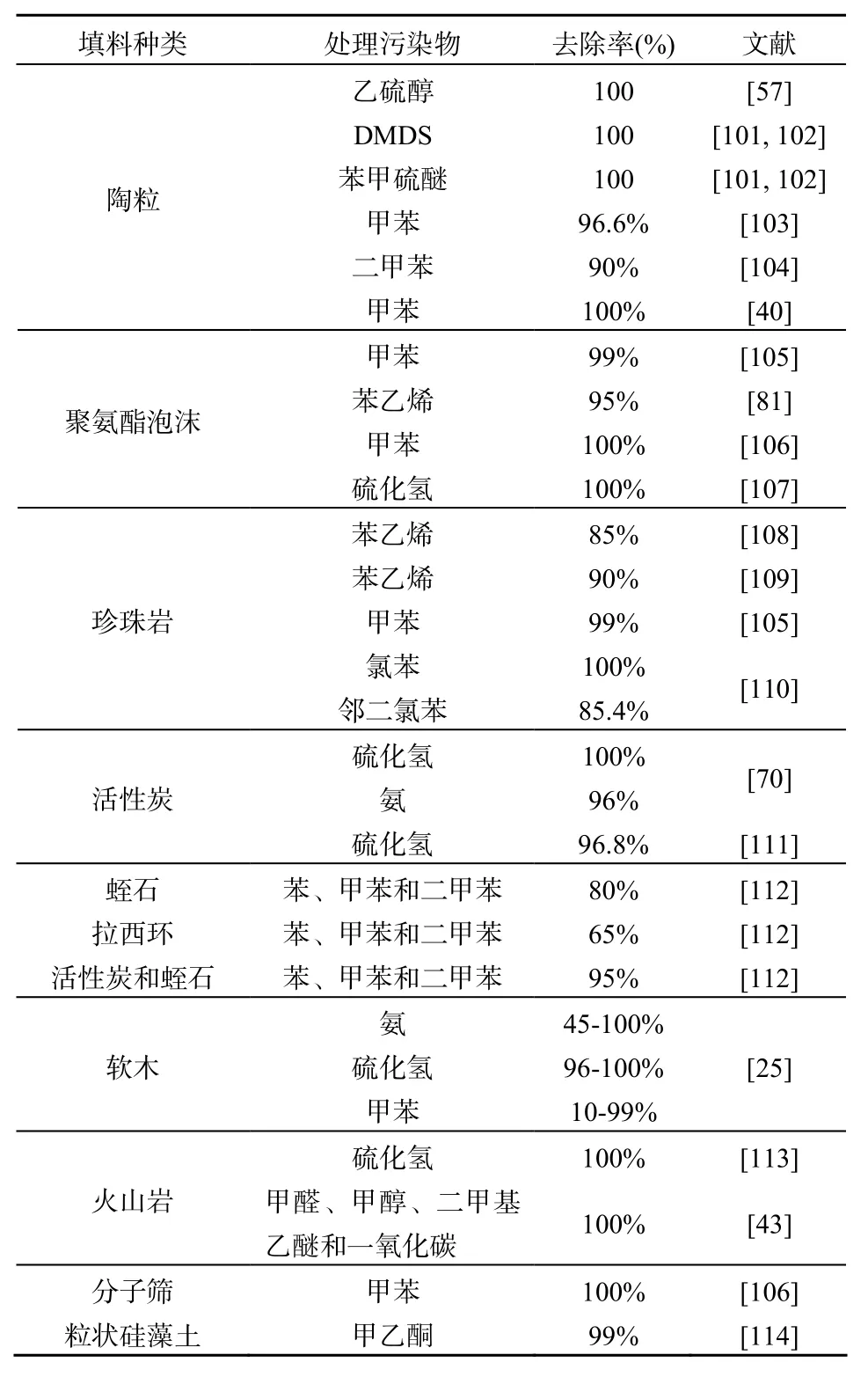
表4 典型降解不同惡臭污染物的填料載體Table 4 List of packing material for degrading representative odorous pollutants
3.6 溫度的影響
環境溫度也是影響固定化微生物反應器性能的重要因素之一,這主要是因為微生物的生長有一定的適宜溫度范圍,絕大多數的微生物的最適宜生長溫度范圍一般在25~35 ℃之間[22,56]。例如降解苯系物中甲苯、苯、乙苯以及二甲苯的最佳溫度范圍就在30~35 ℃之間[77,122]。但是,也有菌種可以在低溫或者高溫條件下能夠對污染物進行有效地降解。如在溫度為2~20 ℃范圍內,通過接種泥炭-土壤或者乙烯氧化菌RD-4的生物反應器均對乙烯具有較好的去除效果[123,124]。以硫化氫和氨氣的混合臭氣為研究對象,在2~8 ℃時,氧化硫桿菌和亞硝化細菌對混合氣體的去除率也可達99%[125]。除此之外,Luvsanjamba等[126]利用嗜高溫(52 ℃)二甲基硫氧化菌種的膜生物反應器處理含有二甲基硫的高溫廢氣,結果表明在停留時間為24 s時,污染物的去除率達到84%,容積去除負荷達到54 g/m3/h。總之,對于固定化生物反應器內的微生物要保持其高效的污染物降解活性,溫度必須控制在其生長的最佳范圍內,而對于實際廢氣溫度過高或者過低,都需要進行預處理,以保證微生物降解污染物的活性。
5 固定化微生物降解惡臭污染物的機理研究進展
大氣中惡臭污染物在固定而化微生物反應器內的去除宏觀上主要是通過底物從氣相中擴散到載體表面的生物膜或者液相進而被所固定化的微生物所降解,然后生成生物質和釋放出CO2等最終代謝產物等[127]。由于氣相污染物的降解首先必須從氣相轉入生物膜或者液相中,因此微觀上固定化生物反應器降解惡臭氣體污染物的途徑和微生物降解液相中同一種污染物的過程基本相同。對于多數惡臭污染物的降解,首先是在母體化合物上引入羥基或者直接脫去某些基團,然后進一步發生系列生化反應而將目標污染物去除。如甲基叔丁基醚在微生物菌種的作用下先生成叔丁氧基甲醇,進一步的生成叔丁基甲酸然后再進一步轉化成叔丁醇,或者叔丁基甲醚可以直接生成叔丁醇。叔丁醇在微生物的作用下進一步降解生成異丙醇以及丙酮等而最終得到完全分解[128]。正己烷在微生物菌種Rhodococcussp. EH831的作用下,首先通過引入羥基生成2-己醇,經2-己酮進一步礦化成丁醛,最后經丙醛、丙酮和乙醛等途徑生成終產物CO2[79]。對于含有苯環結構的物質生物降解機理具有類似的結果,如Ralstonia pickettiiL2降解氯苯過程可以通過兩條途徑完成,首先是在微生物的作用下直接脫去氯原子的同時引入羥基生成鄰苯二酚或者直接依次引入兩個羥基生成鄰氯二苯酚,然后這些中間產物在微生物的作用下經鄰位或者間位開環而降解[89]。Na等[129]采用Rhodococcus opacus菌種降解液相中苯,首先生成鄰苯二酚然后開環而得到降解。同時Liang等[130]采用Delftia tsuruhatensisAD9菌種對苯環含有氨基的化合物苯胺的研究結果也表明,苯胺在液相中的降解首先是通過在苯環上引入兩個羥基生成鄰苯二酚作為第一級降解產物,然后再以鄰位或者間位開環的形式得到進一步的降解。Zhang等[131]研究同樣表明液相中苯胺在微生物的作用下首先生成鄰苯二酚,然后進一步開環后生成最終產物CO2。對于含硫化合物的生物轉化機理和上述的引入羥基不同,如Gonzalez等[132]研究二甲基硫在Proteobacteria的作用下,直接生物降解生成中間產物甲硫醇,然后甲硫醇進一步礦化生成CO2和硫酸根。同樣二甲基亞砜和二甲基二硫醚在微生物的作用下,首先生成一級降解產物甲硫醇,然后進一步被微生物降解生成硫化氫和甲醛,然后硫元素徹底礦化成硫酸根,而碳元素徹底礦化成CO2或生成生物質[133]。而對于非含苯環的含氮化合物如三甲胺等在好氧的條件下首先生成三甲胺氮氧化合物,然后依次生成二甲胺和甲胺,最后進一步礦化成最終產物,而在厭氧的條件下直接依次生成二甲胺和甲胺等代謝產物后被最終降解[71,72]。
6 研究展望
近年來固定化微生物技術在處理大氣惡臭污染物方面顯示了良好的應用前景。固定化微生物技術能夠將大氣中含有的各種有機惡臭污染物經微生物的同化作用和異化作用轉化為CO2、水和生物質,從而消除惡臭污染物對環境的影響。但是在現有的研究基礎上真正實現固定化微生物技術在大氣惡臭污染物處理中的工業化應用,今后還需要加強以下幾個方面的研究工作:
(1)優勢微生物菌劑的培育。盡管目前已經有大量能夠降解惡臭污染物的優勢菌種,但是不同的惡臭底物降解所需要的菌種不同,因此針對不同惡臭污染物的不同特性,需要培養和獲得更多的可用于惡臭污染物降解的優勢菌種,包括能夠適應處理實際環境條件下的低溫和高溫環境中使用的優勢菌種以滿足降解不同種類和不同條件下惡臭有機物的需要,在今后有效實現固定化微生物技術在實際大氣惡臭污染物治理中的應用具有非常重要的研究價值。
(2)固定化載體的開發與改良。如何針對現有天然填料容易坍塌壓實、無機填料比表面積小以及有機合成填料容易堵塞等不足問題,設計開發出更加廉價和穩定的填料載體,以便有利于固定化微生物的吸附和生長的新型多功能填料是實現固定化微生物技術工業化應用的重要研究方向之一。
(3)固定化微生物反應器的構建與優化。如何針對實際不同惡臭污染物的來源和特性,通過固定化載體和優勢微生物的組裝,有針對性地選擇和構建高效固定化微生物反應器,并且系統開展固定化微生物技術在實際大氣惡臭污染物工業應用化中操作參數的優化與篩選,有效縮短惡臭污染物在生物反應器中的停留時間,充分和高效地發揮固定微生物反應器的處理效率也是其工業化應用中非常關鍵的研究內容之一。
(4)固定化微生物技術與其它單元技術的聯用。盡管目前有關固定化微生物技術凈化惡臭污染物的研究也不少,但是固定化微生物技術處理實際惡臭污染物的工業化應用還比較有限,因此如何發揮現有固定微生物技術在處理惡臭污染物中的主導作用,并將其它大氣處理的物理化學單元技術相結合,系統研究組合工藝不同組合方式、不同組合順序等對其聯用的影響,充分發揮各單元技術之間的獨特優勢,以期實現固定化微生物技術在工業實際惡臭污染物治理方面的應用是目前的一個重要研究方向。如果今后能夠在以上幾個方面開展更加系統和有成效的研究,可以預期在不遠的將來固定化微生物技術必然能夠在大氣惡臭污染物的凈化方面發揮更加出色的作用。
[1] 金紫陽, 徐亞同. 惡臭的污染及其治理[J]. 上海化工 2003,28,10-13.JIN Ziyang, XU Yatong. Odourous Pollutants and Deodorizatjon Treatments [J]. Shanghai Chemical Industry. 2003,28, 10-13.
[2] Johns, M.R. Developments in wastewater treatment in the meat processing industry: A review [J]. Bioresource Technology 1995,54,203-216.
[3] Lau A., Cheng, K. Removal of odor using biofilter from duck confinement buildings [J]. Journal of Environmental Science and Health, Part A 2007,42, 955-959.
[4] Shareefdeen Z., Herner B., Webb D., et al. An odor predictive model for rendering applications [J]. Chemical Engineering Journal 2005,113,215-220.
[5] Zhu J. A review of microbiology in swine manure odor control [J].Agriculture, Ecosystems & Environment 2000,78, 93-106.
[6] Lin C.W. Hazardous air pollutant source emissions for a chemical fiber manufacturing facility in Taiwan [J]. Water, Air, & Soil Pollution 2001,128, 321-337.
[7] Xie B., Liang S.B., Tang Y., et al. Petrochemical wastewater odor treatment by biofiltration [J]. Bioresource Technology 2009,100,2204-2209.
[8] Yoon S.H., Chai X.S., Zhu J.Y., et al. In-digester reduction of organic sulfur compounds in kraft pulping [J]. Advances in Environmental Resear (China) 2001,5, 91-98.
[9] Liu Q., Li M., Chen R., Li Z.Y.,et al. Biofiltration treatment of odors from municipal solid waste treatment plants [J]. Waste Management 2009,29, 2051-2058.
[10] Shareefdeen Z., Herner B., Webb D., et al. Biofiltration eliminates nuisance chemical odors from industrial air streams [J]. Journal of Industrial Microbiology & Biotechnology 2003,30, 168-174.
[11] 盛彥清. 廣州市典型污染河道與城市污水處理廠中惡臭有機硫化物的初步研究[D]. (中國科學院研究生院 (廣州地球化學研究所)),2007.SHENG Yanqing. Primary study on odorous organic sulfides in typical polluted rivers and municipal wstewater treatment plants in Guangzhou urban [D]. Graduate School of Chinese Academy of Sciences (Guangzhou Institute of Geochemistry), 2007.
[12] Ratcliff P.A., Johnson P.W. The relationship between oral malodor,gingivitis, and periodontitis. A review. Journal of periodontology 1999,70, 485-489.
[13] Zeng X., Leyden J.J., Lawley H.J., et al. Analysis of characteristic odors from human male axillae [J]. Journal of Chemical Ecology 1991,17, 1469-1492.
[14] Mackie R.I., Stroot P.G., Varel V.H. Biochemical identification and biological origin of key odor components in livestock waste [J].Journal of Animal Science 1998,76, 1331.
[15] Ruth J.H. Odor Thresholds and irritation levels of several chemical substances: A review [J]. American Industrial Hygiene Association Journal 1986,47, 142 - 151.
[16] O'Neill D.H., Phillips V.R. A review of the control of odour nuisance from livestock buildings: Part 3, properties of the odorous substances which have been identified in livestock wastes or in the air around them [J]. Journal of Agricultural Engineering Research 1992,53,23-50.
[17] Gostelow P., Parsons S.A., Stuetz R.M. Odour measurements for sewage treatment works [J]. Water Research 2001,35, 579-597.
[18] Nimmermark S. Odour influence on well-being and health with specific focus on animal production emissions [J]. Annals of Agricultural and Environmental Medicine 2004,11, 163-173.
[19] Nagao M., Yahagi T., Honda M., et al. Demonstration of mutagenicity of aniline and o-toluidine by norharman [J]. Proceedings of the Japan Academy. Ser. B: Physical and Biological Sciences 1977,53, 34-37.
[20] Guest I., Varma D.R. Teratogenic and macromolecular synthesis inhibitory effects of trimethylamine on mouse embryos in culture [J].Journal of Toxicology and Environmental Health, Part A 1992,36,27-41.
[21] Cox H.H.J., Deshusses M.A. Biological waste air treatment in biotrickling filters [J]. Current Opinion in Biotechnology 1998,9,256-262.
[22] Kennes C., Thalasso F. Review: Waste gas biotreatment technology [J].Journal of Chemical Technology & Biotechnology 1998,72, 303-319.
[23] Hartikainen T., Ruuskanen J., Vanhatalo M., et al. Removal of ammonia from air by a peat biofilter [J]. Environmental Technology 1996,17, 45-53.
[24] Shah S.B., Basden T.J., Bhumbla D.K. Bench-scale biofilter for removing ammonia from poultry house exhaust [J]. Journal of Environmental Science and Health, Part B 2003,38, 89-101.
[25] Park B.G., Shin W.S., Chung J.S. Simultaneous biofiltration of H2S,NH3and toluene using cork as a packing material [J]. Korean Journal of Chemical Engineering 2009,26, 79-85.
[26] Chou M.S., Shiu W.Z. Bioconversion of methylamine in biofilters [J].Journal of the Air & Waste Management Association 1997,47, 58-65.
[27] Tang H.M., Hwang S.J., Hwang S.C. Waste gas treatment in biofilters.Journal of the Air & Waste Management Association 1996,46,349-354.
[28] 殷峻, 許文鋒, 丁穎, 等. 生物濾塔處理含三甲胺氣體的研究[J].中國給水排水, 2009,25, 60-62.YIN Jun, XU Wenfeng, DING Ying, et al. Biological removal of trimethylamine by biofilter [J]. China Water & Wastewater, 2009,25,60-62.
[29] 丁穎. 生物濾器處理惡臭氣體及其微生物生態研究[D]. (浙江大學),2007.DING Ying. Study on performances and microbial ecology of biofilters/biotrickling filters for odor removal [D]. (Zhejiang Unviersity), 2007.
[30] 胡芳, 魏在山, 葉蔚君. 生物法凈化含 NH3、H2S和三甲胺的水產飼料惡臭廢氣的研究[J]. 環境工程2007,25, 41-44.HU Fang, WEI Zaishan, YE Weijun. The study on biopurification of NH3, H2S and trimethylamine- containing odor from aquatic feed [J].Environmental Engineering 2007,25, 41-44.
[31] Schroeder E.D. Trends in application of gas-phase bioreactors [J].Reviews in Environmental Science and Biotechnology 2002,1, 65-74.
[32] Duan H.Q., Koe L.C.C., Yan R. Treatment of H2S using a horizontal biotrickling filter based on biological activated carbon: reactor setup and performance evaluation [J]. Applied Microbiology and Biotechnology 2005,67, 143-149.
[33] Gonza lez-Sa nchez A., Revah S., Deshusses M.A. Alkaline biofiltration of H2S odors. Environmental Science & Technology 2008,42, 7398-7404.
[34] 任愛玲, 郭靜. PVC彈性填料生物膜法處理含H2S氣體[J]. 化工環保 2000,20, 25-28.REN Ailing, GUO Jing. Treatment of H2S-containing gas by biofilm process with PVC elastic filler [J]. Environmental Protection of Chemical Industry 2000,20, 25-28.
[35] 黃樹杰, 周偉煌, 陳凡植. 生物滴濾塔處理含硫化氫惡臭氣體的試驗研究[J]. 廣東化工 2008,35, 106-109,158.HUANG Shujie, ZHOU Weihuang, CHEN Fanzhi. The study of biodegradation of H2S in biotrickling filter tower. Guangdong Chemical Industry 2008,35, 106-109,158.
[36] 王京剛, 張雅旎. 生物滴濾塔處理乙硫醇的實驗研究[J]. 環境科學與管理 2007,32, 74-76.WANG Jinggang, ZHANG Yani. Experimental study on the treatment of odor gas containing ethanethiol by bio-trickling filter [J].Environmental Science and Management 2007,32, 74-76.
[37] Kalingan A.E., Liao C.M., Chen J.W., et al. Microbial degradation of livestock-generated ammonia using biofilters at typical ambient temperatures [J]. Journal of Environmental Science and Health, Part B 2005,39, 185-198.
[38] Ho K.L., Chung Y.C., Lin Y.H., et al. Biofiltration of trimethylamine,dimethylamine, and methylamine by immobilizedParacoccussp. CP2 andArthrobactersp. CP1 [J]. Chemosphere 2008,72, 250-256.
[39] 廖強, 田鑫, 朱恂, 等. 陶瓷球填料生物滴濾塔降解甲苯廢氣[J].化工學報2003,54, 1774-1778.LIAO Qiang, TIAN Xin, ZHU Xun, et al. Purifying waste gas containing low concentration toluene in trickling biofilter with ceramic spheres [J]. Journal of Chemical Industry and Engineering (China)2003,54, 1774-1778.
[40] Li G.Y., He Z., An T.C., et al. Comparative study of the elimination of toluene vapours in twin biotrickling filters using two microorganismsBacillus cereusS1 and S2 [J]. Journal of Chemical Technology &Biotechnology 2008,83, 1019-1026.
[41] Aalam S., Pauss A., Lebeault J.M. (1993). High efficiency styrene biodegradation in a biphasic organic/water continuous reactor [J].Applied Microbiology and Biotechnology39, 696-699.
[42] Djeribi R., Dezenclos T., Pauss A., et al. Removal of styrene from waste gas using a biological trickling filter [J]. Engineering in Life Sciences 2005,5, 450-457.
[43] Prado J., Veiga M.C., Kennes C. Removal of formaldehyde, methanol,dimethylether and carbon monoxide from waste gases of synthetic resin-producing industries [J]. Chemosphere 2008,70, 1357-1365.
[44] Hao O.J., Kim M.H., Seagren E.A., et al. Kinetics of phenol and chlorophenol utilization byAcinetobacterspecies [J]. Chemosphere 2002,46, 797-807.
[45] Raghuvanshi S., Babu B.V. Experimental studies and kinetic modeling for removal of methyl ethyl ketone using biofiltration [J]. Bioresource Technology 2009,100, 3855-3861.
[46] Tsang Y.F., Chua H., Sin S.N., et al. Treatment of odorous volatile fatty acids using a biotrickling filter [J]. Bioresource Technology 2008,99,589-595.
[47] Mohseni M., Allen D.G.. Biofiltration of mixtures of hydrophilic and hydrophobic volatile organic compounds [J]. Chemical Engineering Science 2000,55, 1545-1558.
[48] De Bo I., Van Langenhove H., Jacobs P. Removal of toluene and trichloroethylene from waste air in a membrane bioreactor [J].Environmental Science and Pollution Research International 2002b, 9,28-29.
[49] Kumar A., Dewulf J., Van Langenhove H. Membrane-based biological waste gas treatment [J]. Chemical Engineering Journal 2008,136,82-91.
[50] Reij M.W., Keurentjes J.T.F., Hartmans S. Membrane bioreactors for waste gas treatment [J]. Journal of Biotechnology 1998,59, 155-167.
[51] Mudliar S., Giri B., Padoley K., et al. Bioreactors for treatment of VOCs and odours - A review [J]. Journal of Environmental Management 2010,91, 1039-1054.
[52. Kumar A., Dewulf J., Luvsanjamba M., et al. Continuous operation of membrane bioreactor treating toluene vapors by Burkholderia vietnamiensis G4 [J]. Chemical Engineering Journal 2008,140,193-200.
[53] De Bo I., Van Langenhove H., Heyman J. (2002a). Removal of dimethyl sulfide from waste air in a membrane bioreactor [J].Desalination148, 281-287.
[54] García-Pe?a I., Ortiz I., Hernández S., et al. Biofiltration of BTEX by the fungusPaecilomyces variotii[J]. International Biodeterioration &Biodegradation 2008,62, 442-447.
[55] Adebusoye S.A., Picardal F.W., Ilori M.O., et al. Aerobic degradation of di- and trichlorobenzenes by two bacteria isolated from polluted tropical soils [J]. Chemosphere 2007,66, 1939-1946.
[56] Delhoménie M.C., Heitz M. Biofiltration of air: a review [J]. Critical Reviews in Biotechnology 2005,25, 53-72.
[57] An T.C., Wan S.G., Li G.Y., et al. Comparison of the removal of ethanethiol in twin-biotrickling filters inoculated with strain RG-1 and B350 mixed microorganisms [J]. Journal of Hazardous Materials 2010,183, 372-380.
[58] Smet E., Langenhove H.V., Verstraete W. Long-term stability of a biofilter treating dimethyl sulphide [J]. Applied Microbiology and Biotechnology 1996,46, 191-196.
[59] Pol A., van der Drift C., Op den Camp H.J.M. Isolation of a carbon disulfide utilizingThiomonassp. and its application in a biotrickling filter [J]. Applied Microbiology and Biotechnology 2007,74, 439-446.
[60] Kanagawa T., Mikami E. Removal of methanethiol, dimethyl sulfide,dimethyl disulfide, and hydrogen sulfide from contaminated air by Thiobacillus thioparusTK-m [J]. Applied and Environmental Microbiology 1989,55, 555-558.
[61] Cho K.S., Hirai M., Shoda M. Degradation of hydrogen sulfide byXanthomonassp. strain DY44 isolated from peat [J]. Applied and Environmental Microbiology 1992b,58, 1183-1189.
[62] Sercu B., Nú?ez D., Aroca G., et al. Inoculation and start-up of a biotricking filter removing dimethyl sulfide [J]. Chemical Engineering Journal 2005,113, 127-134.
[63] Pol A., Op den Camp H.J.M., Mees S.G.M., et al. Isolation of a dimethylsulfide-utilizingHyphomicrobiumspecies and its application in biofiltration of polluted air [J]. Biodegradation 1994,5, 105-112.
[64] Shu C.H., Chen C.K. Enhanced removal of dimethyl sulfide from a synthetic waste gas stream using a bioreactor inoculated with microbacterium sp NTUT26 andPseudomonas putida[J]. Journal of Industrial Microbiology & Biotechnology, 2009,36, 95-104.
[65] Chung Y.C., Huang C., Tseng, C. P. Operation optimization ofThiobacillus thioparusCH11 biofilter for hydrogen sulfide removal [J].Journal of Biotechnology 1996,52, 31-38.
[66] Cho K.S., Hirai M., Shoda M. Degradation characteristics of hydrogen sulfide, methanethiol, dimethyl sulfide and dimethyl disulfide byThiobacillus thioparusDW44 isolated from peat biofilter [J]. Journal of Fermentation and Bioengineering 1991a,71, 384-389.
[67] Cho K.S., Zhang L., Hirai M., et al. Removal characteristics of hydrogen sulphide and methanethiol byThiobacillussp. isolated from peat in biological deodorization [J]. Journal of Fermentation and Bioengineering 1991b,71, 44-49.
[68] Shinabe K., Oketani S., Ochi T., et al. Characteristics of hydrogen sulfide removal byThiobacillus thiooxidans KS1 isolated from a carrier-packed biological deodorization system [J]. Journal of Fermentation and Bioengineering 1995,80, 592-598.
[69] Takashi I., Tatsuro M., Tomoyuki N., et al. Degradation of dimethyl disulfide byPseudomonasfluorescensStrain 76 [J]. Bioscience Biotechnology and Biochemistry 2007,71, 366-370.
[70] Chung Y.C., Lin Y.Y., Tseng C.P. Removal of high concentration of NH3and coexistent H2S by biological activated carbon (BAC)biotrickling filter [J]. Bioresource Technology 2005,96, 1812-1820.
[71] Kim S.G., Bae H.S., Lee S.T. A novel denitrifying bacterial isolate that degrades trimethylamine both aerobically and anaerobically via two different pathways [J]. Archives of Microbiology 2001,176, 271- 277.
[72] Liffourrena A.S., Salvano M.A., Lucchesi G.I.Pseudomonas putidaA ATCC 12633 oxidizes trimethylamine aerobically via two different pathways [J]. Archives of Microbiology 2010,192, 471-476.
[73] Meiberg J.B.M., Harder W. Aerobic and anaerobic metabolism of trimethylamine, dimethylamine and methylamine inHyphomicrobiumX [J]. Microbiology 1978,106, 265-276.
[74] Zefirov N.S., Agapova S.R., Terentiev P.B., et al. Degradation of pyridine byArthrobacter crystallopoietesandRhodococcus opocusstrains [J]. FEMS Microbiology Letters 1994,118, 71-74.
[75] Mohan S.V., Sistla S., Guru R.K., et al. Microbial degradation of pyridine usingPseudomonassp. and isolation of plasmid responsible for degradation [J]. Waste Management 2003,23, 167-171.
[76] Zilli M., Del Borghi A., Converti A. Toluene vapour removal in a laboratory-scale biofilter [J]. Applied Microbiology and Biotechnology 2000,54, 248-254.
[77] Park D.W., Kim S.S., Haam S., et al. Biodegradation of toluene by a lab-scale biofilter inoculated withpseudomonas putidaDK-1 [J].Environmental Technology 2002,23, 309-318.
[78] Jeong E., Hirai M., Shoda M. Removal of o-xylene using biofilter inoculated withRhodococcussp. BTO62 [J]. Journal of Hazardous Materials 2008,152, 140-147.
[79] Lee E.H., Kim J., Cho K.-S., et al. Degradation of hexane and other recalcitrant hydrocarbons by a novel isolateRhodococcussp. EH831[J]. Environmental Science and Pollution Research 2010,17, 64-77.
[80] Jang J.H., Hirai M., Shoda M. Styrene degradation byPseudomonassp.SR-5 in biofilters with organic and inorganic packing materials [J].Applied Microbiology and Biotechnology 2004,65, 349-355.
[81] Kim J., Ryu H.W., Jung D.J., et al. Styrene degradation in a polyurethane biofilter inoculated withPseudomonassp. IS-3 [J].Journal Microbiology Biotechnology 2005,15, 1207-1213.
[82] Bustard M., Whiting S., Cowan D., et al. Biodegradation of high-concentration isopropanol by a solvent-tolerant thermophile,Bacillus pallidust [J]. Extremophiles 2002,6, 319-323.
[83] Vainberg S., McClay K., Masuda H., et al. Biodegradation of ether pollutants byPseudonocardiasp. Strain ENV478 [J]. Applied and Environmental Microbiology 2006,72, 5218-5224.
[84] Ferreira N., Maciel H., Mathis H., et al. Isolation and characterization of a newMycobacterium austroafricanumstrain, IFP 2015, growing on MTBE [J]. Applied Microbiology and Biotechnology 2006,70,358-365.
[85] Jung I.G., Park O.H. Enhancement of cometabolic biodegradation of trichloroethylene (TCE) gas in biofiltration [J]. Journal of Bioscience and Bioengineering 2005,100, 657-661.
[86] Kan E., Deshusses M.A. Cometabolic Degradation of TCE vapors in a foamed emulsion bioreactor [J]. Environmental Science & Technology 2005,40, 1022-1028.
[87] Yu J.M., Chen J.M., Wang J.D. Removal of dichloromethane from waste gases by a biotrickling filter [J]. Journal of Environmental Sciences 2006,18, 1073-1076.
[88] G?bel M., Kranz O.H., Kaschabek S.R., et al. Microorganisms degrading chlorobenzene via ameta-cleavage pathway harbor highly similar chlorocatechol 2,3-dioxygenase-encoding gene clusters [J].Archives of Microbiology 2004,182, 147-156.
[89] Zhang L., Leng S., Zhu R., et al. Degradation of chlorobenzene by strainRalstonia pickettiiL2 isolated from a biotrickling filter treating a chlorobenzene-contaminated gas stream [J]. Applied Microbiology and Biotechnology, 2011, 1-9.
[90] Kennes C., Veiga M.C. Fungal biocatalysts in the biofiltration of VOC-polluted air [J]. Journal of Biotechnology 2004,113, 305-319.
[91] 朱國營, 劉俊新. 處理乙硫醇廢氣生物濾池中微生物的初步鑒定[J].環境科學學報2004,24, 333-337.ZHU Guoying, LIU Junxin . Identification of microorganisms in an EM-degrading biofilter [J]. Acta Scientiae Circumstantiae 2004,24,333-337.
[92] Prenafeta-Boldú F., Illa J., van Groenestijn J., et al. Influence of synthetic packing materials on the gas dispersion and biodegradation kinetics in fungal air biofilters [J]. Applied Microbiology and Biotechnology 2008,79, 319-327.
[93] García-Pe?a E.I., Hernández S., Favela-Torres E., et al. Toluene biofiltration by the fungusScedosporium apiospermumTB1 [J].Biotechnology and Bioengineering 2001,76, 61-69.
[94] Zamir S.M., Halladj R., Nasernejad B. Removal of toluene vapors using a fungal biofilter under intermittent loading [J]. Process Safety and Environmental Protection 2011,89, 8-14.
[95] Jin Y., Guo L., Veiga M.C., et al. Fungal biofiltration of α-pinene:Effects of temperature, relative humidity, and transient loads [J].Biotechnology and Bioengineering 2007,96, 433-443.
[96] Hernández-Meléndez O., Bárzana E., Arriaga S., et al. Fungal removal of gaseous hexane in biofilters packed with poly(ethylene carbonate)pine sawdust or peat composites [J]. Biotechnology and Bioengineering 2008,100, 864-871.
[97] Rene E.R., Veiga M.C., Kennes, C. Biodegradation of gas-phase styrene using the fungus Sporothrix variecibatus: Impact of pollutant load and transient operation [J]. Chemosphere 2010b,79, 221-227.
[98] Rene E.R., Spackov R., Veiga M., et al. Biofiltration of mixtures of gas-phase styrene and acetone with the fungusSporothrix variecibatus[J]. Journal of Hazardous Materials 2010a,184, 204-214.
[99] Wang C., Xi J.Y., Hu H.Y., et al. Biodegradation of Gaseous Chlorobenzene by White-rot FungusPhanerochaete chrysosporium[J].Biomedical and Environmental Sciences 2008,21, 474-478.
[100] Qi B., Moe W.M., Kinney K.A. Biodegradation of volatile organic compounds by five fungal species [J]. Applied Microbiology and Biotechnology 2002,58, 684-689.
[101] Wan S.G., Li G.Y., An T.C., et al. Co-treatment of single, binary and ternary mixture gas of ethanethiol, dimethyl disulfide and thioanisole in a biotrickling filter seeded with Lysinibacillus sphaericus RG-1 [J].Journal of Hazardous Materials 2011,186, 1050-1057.
[102] Wan S.G., Li G.Y., An T.C. Treatment performance of volatile organic sulfide compounds by the immobilized microorganisms of B350 group in a biotrickling filter [J]. Journal of Chemical Technology &Biotechnology, 2011, 86(9): 1166-1176.
[103. Lim J.S., Park S.J., Koo J.K., et al. Evaluation of porous ceramic as microbial carrier of biofilter to remove toluene vapor [J].Environmental Technology 2001,22, 47 - 56.
[104] Liu Q., Babajide A.E., Zhu P., et al. Removal of xylene from waste gases using biotrickling filters [J]. Chemical Engineering &Technology 2006,29, 320-325.
[105] Woertz J.R., van Heiningen W.N., van Eekert M.H., et al. Dynamic bioreactor operation: effects of packing material and mite predation on toluene removal from off-gas [J]. Applied Microbiology and Biotechnology 2002,58, 690-694.
[106] He Z., Zhou L.C., Li G.Y., et al. Comparative study of the eliminating of waste gas containing toluene in twin biotrickling filters packed with molecular sieve and polyurethane foam. Journal of Hazardous Materials 2009,167, 275-281.
[107] Chen J.M., Jiang L.Y., Sha H.L. Removal efficiency of high-concentration H2S in a pilot-scale biotrickling filter [J].Environmental Technology 2006,27, 759 - 766.
[108] Weigner P., Páca J., Loskot P., et al. The start-up period of styrene degrading biofilters [J]. Folia Microbiologica 2001,46, 211-216.
[109] Paca J., Koutsky B., Maryska M., et al. Styrene degradation along the bed height of perlite biofilter [J]. Journal of Chemical Technology &Biotechnology 2001,76, 873-878.
[110] Oh Y.S., Bartha R. Design and performance of a trickling air biofilter for chlorobenzene and o-dichlorobenzene vapors [J]. Applied and Environmental Microbiology 1994,60, 2717-2722.
[111] Ma Y., Zhao J., Yang B. Removal of H2S in waste gases by an activated carbon bioreactor [J]. International Biodeterioration &Biodegradation 2006,57, 93-98.
[112] Ortiz I., Revah S., Auria R. Effects of packing material on the biofiltration of benzene, toluene and xylene vapours [J].Environmental Technology 2003,24, 265 - 275.
[113] Cho K.S., Ryu H.W., Lee N.Y. Biological deodorization of hydrogen sulfide using porous lava as a carrier ofThiobacillus thiooxidans[J].Journal of Bioscience and Bioengineering 2000,90, 25-31.
[114] Cai Z., Kim D., Sorial G.A. Evaluation of trickle-bed air biofilter performance for MEK removal [J]. Journal of Hazardous Materials 2004,114, 153-158.
[115] Zhou L.C., Li G.Y., An T.C., et al. Recent patents on immobilized microorganism technology and its engineering application in wastewater treatment. Recent Patent on Engineering [J]. 2008,2(1),28-35.
[116] 崔明超,陳繁忠,傅家謨,等. 固定化微生物技術在廢水處理中的研究進展[J]. 化工環保,2003,23(5), 261-264.Cui Mingchao, CHEN Fanzhong, FU Jiamo, et al., Progress in the research on immobilized microorganism technology for wastewater treatment [J]. 2003,23(5), 261-264.
[117] 吳偉. 固定化微生物技術在處理高濃度有機廢水中的應用[J]. 環境科學與管理,2011,36(7), 105-110.WU Wei. Applications of Immobilized Microorganism Technology in high concentration organic wastewater treatment [J]. Environmental Science and Management. 2011,36(7), 105-110.
[118] Leson G., Winer A.M. Biofiltration: an innovative air pollution control technology for VOC emissions [J]. Journal of the Air & Waste Management Association 1991,41, 1045-1054.
[119] Jin Y.M., Veiga M.C., Kennes C. Effects of pH, CO2, and flow pattern on the autotrophic degradation of hydrogen sulfide in a biotrickling filter [J]. Biotechnology and Bioengineering 2005,92, 462-471.
[120] Smet E., Langenhove H.V., Philips G. Dolomite limits acidification of a biofilter degrading dimethyl sulphide [J]. Biodegradation 1999,10,399-404.
[121] Cho K.S., Hirai M., Shoda M. Enhanced removal efficiency of malodorous gases in a pilot-scale peat biofilter inoculated withThiobacillus-ThioparusDw44. Journal of Fermentation and Bioengineering 1992a,73, 46-50.
[122] Lee E.Y., Jun Y.S., Cho K.S., et al. Degradation characteristics of toluene, benzene, ethylbenzene, and xylene byStenotrophomonas maltophiliaT3-c [J]. Journal of the Air & Waste Management Association 2002,52, 400-406.
[123] Elsgaard L. Ethylene removal by a biofilter with immobilized bacteria[J]. Applied and Environmental Microbiology 1998,64, 4168-4173.
[124] Elsgaard L. Ethylene removal at low temperatures under biofilter and batch conditions[J]. Applied and Environmental Microbiology 2000,66, 3878-3882.
[125] 徐桂芹, 姜安璽, 閆波, 等. 低溫生物處理含硫含氮氣體效能和機理研究[J]. 哈爾濱工業大學學報 2005,37, 167-169.Xu Guiqin, JIANG Anxi, YAN Bo, et al. Evaluation of mechanism and result of H2S and NH3gas mixtures biodegradation in low temperature[J]. Journal of Harbin Institute of Technology 2005,37, 167-169.
[126] Luvsanjamba M., Kumar A., Van Langenhove H. Removal of dimethyl sulfide in a thermophilic membrane bioreactor [J]. Journal of Chemical Technology & Biotechnology 2008,83, 1218-1225.
[127] Deshusses M.A. Biological waste air treatment in biofilters [J].Current Opinion in Biotechnology 1997,8, 335-339.
[128] Schmidt T.C., Schirmer M., Wei H., et al. Microbial degradation of methyl tert-butyl ether and tert-butyl alcohol in the subsurface [J].Journal of Contaminant Hydrology 2004,70, 173-203.
[129] Na K., Kuroda A., Takiguchi N., et al. Isolation and characterization of benzene-tolerantRhodococcus opacusstrains [J]. Journal of Bioscience and Bioengineering 2005,99, 378-382.
[130] Liang Q., Takeo M., Chen M., et al. Chromosome-encoded gene cluster for the metabolic pathway that converts aniline to TCA-cycle intermediates inDelftia tsuruhatensisAD9 [J]. Microbiology 2005,151, 3435-3446.
[131] Zhang T., Zhang J., Liu S., et al. A novel and complete gene cluster involved in the degradation of aniline byDelftiasp. AN3 [J]. Journal of Environmental Sciences 2008,20, 717-724.
[132] Gonzalez J.M., Kiene R.P., Moran M.A. Transformation of sulfur compounds by an abundant lineage of marine bacteria in the alpha-subclass of the classProteobacteria[J]. Applied and Environmental Microbiology 1999,65, 3810-3819.
[133] Kelly D.P., Smith N.A. Organic sulfur compounds in the environment:biogeochemistry, microbiology, and ecological aspects [J]. Advances in Microbial Ecology 1990,11, 345-385.

