肝X受體抑制乳鼠心肌細(xì)胞缺氧/復(fù)氧損傷*
殷 然, 王夢(mèng)洪, 鄭澤琪, 彭錦添, 夏 鶯
(1南昌大學(xué)第一附屬醫(yī)院心內(nèi)科,江西省高血壓病研究所,2江西省人民醫(yī)院干部病房,江西 南昌 330006)
肝 X受體(liver X receptors,LXPs)包括 LXRα和LXRβ,屬于核受體超家族。結(jié)合了配體的LXRs構(gòu)象發(fā)生變化,使得輔阻遏復(fù)合物與輔激活因子之間發(fā)生交換,目的基因被轉(zhuǎn)錄。近年來的研究證實(shí),LXRs在脂代謝、糖代謝、炎癥、凋亡信號(hào)中起著關(guān)鍵的調(diào)節(jié)作用[1-6],并且有研究顯示LXRs對(duì)某些臟器如腦、腸等的缺血/再灌注損傷起保護(hù)作用[7,8]。我們的前期研究證實(shí),在正常小鼠心肌組織中有LXRs的低水平表達(dá);LXRs同樣對(duì)心肌細(xì)胞應(yīng)激,例如:由血管緊張素II(angiotensin II,Ang II)及脂多糖(lipopolysaccharide,LPS)誘導(dǎo)的心肌細(xì)胞肥大性生長起抑制作用[9,10]。鑒于心肌缺血/再灌注損傷與其它臟器缺血/再灌注損傷病理生理機(jī)制的相似性,并結(jié)合我們前期的工作基礎(chǔ),我們?cè)O(shè)想:LXRs通過抑制心肌細(xì)胞炎癥反應(yīng),從而對(duì)缺血/再灌注心肌起保護(hù)作用,是機(jī)體抗心肌缺血/再灌注損傷的重要防御因子。本研究以體外培養(yǎng)的乳鼠心肌細(xì)胞為研究對(duì)象,復(fù)制心肌細(xì)胞缺氧/復(fù)氧(anoxia/reoxygenation,A/R)模型,觀察外源性激活LXRs對(duì)心肌細(xì)胞A/R損傷的影響,探討其抗心肌缺血/再灌注損傷的機(jī)制及相應(yīng)的細(xì)胞信號(hào)通路。
材料和方法
1 材料
原代心肌細(xì)胞分離試劑盒購自Worthington。大鼠胚胎心肌細(xì)胞株H9c2為本實(shí)驗(yàn)室貯存。DEME/F12培養(yǎng)基、標(biāo)準(zhǔn)胎牛血清購自HyClone。LXRs特異性激動(dòng)劑T0901317購自Sigma。總RNA提取及逆轉(zhuǎn)錄試劑盒購自Applied Biosystems。Real-time PCR儀及綠色熒光SYBP試劑盒購自Roche。PCR引物由Invitrogen合成。乳酸脫氫酶(lactate dehydrogenase,LDH)及肌酸激酶(creatine kinase,CK)活性試劑盒購自南京建成生物工程研究所。熒光素酶報(bào)告基因檢測(cè)試劑盒及 pNF-κB-Luc購自Stratagene。Effectene轉(zhuǎn)染試劑盒購自Qiagen。
2 方法
2.1 乳鼠心肌細(xì)胞分離、培養(yǎng)及A/R模型建立選用出生后1-2 d的SD大鼠,參照文獻(xiàn)[8]的方法分離心肌細(xì)胞,接種、培養(yǎng)于24孔培養(yǎng)板中。A/R模型的建立:用氬氣飽和后更換使用無糖無血清培養(yǎng)基,再灌入高純度氬氣封口,在培養(yǎng)箱中孵育2 h,再拆開封口在培養(yǎng)箱中孵育24 h。
2.2 實(shí)驗(yàn)分組 乳鼠心肌細(xì)胞分離成功后,隨機(jī)分為 5組:正常對(duì)照組(control)、A/R組、A/R+T0901317(1 μmol/L)、A/R+T0901317(5μmol/L)組和 A/R+T0901317(10 μmol/L)組。Control組:不進(jìn)行A/R處理,正常情況下連續(xù)培養(yǎng)26 h;A/R組:在高純度氬氣,無糖無血清培養(yǎng)基條件下培養(yǎng)2 h,復(fù)氧開始時(shí)加入生理鹽水,再復(fù)氧培養(yǎng)24 h;A/R+T0901317(1 μmol/L)組、A/R+T0901317(5 μmol/L)組和 A/R+T0901317(10 μmol/L)組:預(yù)先給予終濃度為1、5、10μmol/L T0901317 孵育60 min,再在無血清低糖DMEM培養(yǎng)基缺氧孵育2 h,然后繼續(xù)復(fù)氧培養(yǎng)24 h,檢測(cè)各組在復(fù)氧24 h后的LDH、CK活性及腫瘤壞死因子-α(tumor necrosis factor α,TNF-α)、白細(xì)胞介素 -6(interleukin-6,IL-6)、單核細(xì)胞趨化因子-1(monocyte chemoattractant protein-1,MCP-1)mRNA的水平。在熒光素酶報(bào)告基因檢測(cè)核因子 -κB(nuclear factor-κB,NF-κB)轉(zhuǎn)錄活性實(shí)驗(yàn)中,H9c2細(xì)胞隨機(jī)分為3組:ad-LacZ組、ad-VP16-LXRα組和ad-VP16-LXRβ組。3組均參照文獻(xiàn)[8]轉(zhuǎn)染 pNF-κB-Luc 24 h后,換為無血清培養(yǎng)基繼續(xù)培養(yǎng)12 h,分別轉(zhuǎn)染 Ad-LacZ、Ad-VP16-LXRα、Ad-VP16-LXRβ,12 h后進(jìn)行 A/R或?qū)φ諏?shí)驗(yàn)。
2.3 LDH、CK活性測(cè)定 取復(fù)氧24 h心肌細(xì)胞,常規(guī)消化。調(diào)整細(xì)胞密度為3×109cells/L,加入預(yù)冷的RIPA細(xì)胞裂解液,重新懸浮細(xì)胞。冰浴15 min,4℃、13000×g離心30 min,取上清,采用常規(guī)比色法,按試劑盒說明書測(cè)定LDH、CK的活性。
2.4 Real-time PCR Trizol法提取總 RNA,在逆轉(zhuǎn)錄酶MML-V的作用下,將mRNA逆轉(zhuǎn)錄成cDNA分子。應(yīng)用SYBR Green熒光染料技術(shù)行實(shí)時(shí)定量PCR反應(yīng)。PCR引物如下:TNF-α上游引物5'-TGAACTTCGGGGTGATCGGTC-3',下游引物 5'-AGCCTTGTCCCTTGAAGAGGAAC-3';IL-6上游引物5'-CACGAAGGCTGTGCTGTTT-3',下游引物 5'-ACTTGCTTCCCACACTGTTTG-3';MCP-1上游引物 5'-TTAACGCCCCACTCACCTGCTG -3',下游引物 5'-CAATGTAGGCCGAGAGTGCTG-3';βactin上游引物 5'-AGATTACTGCTCTGGCTCCTA-3',下游引物 5'-CAAAGAAAGGGTGTAAAACG-3'。反應(yīng)條件:94 ℃ 3 min,94 ℃ 30 s,53 ℃ 30 s,72℃ 30 s,50個(gè)循環(huán)。
2.5 轉(zhuǎn)染及熒光素酶報(bào)告基因檢測(cè) H9c2細(xì)胞接種于24孔板,在完全培養(yǎng)基(DMEM/F12)中培養(yǎng)至匯合度為60%。用Effectene轉(zhuǎn)染試劑盒中的緩沖液EC 溶解 0.4 μg pNF - κB - Luc,終體積 100 μL,加入3.2 μL試劑盒中的 Enhancer,輕輕混勻;15-25℃放置2-5 min,加入10 μL Effectene轉(zhuǎn)染試劑,輕輕混勻,15-25℃放置5-10 min;用PBS清洗細(xì)胞,加入1.6 mL培養(yǎng)液;向轉(zhuǎn)染混合物中加入0.6 mL培養(yǎng)液,混勻,迅速加入細(xì)胞中,37℃、5%CO2孵育箱孵育24 h。參照說明書,采用熒光素酶報(bào)告基因法測(cè)定NF-κB活性。
3 統(tǒng)計(jì)學(xué)處理
數(shù)據(jù)采用SPSS 12.0進(jìn)行統(tǒng)計(jì)分析。計(jì)數(shù)資料以均數(shù)±標(biāo)準(zhǔn)差()表示,采用隨機(jī)區(qū)組設(shè)計(jì)的單因素方差分析(ANOVA),組間多重比較采用最小顯著差異法,檢驗(yàn)顯著性水平定于α=0.05。
結(jié) 果
1 LXRs激動(dòng)劑T0901317對(duì)心肌細(xì)胞A/R損傷的保護(hù)作用
各實(shí)驗(yàn)組在缺氧后心肌細(xì)胞受到損傷,復(fù)氧24 h后,上清液中LDH和CK均較對(duì)照組明顯增高(P<0.05),而經(jīng)T0901317預(yù)處理后顯著減輕A/R損傷,表現(xiàn) 為 A/R+T0901317(5 μmol/L)組、A/R+T0901317(10 μmol/L)組的LDH和CK較單純A/R組顯著降低(P<0.05),見圖 1。以上結(jié)果顯示,T0901317對(duì)LXRs的激活明顯減輕A/R造成的心肌細(xì)胞損傷。

Figure1.The protective effect of LXRs agonist T0901317 on A/R injury in cultured neonatal rat cardiomyocytes..n=6.*P <0.05 vs control;#P <0.05 vs A/R.圖1 LXRs激動(dòng)劑T0901317對(duì)乳鼠心肌細(xì)胞A/R損傷的保護(hù)作用
2 LXRs激動(dòng)劑T0901317對(duì)心肌細(xì)胞A/R損傷炎癥因子表達(dá)的影響
TNF-α、IL-6和MCP-1 mRNA均較對(duì)照組顯著升高(P<0.05)。經(jīng)T0901317預(yù)處理的A/R+T0901317(5 μmol/L)組、A/R+T0901317(10 μmol/L)組炎癥因子表達(dá)水平較單純A/R組顯著降低(P<0.05),見圖2。這說明A/R可以引起心肌細(xì)胞炎癥因子的大量釋放,而通過T0901317激活LXRs則可起到抑制由A/R介導(dǎo)的TNF-α、IL-6和MCP-1 mRNA水平增高。
3 腺病毒介導(dǎo)的LXRs過表達(dá)對(duì)心肌細(xì)胞A/R損傷NF-κB活性的影響
各實(shí)驗(yàn)組NF-κB活性水平均較對(duì)照組顯著升高(P<0.05)。經(jīng)Ad-VP16-LXRα感染的Ad-VP16-LXRα組NF-κB活性水平較Ad-LacZ感染的Ad-LacZ組顯著降低(P<0.05);而經(jīng) Ad-VP16-LXRβ感染的Ad-VP16-LXRβ組NF-κB活性水平與Ad-LacZ感染的Ad-LacZ組無顯著差別(P>0.05),見圖3。這說明A/R可以引起NF-κB活性水平增高,而LXRα過表達(dá)則抑制由A/R介導(dǎo)的NF-κB活性水平增高。
討 論
心肌梗死嚴(yán)重危害人類健康,是影響生存率和死亡率的主要原因之一。目前針對(duì)心肌梗死的主要治療手段,包括溶栓、腔內(nèi)介入治療、冠狀動(dòng)脈搭橋手術(shù)等,均是對(duì)缺血心肌實(shí)施再灌注,而在心肌缺血后實(shí)行再灌注的過程中,在挽救存活細(xì)胞的同時(shí),也會(huì)帶來細(xì)胞的損傷,表現(xiàn)為電活動(dòng)異常、心肌收縮性能降低、心肌細(xì)胞線粒體腫脹等,使再灌注心肌功能急劇降低,部分可逆性心肌損傷轉(zhuǎn)變?yōu)椴豢赡嫘該p傷。心肌缺血/再灌注損傷是阻礙缺血心肌從再灌注療法中獲得最佳療效的主要難題。炎癥反應(yīng)、凋亡是心肌缺血/再灌注損傷發(fā)病機(jī)制中的重要環(huán)節(jié),抑制炎癥反應(yīng)及凋亡,已成為治療心肌缺血/再灌注損傷研究的熱點(diǎn)[11]。
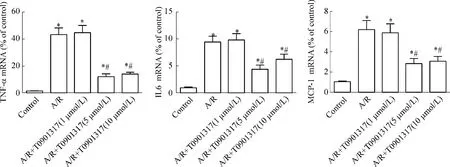
Figure2.The effect of LXRs agonist T0901317 on proinflammatory factor expression induced by A/R in cultured neonatal rat cardiomyocytes..n=6.*P<0.05 vs control;#P<0.05 vs A/R.圖2 LXRs激動(dòng)劑T0901317對(duì)乳鼠心肌細(xì)胞A/R誘導(dǎo)的炎癥因子的作用
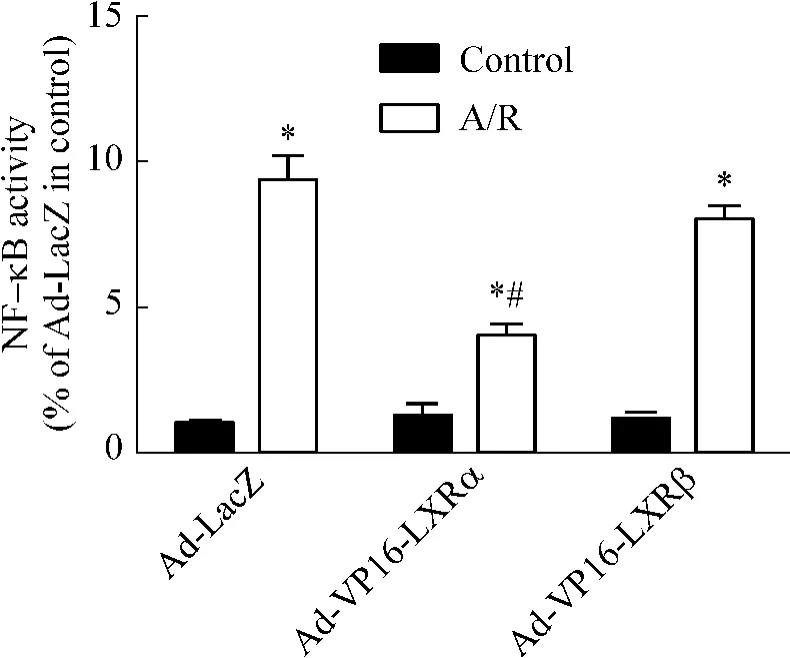
Figure3.The effect of adenoviral vectors containing constitutively-active forms of LXRα and LXRβ on NF-κB activity induced by A/R injury in cultured neonatal rat cardiomyocytes..n=6.*P<0.05 vs control;#P<0.05 vs Ad-LacZ in A/R.圖3 腺病毒介導(dǎo)的LXRs過表達(dá)對(duì)乳鼠心肌細(xì)胞A/R損傷NF-κB活性的影響
最初在巨噬細(xì)胞中的研究表明LXRs調(diào)控了一系列參與膽固醇逆向轉(zhuǎn)運(yùn)的基因,主要是調(diào)控膜轉(zhuǎn)運(yùn)體三磷酸腺苷結(jié)合子超家族成員的表達(dá)[1]。此外,LXRs還能抑制細(xì)菌、LPS、TNF-α和IL-1β刺激所產(chǎn)生的炎癥因子,這些炎癥因子包括:誘導(dǎo)型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、環(huán)氧合酶2(cyclooxygenase 2,COX-2)、IL-6和IL-1β、MCP-1、MCP-3和人基質(zhì)金屬蛋白酶 -9(matrix metalloproteinase - 9,MMP - 9)[2-4]。在得到功能和失去功能研究中都發(fā)現(xiàn),激活LXRs途徑具有抗動(dòng)脈粥樣硬化作用。LXRs抗動(dòng)脈粥樣硬化與其調(diào)控炎癥、凋亡反應(yīng)、脂代謝有關(guān)[5]。此前,我們的研究首次證實(shí),在正常小鼠心肌組織中有LXRs的表達(dá),LXRα基因缺失的C57/B6小鼠在主動(dòng)脈縮窄術(shù)后左室肥厚較對(duì)照組明顯加重;肥厚刺激明顯增加心肌LXRs含量,LXRs激動(dòng)劑-T0901317通過抑制NF-κB而減輕由Ang II及LPS誘導(dǎo)的心肌細(xì)胞肥大性生長。此外我們構(gòu)建了心肌特異性表達(dá)LXRα及 LXRβ的腺病毒載體:Ad-VP16-LXRα和Ad-VP16-LXRβ,并發(fā)現(xiàn)心肌細(xì)胞過表達(dá)LXRα及LXRβ能抑制由Ang II及LPS誘導(dǎo)的NF-κB活化,從而證實(shí)LXRs在心肌細(xì)胞炎癥反應(yīng)中發(fā)揮重要作用[9,10]。
雖然LXRs對(duì)心肌缺血/再灌注損傷有何影響及相應(yīng)的作用靶點(diǎn)尚未見報(bào)道,但有研究者已經(jīng)注意到LXRs在其它臟器缺血/再灌注損傷中的作用。一項(xiàng)研究顯示,LXRs激動(dòng)劑GW3695可減輕大鼠腦缺血/再灌注損傷,這一效應(yīng)與LXRs抑制神經(jīng)細(xì)胞NF-κB活性、降低其靶基因COX-2表達(dá)有關(guān)[7]。另一項(xiàng)小鼠內(nèi)臟動(dòng)脈阻斷性休克的研究發(fā)現(xiàn),LXRs激動(dòng)劑T0901317通過抑制MAPKs、NF-κB信號(hào)通路,調(diào)控凋亡相關(guān)基因fas、bax、bcl-2的表達(dá),從而減輕內(nèi)臟器官的再灌注損傷[8]。本研究發(fā)現(xiàn),LXRs激動(dòng)劑T0901317抑制由A/R損傷造成的乳鼠心肌細(xì)胞炎癥因子TNF-α、IL-6和MCP-1 mRNA表達(dá),從而減輕乳鼠心肌細(xì)胞A/R損傷。進(jìn)一步應(yīng)用腺病毒介導(dǎo)LXRα/LXRβ在心肌細(xì)胞中過表達(dá)的實(shí)驗(yàn)表明,LXRs對(duì)心肌細(xì)胞A/R損傷起保護(hù)作用,這一保護(hù)作用與LXRs,尤其是LXRα抑制NF-κB轉(zhuǎn)錄活性有關(guān)。核轉(zhuǎn)錄因子NF-κB是參與調(diào)節(jié)缺血再灌注心肌細(xì)胞炎癥反應(yīng)與凋亡的重要環(huán)節(jié),轉(zhuǎn)錄產(chǎn)生的細(xì)胞因子和黏附分子如TNF-α、IL-6、MCP-1、細(xì)胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、IL-8、選擇素等,直接或間接通過活性氧增加引起血管內(nèi)皮細(xì)胞和心肌細(xì)胞的損傷[12]。缺血預(yù)處理及NF-κB特異性抑制劑PDTC可能通過抑制NF-κB激活,減少炎癥介質(zhì)的表達(dá),抑制中性粒細(xì)胞的激活,減少心肌細(xì)胞的凋亡,進(jìn)而減輕心肌缺血再灌注損傷[13];NF-κB亞基p50的靶向斷裂能減輕心肌梗死后的心室破裂,改善心臟功能和生存時(shí)間[14]。本研究在體外培養(yǎng)的乳鼠心肌細(xì)胞中復(fù)制A/R模型,觀察到外源性激活LXRs通過抑制NF-κB活化、減輕心肌細(xì)胞炎癥反應(yīng)而改善心肌細(xì)胞A/R造成的損傷,證實(shí)了LXRs是機(jī)體抗心肌缺血/再灌注損傷的重要防御因子。我們下一步計(jì)劃進(jìn)行在體動(dòng)物實(shí)驗(yàn),進(jìn)一步驗(yàn)證此假設(shè),以期為遏制心肌缺血/再灌注損傷的發(fā)生發(fā)展和尋找新的治療方法提供一個(gè)新的方向。
[1]Tontonoz P,Mangelsdorf DJ.Liver X receptor signaling pathways in cardiovascular disease[J].Mol Endocrinol,2003,17(6):985-993.
[2]Tangirala RK,Bischoff ED,Joseph SB,et al.Identification of macrophage liver X receptors as inhibitors of atherosclerosis[J].Proc Natl Acad Sci U S A,2002,99(18):11896-11901.
[3]Morello F,Saglio E,Noghero A,et al.LXR -activating oxysterols induce the expression of inflammatory markers in endothelial cells through LXR-independent mechanisms[J].Atherosclerosis,2009,207(1):38 -44.
[4]Fntaine C,Rigamonti E,Pourcet B,et al.The nuclear receptor Rev-erbalpha is a liver X receptor(LXR)target gene driving a negative feedback loop on select LXR-induced pathways in human macrophages[J].Mol Endocrinol,2008,22(8):1797 -1811.
[5]Buono C,Li Y,Waldo SW,et al.Liver X receptors inhibit human monocyte-derived macrophage foam cell formation by inhibiting fluid - phase pinocytosis of LDL[J].J Lipid Res,2007,48(11):2411-2418.
[6]殷 然,董吁鋼,李紅良,等.AMPK通過增強(qiáng)心肌脂肪酸氧化抑制大鼠心肌肥厚[J].中國病理生理雜志,2007,23(7):1258 - 1262.
[7]Morales JR,Ballesteros I,Deniz JM,et al.Activation of liver X receptors promotes neuroprotection and reduces brain inflammation in experimental stroke[J].Circulation,2008,118(14):1450-1459.
[8]Crisafulli C,Di Paola R,Mazzon E,et al.Liver X receptor agonist treatment reduced splanchnic ischemia and reperfusion injury[J].J Leukoc Biol,2009,87(2):309-321.
[9]Wu S,Yin R,Ernest R,et al.Liver X receptors are negative regulators of cardiac hypertrophy via suppressing NF-κB signalling[J].Cardiovasc Res,2009,84(1):119 -126.
[10]殷 然,李玉泉,王夢(mèng)洪,等.肝臟X受體調(diào)控小鼠心肌細(xì)胞肥大性生長[J].中華心血管病雜志,2009,37(12):1119-1123.
[11]Baines CP.The mitochondrial permeability transition pore and ischemia - reperfusion injury[J].Basic Res Cardiol,2009,104(2):181-188.
[12]Gu Q,Yang XP,Bonde P,et al.Inhibition of TNF-alpha reduces myocardial injury and proinflammatory pathways following ischemia - reperfusion in the dog[J].Cardiovasc Pharmacol,2006,48(6):320 -328.
[13]Fischer UM,Radhakrishnan RS,Uray KS,et al.Myocardial function after gut ischemia/reperfusion:does NF κB play a role?[J].J Surg Res,2009,152(2):264 -270.
[14]Gutierrez SH,Kuri MR,del Castillo ER.Cardiac role of the transcription factor NF - κB[J].Cardiovasc Hematol Disord Drug Targets,2008,8(2):153-160.
- 中國病理生理雜志的其它文章
- 慢性乙肝患者外周血CD4 + CD25 + FOXP3 +Tregs 及HBV 抗原特異性CTLs 的檢測(cè)和分析*
- 1,25-二羥維生素D3抑制被動(dòng)致敏人氣道平滑肌細(xì)胞的增殖
- 職業(yè)苯接觸工人外周血T-bet和GATA-3表達(dá)變化的特點(diǎn)*
- 職業(yè)苯接觸工人外周血T-bet和GATA-3表達(dá)變化的特點(diǎn)*
- 變性高效液相色譜技術(shù)定量檢測(cè)急性髓細(xì)胞白血病FLT3基因內(nèi)部串聯(lián)重復(fù)突變方法學(xué)的建立
- 腹腔鏡子宮切除術(shù)單極電凝對(duì)機(jī)體電解質(zhì)及子宮超微結(jié)構(gòu)的影響

