變性高效液相色譜技術定量檢測急性髓細胞白血病FLT3基因內部串聯重復突變方法學的建立
陳建蘭,李慶山△,王漢平,應 逸,杜慶華,許艷麗,陳曉燕,謝健晉,毛 平,李志鵬
(1廣州醫學院附屬市一人民醫院血液科,廣東 廣州 510180;2廈門大學生命科學學院分子診斷學實驗室,福建 廈門 361005)
在急性髓細胞白血病(acute myeloid leukemia,AML)分層治療的研究中,Fms樣酪氨酸激酶3(Fms-like tyrosine kinase 3,FLT3)基因近膜區的內部串聯重復(internal tandem duplication,ITD)是最早被識別的分子標記之一,其存在與否被認為對AML的預后具有重要的判斷價值。有研究認為[1,2],FLT3-ITD的這種預測價值與突變等位基因的比例有關,疾病復發率(relapse rate,RR)、無病生存率(disease-free survival,DFS)和總體生存期(overall survival,OS)隨著突變比例的升高均有惡化趨勢,且高白細胞也在高突變比例中更加突出,高比例突變的FLT3-ITD預測價值顯得更大,因而定量分析FLT3-ITD尤為重要。通常情況下由于毛細管電泳法(capillary electrophoresis,CE)的高效性和高敏感性,FLT3-ITD相對定量分析主要是采用此法[3]。變性高效液相色譜技術(denaturing high-performance liquid chromatography,DHPLC)已經用于檢測慢性粒細胞白血病(chronic myeloid leukemia,CML)ABL激酶區點突變[4],且技術方法穩定可靠,而少見DHPLC用于檢測FLT3-ITD,故我們嘗試運用DHPLC技術建立相對定量檢測FLT3-ITD突變比例的方法,對121例臨床病例進行檢測,并與CE分析結果進行了比較,最后對比測序結果。
材料和方法
1 材料
1.1 研究對象 為患者,共121例,其中40例來自2007年1月-2010年12月我院住院或門診初治經細胞形態學、免疫組織化學染色及流式細胞術免疫學分型并參照《血液病診斷及療效標準》[5]確診為原發性 AML病例,其余81例來自2007年1月-2010年12月廈門大學中山醫院與第一附屬醫院的住院或門診初治同上確診為AML病例,由廈門大學生命科學學院分子診斷學實驗室提供。其中M111例,M235例,M335例,M49例,M526例,M64例,M71例;男59例,女62例;中位年齡35(16-77)歲。陰性對照為10例健康人群。
1.2 主要試劑 EZHighTMDNA kit購自Texas BioGene。5×buffer溶液(含 2.5 mmol/L dNTPs,2.5 mmol/L Mg2+)和無RNase H2O均購自TaKaRa大連寶生物工程有限公司;10×LCGreen plus dye、Hotstart polymerase均為 Qiagen產品;FLT3-ITD正反向引物參照NCBI設計,由TaKaRa大連寶生物工程有限公司合成。DHPLC流動液:三乙胺乙酰鹽(TEAA)和乙腈(ACN)均購自Transgenomic。
2 方法
2.1 基因組DNA提取 原保存的固定后的骨髓樣本用EZHighTMDNA kit提取樣本DNA,具體操作步驟按試劑盒說明進行。采用紫外分光光度計測定A260/A280值確定DNA產物的濃度。將提取的DNA置于-80℃凍存備用。
2.2 PCR擴增 針對FLT3-ITD突變主要發生在14號外顯子上,設計擴增片段長度為328 bp,正向引物5'-AGC AAT TTA GGT ATG AAA GCC AGC TA-3',反向引物 5'-GGT TGC CGT CAA AAT GCT GAA AG-3'。反應體系組成為:5× buffer 5.0 μL;正向引物(10 μmol/L):0.5 μL;反向引物(10 μmol/L):0.5 μL;Hotstart polymerase 1.0 μL,DNA 2.0 μL(根據濃度調到50-100 ng);加無RNA酶水至體積25 μL。上ABI Veriti PCR擴增儀,反應條件:95℃預變性10 min,94 ℃ 30 s,55 ℃ 1 min,72℃ 1 min,循環29次。72 ℃延伸7 min,1個循環。將PCR產物置95℃變性5 min,然后降溫至25℃ 1 min,這時混合樣品中就會形成同源和異源的雙鏈。
2.3 DHPLC分析 上WAVE 3500型分析儀前先配流動液:Buffer A液(0.1 mol/L TEAA):50 mL 2 mmol/L TEAA+250 μL ACN(乙腈)再加HPLC純水定容至1 L。Buffer B液(0.1 mol/L TEAA,含25%ACN):50 mL 2 mmol/L TEAA+250 mL ACN再加HPLC純水定容至1 L。將變性后的PCR產物放入到WAVE 3500型分析儀96孔樣品池上,在50℃的條件下分析待測樣本。根據程序指令,進樣器自動吸取15 μL PCR產物,注人DNASep分離柱內,被流動相以0.9 mL/min的流速進行洗脫,在260 nm波長處讀取吸光度(A)值。經系統自動處理后,形成DHPLC峰形圖譜,結果被自動存儲,供分析鑒定。每個樣品重復3次實驗。
正常人基因組和FLT3-ITD野生型標本DHPLC分析時表現為單1洗脫峰,突變型樣本則表現為2個或3個洗脫峰。與標準參考模板對比,通過觀察異源雙鏈洗脫峰出現與否,確定突變存在的情況;然后通過對洗脫峰的峰面積進行計算,獲得突變等位基因的比例,計算公式:

2.4 CE方法分析 在廈門大學生命科學學院分子診斷學實驗室完成,首先也是針對FLT3-ITD基因突變多發生在14外顯子上設計引物,設計擴增片段為367 bp。摸索反應體系和反應條件后進行PCR擴增,摸索反應體系和反應條件,25 μL 反應體系含5 μL 10 ×PCR buffer(100 mmol/L Tris-HCl,pH 8.3,500 mmol/L KCl,15 mmol/L MgCl2),0.2 mmol/L dNTPs,1 U Taq HS DNA聚合酶,正反向引物(各自均為150 nmol/L)和5 μL gDNA模板。在T3 Thermocycler上進行PCR擴增,程序如下:95℃預變性3 min;18個循環的Touchdown PCR,程序為95℃ 30 s,61℃ 30 s(每個循環下降0.5℃),72℃ 40 s;17個循環的普通PCR,程序為95℃ 30 s,52℃ 30 s,72℃ 40 s;72℃ 7 min。
后取1 μL PCR產物(用去離子水稀釋50-200倍)、16.5 μL去離子甲酰胺(SLS)、2.5 μL 熒光標記的分子量標準(CEQ 600 size standard mixture,Beckman Coulter,p/n 608095,用SLS稀釋10倍)混勻后,轉移到96孔加樣板,并滴加1滴石蠟油防止揮發。在CEQ8800遺傳分析系統上,采用“Frag-2”程序運行,程序進行自動化操作。實驗結束后,根據儀器自帶軟件進行“Fragment Analysis”,對毛細管電泳結果進行片段分析,確定是否存在FLT3-ITD突變。正常人基因組DNA標本和野生型PCR擴增產物在367 bp處出現單個尖峰。突變型標本除在367 bp處出現單峰外,在367 bp后將出現另一峰,根據軟件給出的野生型峰面積S1和突變型峰面積S2,按照以下公式來計算突變比例,計算公式:
FLT3-ITD突變比例(%)=S2/(S1+S2)×100%。
2.5 DNA測序 將所有樣品DNA送北京六合華大基因科技有限公司擴增后測序驗證;再將測序結果利用DNAMAN軟件分析并與NCBI網上的FLT3基因進行比對確定基因突變情況;最后與2種方法檢測結果對比。
3 統計學處理
采用SPSS 13.0統計軟件包對實驗數據進行統計學分析。兩組計量資料均數比較采用隨機配對設計資料t檢驗,假定差值服從正態分布。
結 果
1 AML患者DHPLC分析結果
121例患者樣本中有108例樣本擴增后進行分析出現單1洗脫峰,為FLT3-ITD野生型,121例中(4號、5號、7號、8號、11號、14號、28 號、79號、85號、93號、107號、110號和118號)有2個或3個洗脫峰,即為FLT3-ITD突變型的樣本,見圖1,總陽性率為13/121(10.7%)。根據以上所述對應的公式計算出陽性樣本的突變比例。每例陽性樣本3次實驗所得突變比例間無顯著差異,取平均值。得出13例陽性樣本突變等位基因的比例不一,分布范圍中位數34.0%(12.4%-87.0%),見表1。正常對照的10例健康人群PCR產物的DHPLC洗脫峰也全為單1峰。
2 AML患者CE分析結果
正常對照健康成人DNA標本進行CE的片段分析結果在367 bp處出現單個尖峰。121例AML標本中108例在367 bp處出現單個尖峰,為FLT3-ITD野生型;13例除367 bp處峰之外在367 bp后出現額外峰,為FLT3-ITD突變型(見121例樣本中4號、5號、7號、8號、11號、14號、28號、79號、85號,93號、107號、110號和 118號),見圖 2,總陽性率為13/121(10.7%)。根據以上所述對應的公式計算出陽性樣本的突變比例。每例陽性樣本重復3次實驗所得突變比例間無顯著差異,取平均值。13例陽性樣本間比較突變等位基因的比例不一,分布范圍中位數為34.5%(11.4%-80.2%),見表1。
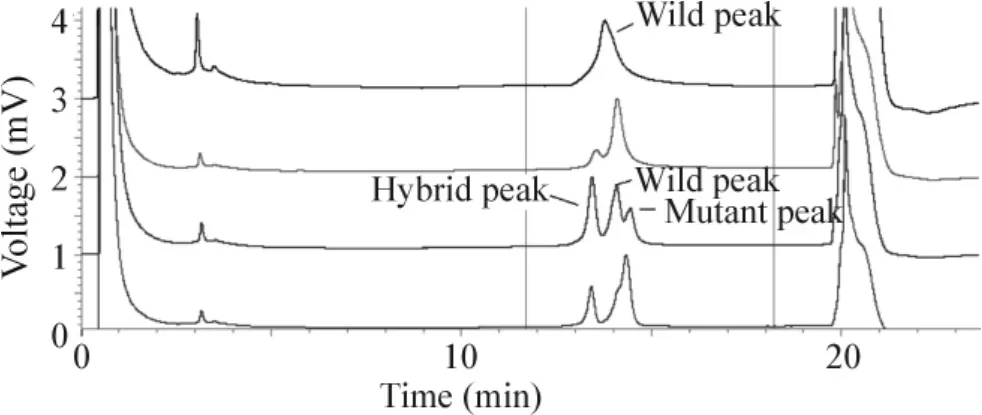
Figure1.The DHPLC characteristic elution peaks.From top to bottom:represent sample of wildtype FLT3-ITD;the 28th sample:FLT3-ITD mutation in the low percentage(12.4%);the 8th sample:FLT3-ITD mutation in the moderate percentage(42.3%);the 7th sample:FLT3-ITD mutation in the high proportion(87.0%).圖1 DHPLC的特征性洗脫峰
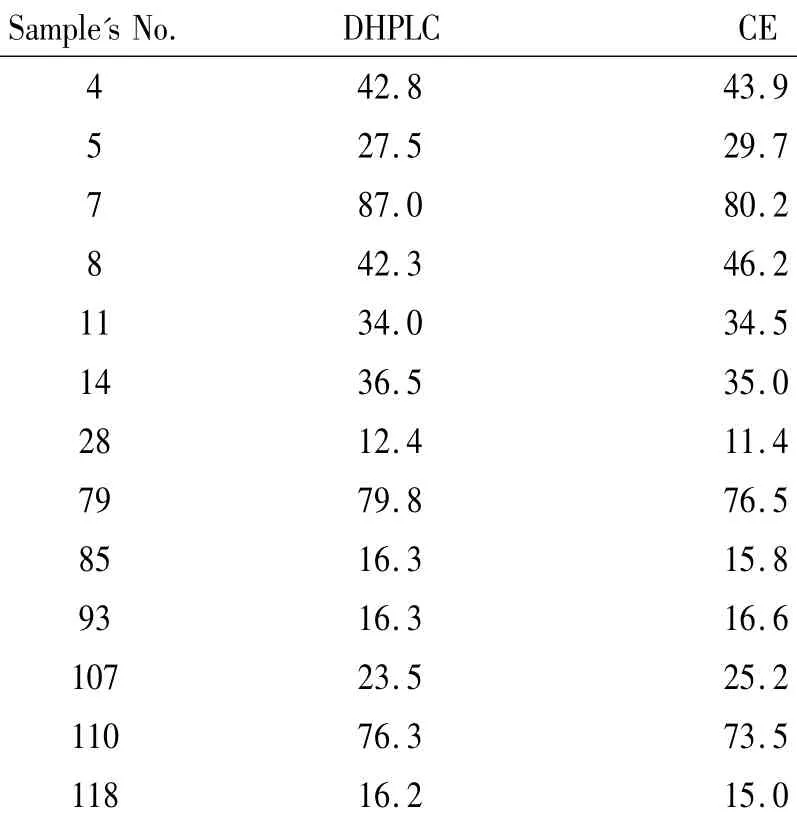
表1 DHPLC和CE定量分析FLT3-ITD突變陽性樣本的結果對比Table1.The quantitative analysis of FLT3-ITD mutation in positive samples examined with DHPLC and CE methods(%.the average for three repeative experiments)
3 2種方法結果對比
2種方法陽性定性結果吻合,陽性率是一樣的。2種方法陽性定量結果之間比較也無顯著差異(P>0.05)。
參照文獻[1],我們將突變比例分成3組。低突變 (<25%)有5例,中突變(≥25%且≤50%)有5例,高突變 (>50%)有3例。
4 測序驗證
將所得樣品進行了測序驗證,發現4號、5號、7號、8號、11號、14號,28號、79號、85號,93號、107號、110號和 118號樣品為單個串聯重復突變,插入片段大小為21-87 bp不等,均為單個插入片段。結果與DHPLC、CE檢測到的陽性結果吻合。其余108例為FLT3-ITD陰性。
討 論
AML分層治療是近年來研究的熱點,染色體核型異常的AML病例可按照WHO的標準進行分層管理,而占原發病例40%-50%的核型正常的中間型病例具有高度異質性,目前尚缺乏足夠分子標記對其進行精細的分層管理和準確的預后判斷[6]。作為最早被發現具有不良預后判斷價值的的分子指標之一,FLT3-ITD的研究最為廣泛,早幾年國內外針對FLT3-ITD定性研究較多。尹列芬等[7]已用DHPLC技術定性檢測了60例AML患者FLT3-ITD基因突變情況,認為FLT3-ITD基因突變可作為預測AML預后的一個指標。而目前這種預測價值探索深入化,有些研究者認為FLT3-ITD等位基因突變水平的不同,預后也不同;比尹列芬他們單純的定性研究更具有預后判斷價值。比如有一項采用CE的方法[1]的研究以FLT3-ITD突變等位基因水平和FLT3-ITD存在與否作為分組指標,比較分析了2組病例RR、DFS和OS,顯示前者的預測作用明顯強于后者,差異極顯著:隨著FLT3-ITD突變比例的增加,患者的RR也隨之增加,DFS和OS降低,預后則變差;低突變水平(﹤25%)患者的預后較野生型患者差,中度突變水平(25%-50%)患者的預后又較低突變水平患者差,高度突變水平(﹥50%)患者的預后最差。Bullinger等[8]研究提示對FLT3-ITD突變等位基因進行定量分析,有可能對AML進行更精細的治療分層和更準確的預后判斷。不過Thiede等[2]則認為,FLT3-ITD低突變水平患者的預后與野生型患者相比并無差別,只有高水平的FLT3-ITD突變才具有預后判斷價值。
Figure2.The analysis result of one sample using CE method.圖2 某一樣品的CE方法分析結果
所以定量檢測FLT3-ITD對日后詳細判斷正常核型AML患者預后及指導治療具有更重要的意義。但是目前多用上述的CE方法進行檢測,該方法對儀器設備要求高或技術方法上繁瑣耗時長,不利于快速判斷,為進一步探討FLT3-ITD突變等位基因水平的臨床價值,我們根據自身實驗條件,在DHPLC定性檢測基因突變功能的基礎上對FLT3-ITD突變等位基因進行定量檢測。它是一項敏感可靠的DNA分析技術[9]。FLT3-ITD基因突變運用該法的檢測是基于異源雙鏈的形成,根據PCR產物變性復性后,形成了同源雙鏈和異源雙鏈,而異源雙鏈由于堿基對不匹配,在部分變性的溫度條件下,會在不匹配的堿基對處形成部分解鏈。由于單鏈DNA帶負電荷減少,結合力弱,因此,異源雙鏈比同源雙鏈先洗脫出來。根據其在柱子上保留時間的不同,可將同源雙鏈和異源雙鏈分離。如此就可分離檢測出由于ITD的插入而引起的FLT3基因長度多態性,再通過對洗脫峰面積的計算,對FLT3-ITD突變等位基因即可進行定量分析。
應用該方法,我們成功地對121例AML樣本進行了檢測分析,對13例突變陽性的樣本進行了定量計算。為驗證DHPLC定量結果的準確性,我們采用CE的方法對樣本重復進行了分析。從表1可知,2種方法定量的結果完全一致(P>0.05),表明本研究的DHPLC定量檢測方法準確可靠、穩定。而本組的研究群體中,FLT3-ITD突變的陽性率只有10.7%(13/121),遠低于文獻報道的AML中20%-30%的陽性檢出率,正常核型AML中30%-40%[9]。而這較低的陽性率可能與樣本數量有限、地域分布局限性有關。而且,目前有研究認為FLT3-ITD定量結果不同,預后比較有顯著差異,當然,這有待我們后續進一步研究。
與以往多數采用的CE方法檢測FLT3基因突變情況相比,DHPLC除具有同CE方法一樣快速、高重復性、自動化、準確的優點外,且具有高通量、快捷、成本相對低的特點[10]。它不需要熒光標記的引物,也不需要任何PCR純化,簡化了操作步驟。經我們對比觀察,DHPLC方法檢測1個樣品所花時間不足CE方法的一半,而我們的研究又證實DHPLC的結果與CE的結果一致,更進一步證實了DHPLC方法的可行性和實效性。雖然突變比例極高時該法不如CE精確,但計算軟件中的切割峰功能能使計算結果達到較高精確性,且并不影響對高突變比例樣本界限的判定。
綜上所述,建立DHPLC技術相對定量檢測FLT3-ITD突變情況,能為急性髓細胞白血病臨床治療與預后提供了更詳盡的參考指標。
[1]Gale RE,Green C,Allen C,et al.The impact of FLT3 internal tandem duplication mutant level,number,size,and interaction with NPM mutations in a large cohort of young adult patients with acute myeloid leukemia[J].Blood,2008,111(5):2776-2784.
[2]Thiede C,Steudel C,Mohr B,et al.Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia:association with FAB subtypes and identification of subgroups with poor prognosis[J].Blood,2002,99(12):4326-4335.
[3]Noguera NI,Ammatuna E,Zangrilli D,et al.Simultaneous detection of NPM1 and FLT3-ITD mutations by capillary electrophoresis in acute myeloid leukemia[J].Leukemia,2005,19(8):1479-1482.
[4]秦效英,秦亞溱,劉艷榮,等.應用變性高效液相色譜檢測伊馬替尼治療后慢性髓性白血病患者ABL激酶區點突變[J].中華檢驗醫學雜志,2006,29(11):991-995.
[5]張之南,沈 悌.血液病診斷及療效標準[M].第3版.北京:科學出版社,2007.106-116.
[6]Schnittger S,Schoch C,Dugas M,et al.Analysis of FLT3length mutations in 1003 patients with acute myeloid leukemia:correlation to cytogenetics,FAB subtype and prognosis in the AMLCG Study and usefulness as a marker for the detection of minmal residual disease [J].Blood,2002,100(1):59-66.
[7]尹列芬,王 曄,姚 錦,等.急性髓細胞白血病FLT3-ITD基因突變的檢測及其臨床意義[J].西安交通大學學報(醫學版),2009,30(4):453-455.
[8]Bullinger L,D?hner K,Kranz R,et al.An FLT3 geneexpression signature predicts clinical outcome in normal karyotype AML[J].Blood,2008,111(9):4490-4495.
[9]Jiang A,Jiang H,Brandwein J,et al.Prognostic factors in normal karyotype acute myeloid leukemia in the absence of the FLT3-ITD mutation[J].Leuk Res,2011,35(4):492-498.
[10]李 莉,王 翀,陳瑤生.DHPLC系統工作原理及其應用[J].生物技術通報,2006(S1):120-124.

