腦膠質瘤組織中BDNF和TrkB表達及臨床意義
尹 宏,馬祁生,趙海龍,黃 欣
(青海大學醫學院,西寧 810001)
腦膠質瘤是常見的顱內腫瘤,其發病率約占全部顱內腫瘤的40%~50%,根據腫瘤細胞的分化程度和增殖潛能等可分成4個不同的等級[1],通常認為Ⅰ~Ⅱ級膠質瘤屬于低度惡性,而Ⅲ~Ⅳ級則屬于高度惡性。2008年5月~2010年6月,我們檢測了腦源性神經營養因子(BDNF)及其受體酪氨酸激酶B(TrkB)在人腦膠質瘤組織中的表達,旨在進一步探討兩者在人腦膠質瘤發生、發展中的作用。
1 材料與方法
1.1 材料 選取青海大學附屬醫院神經外科手術切除的腦膠質瘤組織標本48份(膠質瘤組),患者男25例,女23例;年齡38~73歲;≤50歲28例,>50歲20例。所有患者均經病理證實,且術前均未接受化療、放療或其他針對腫瘤的治療。按WHO病理分級法分為Ⅰ級、Ⅱ級、Ⅲ級、Ⅳ級各12例。取正常腦組織48份(正常組)作對照。兩組一般資料無統計學差異。主要試劑:兔抗BDNF和TrkB多克隆抗體(一抗,美國CHEMICON);SP試劑盒(北京中杉金橋生物技術有限公司);逆轉錄—聚合酶鏈反應試劑盒(TaKaRa公司);DNA2000(上海生工公司);瓊脂糖(大連寶生物公司);采用Primer Premier5.0軟件設計引物,引物由大連寶生物公司合成。
1.2 BDNF和TrkB蛋白檢測 采用免疫組化法。標本組織常規包埋、切片。常規的SP法染色,DAB棕色呈色,陰性對照用PBS代替一抗,其余均照說明書操作。BDNF和TrkB蛋白陽性判斷標準:在高倍鏡下隨機選擇10個視野,每個視野至少記數100個細胞,按每一切片陽性細胞比例及著色深淺計分,采用半定量積分法。BDNF和TrkB蛋白陽性著色主要定位于細胞質,以出現棕黃色顆粒者為陽性,陽性細胞著色判斷:<5%為0分,5% ~25%為1分,26% ~50%為2分,51% ~75%為3分,>75%為4分。陽性強度:無著色或與背景均勻一致的淡黃色為0分,淺棕黃色為1分,棕黃色為2分,棕褐色為3分。根據兩項指標的乘積分數進行計分,0~1分為(-),2~4分為(+),5~7分為(++),>7分為(+++)。
1.3 BDNF和TrkB mRNA檢測 采用RT-PCR法。取出凍存的新鮮標本(膠質瘤及膠質瘤旁正常腦組織各100 mg),Trizol法提取組織總 RNA,測定總RNA濃度及純度。使用Takara的M-MLV Rtase cDNA synthesis Kit(codeD6130)反轉錄合成cDNA的第1鏈,接著合成第2鏈(均照說明書操作)。將所得10 μl產物凍存于-20℃以備進行PCR。PCR反應體系 50 μl,包括 5 × Buffer 10 μl,TaqDNA 酶 0.2 μl,目的引物 BDNF 及 TrkB 上下游各 1 μl,β-actin引物上下游各 1 μl,cDNA 模板 10 μl,無菌水 25.8 μl。反應條件:95℃預變性5 min;95℃變性45 s,退火溫度55℃、60 s,72℃延伸60 s,35個循環;72℃、10 min后終止反應。PCR產物于15 g/L的瓊脂糖凝膠做電泳,以無菌水代替cDNA模板的PCR管為陰性對照,天能凝膠成像系統對電泳條帶拍照并進行半定量分析。BDNF及TrkB mRNA相對表達量以同一反應體系中目的產物電泳條帶密度指數與內參對照β-actin電泳條帶密度指數的比值來表示。
1.4 統計學方法 采用SPSS13.0統計軟件,計量資料以表示,采用t檢驗;計數資料行χ2檢驗。RT-PCR結果和免疫組化結果的相關性采用Spearman等級相關分析。檢驗水準α=0.05。
2 結果
2.1 BDNF和TrkB蛋白表達 膠質瘤組及正常組BDNF蛋白陽性率分別為 77.1%、41.7%,TrkB 蛋白的陽性率分別為81.2%、54.2%,兩組比較P均<0.05。
2.2 BDNF和TrkB mRNA表達 膠質瘤組及正常組BDNF mRNA的相對表達量分別為0.76±0.15、0.48 ±0.07,TrkB mRNA 的相對表達量分別為0.82±0.09、0.53 ±0.10,兩組比較 P 均 <0.05。
2.3 BDNF和TrkB表達與膠質瘤臨床病理參數的關系 見表1。
表1 BDNF和TrkB表達與膠質瘤臨床病理參數的關系()
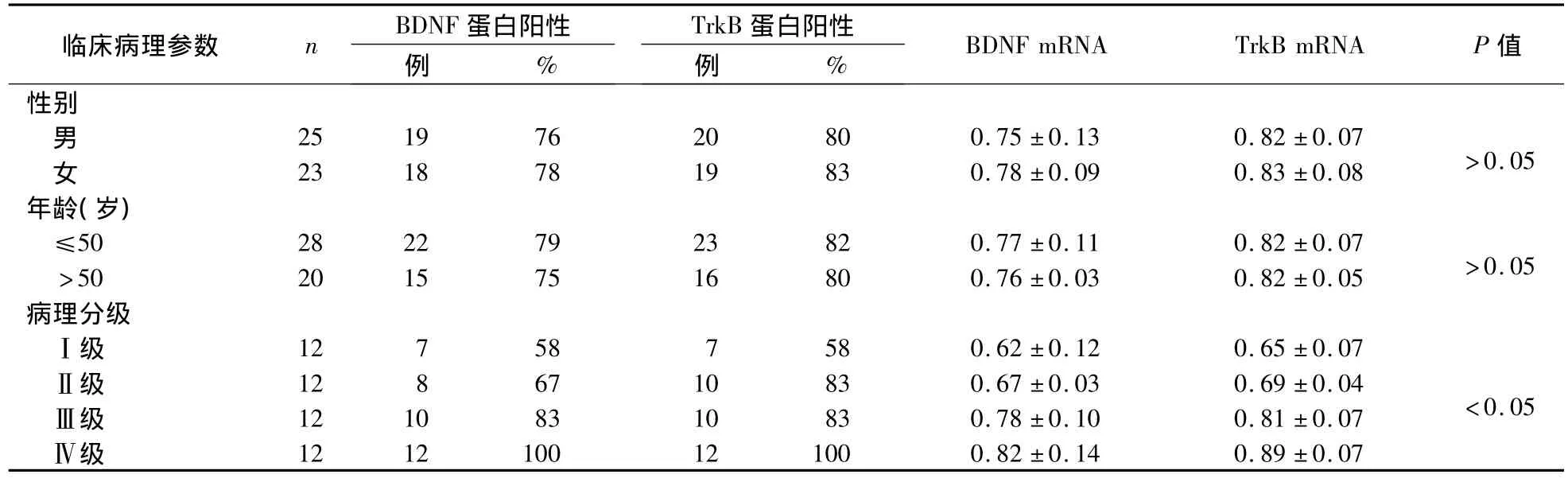
表1 BDNF和TrkB表達與膠質瘤臨床病理參數的關系()
臨床病理參數 n BDNF 蛋白陽性例%TrkB 蛋白陽性例%BDNF mRNA TrkB mRNA P 值性別男25 19 76 20 80 0.75 ±0.13 0.82 ±0.07 >0.05女23 18 78 19 83 0.78 ±0.09 0.83 ±0.08年齡(歲)≤50 28 22 79 23 82 0.77 ±0.11 0.82 ±0.07 >0.05>50 20 15 75 16 80 0.76 ±0.03 0.82 ±0.05病理分級Ⅰ級 12 7 58 7 58 0.62 ±0.12 0.65 ±0.07Ⅱ級 12 8 67 10 83 0.67 ±0.03 0.69 ±0.04 <0.05Ⅲ級 12 10 83 10 83 0.78 ±0.10 0.81 ±0.07Ⅳ級12 12 100 12 100 0.82 ±0.14 0.89 ±0.07
2.4 相關性分析 膠質瘤組 BDNF、TrkB蛋白和BDNF、TrkB mRNA 呈正相關(r=0.805,P 均 <0.01)。
3 討論
BDNF是一種在中樞神經系統內合成并廣泛存在于大腦皮層、海馬、基底前腦、下丘腦的最具活性的神經營養因子之一[2]。其通過TrkB參與細胞的增殖分化、黏著與成熟,進而促進中樞神經元的發育、存活、神經突起的生長和分支及損傷后的再生修復[3]。TrkB是BDNF的功能型受體,BDNF與TrkB結合,誘導TrkB受體形成二聚體,激活內在酪氨酸激酶活性使得胞內區酪氨酸殘基自磷酸化;活化的受體能與多個胞內蛋白質相互作用并使其磷酸化從而將胞外信號傳導至細胞內;在胞內則主要通過磷酯酰肌醇-3激酶/Akt、Ras/ERK、PLCγ等通路來發揮生物學作用[4]。BDNF能夠阻止神經細胞的凋亡,其主要通過高親和力受體TrkB發揮作用。Sugimoto等[5]在研究表達TrkB的成人神經細胞瘤的實驗中觀察,BDNF、NT-4可誘導成神經細胞瘤TrkB磷酸化,激活Ras/ERK信號轉導通路,促進細胞增殖。以往研究表明,BDNF的表達與膠質瘤的惡性程度有關[6]。本研究膠質瘤組BDNF和TrkB蛋白、mRNA陽性表達率均高于正常組,提示BDNF和TrkB與膠質瘤有關可能參與了膠質瘤的發生。本研究還發現,BDNF和TrkB蛋白、mRNA與腦膠質瘤病理分級相關,且隨惡性程度增高而增加,提示BDNF和TrkB在膠質瘤細胞內表達的高低與膠質瘤病理級別有密切關系,BDNF和TrkB的高表達在膠質瘤的發生發展過程中可能起著重要作用。
總之,BDNF和TrkB的表達可反映膠質瘤的生物學行為,可以作為判斷膠質瘤惡性程度和預后的有價值的指標。
[1]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
[2]Yan Q,Rosenfeld RD,Matheson CR,et al.Expression of brain-derived neurotrophic factor protein in the adult rat central nervous system[J].Neurosci,1997,78(2):431-448.
[3]Skup M,Dwornik A,Macias M,et al.Long-term locomotor training up-regulates TrkB(FL)receptor-like proteins,brain-derived neurot rophic factor,and neurotrophin 4 with different topographies of expression in oligodendroglia and neurons in the spinal cord[J].Exp Neurol,2002,176(2):289-307.
[4]Almeida RD,Manads BJ,Melo CV,et al.Neuroprotection by BDNF against glutamate induced apoptotic cell death is mediated by ERK and PI3-kinase pathways[J].Cell Death Diffa,2005,12(10):1329-1343.
[5]Sugimoto T,Ikuroda H,Horii Y,et al.Signal transduction pathways through TRK-A and TRK-B receptors in human neuroblastoma cells[J].J Cancer Res,2001,92(2):152-160.
[6]Aoyama M,Asai K,Shishikura T,et al.Human neurob lastom as with unfavorable biologies express high levels of brain-derived neurotrophic factorm RNA and a variety of its variants[J].Cancer Lett,2001,164(1):51-60.

