Bcl-2在RNAi-hTERT誘導HeLa細胞凋亡過程中的作用
王 建,何志巍
(廣東醫學院中美腫瘤研究所,廣東 東莞 523808)
靶向端粒酶逆轉錄酶(hTERT)是端粒酶的催化亞基,其在大部分惡性腫瘤組織細胞中均有較高活性,與癌癥的發生、發展密切相關。我們前期研究顯示,在HeLa細胞中抑制hTERT表達可下調凋亡抑制基因白血病-2(Bcl-2)的表達,并能誘導細胞凋亡[1,2]。近期,我們進行了 siRNA-hTERT 序列與pcDNA3.1-Bcl-2表達載體的共轉染,旨在探討誘導HeLa細胞凋亡的效應是否與Bcl-2有關。
1 材料與方法
1.1 材料 人宮頸癌HeLa細胞(北京中科院腫瘤研究所);siRNA-hTERT序列(上海吉凱基因化學技術有限公司);pcDNA3.1-Bcl-2真核表達載體(大連寶生物工程有限公司);轉染試劑Lipofectamine2000(Invitrogen公司);兔抗人hTERT多克隆抗體、兔抗人Bcl-2多克隆抗體和鼠抗人β-actin單克隆抗體(Santa Cruz公司);堿性磷酸酶標記的山羊抗兔和山羊抗鼠二抗(北京中杉試劑公司);其余均為進口或國產分析純試劑。
1.2 實驗方法
1.2.1 細胞培養、分組及轉染 采用含10%胎牛血清的RPMI1640培養液,置于37℃、5%CO2、飽和濕度下細胞培養箱內培養,取對數生長期細胞進行實驗。將常規培養的HeLa細胞分為6個組,A組不處理,B組轉染試劑,C組轉染空載體,D組轉染陰性siRNA,E組轉染 siRNA-hTERT,F組同時轉染pcDNA3.1-Bcl-2和 siRNA-hTERT。轉染前調整細胞濃度為1×105個/ml,接種于6孔板,每孔2 ml,達50%~60%匯合時轉染。轉染過程按照試劑盒說明書操作:DNA轉染用量為4.0 μg/孔,轉染試劑10 μl/孔;RNA 轉染用量為 100 pmol/孔,轉染試劑5.0 μl/孔。鋪板培養基為2 ml,稀釋培養基為2×250 μl。
1.2.2 細胞凋亡率檢測 采用流式細胞術。轉染后48 h,將各組細胞消化,收獲,調整待測細胞濃度為5×105~1×106/ml;取1 ml細胞,1000×g,4 ℃離心10 min,棄去上清。加入1 ml預冷的PBS,輕輕震蕩使細胞懸浮;1000×g,4℃離心10 min,棄去上清,重復兩次;將細胞重懸于200 μl預冷結合緩沖液;加入10 μl膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)避光室溫反應15 min;上機前5 min加入5 μl碘化吡啶。用FACS流式細胞儀進行檢測。
1.2.3 細胞hTERT、Bcl-2表達檢測 采用Western blot法。轉染后48 h裂解細胞提取各組細胞蛋白。用酚試劑法進行定量后,將含有等量蛋白的細胞裂解液用5×上樣緩沖液稀釋,置于SDS-PAGE(分離膠8%、濃縮膠5%)電泳分離,用半干轉方法轉移至硝酸纖維素膜,室溫下用5%脫脂奶粉封閉1 h;分別加入各種一抗(1∶1000),4℃過夜;加堿性磷酸酶標記的二抗(1∶500),37℃孵育1 h后,用堿性磷酸酶顯色液顯色后掃描成像。以hTERT/β-actin相對灰度值代表hTERT相對表達水平,以Bcl-2/β-actin代表Bcl-2相對表達水平。
1.3 統計學方法 采用SPSS11.5統計軟件,計量數據用表示,采用t檢驗。檢驗水準α=0.05。
2 結果
各組細胞凋亡率及hTERT、Bcl-2水平比較見表1。
表1 各組細胞凋亡率及hTERT、Bcl-2水平比較(n=5,)
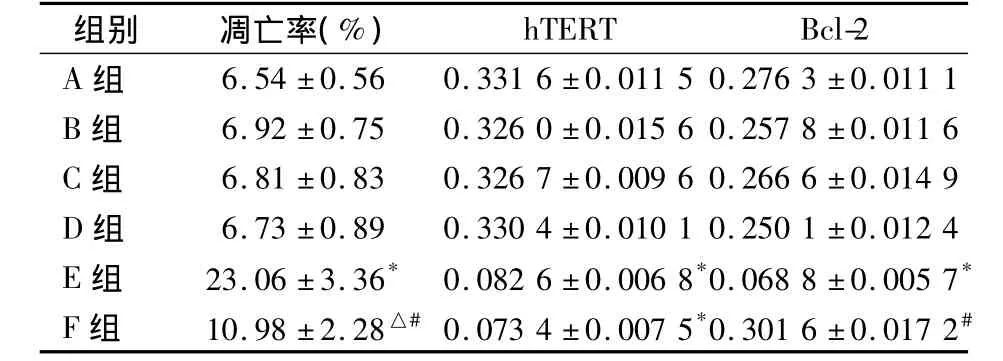
表1 各組細胞凋亡率及hTERT、Bcl-2水平比較(n=5,)
注:與 A、B、C、D 組比較,*P <0.01;與 A、B、C、D 組比較,△P <0.05;與 E 組比較,#P <0.01
A組6.54 ±0.56 0.3316 ±0.01150.2763 ±0.0111 B 組 6.92 ±0.75 0.3260 ±0.01560.2578 ±0.0116 C 組 6.81 ±0.83 0.3267 ±0.00960.2666 ±0.0149 D 組 6.73 ±0.89 0.3304 ±0.01010.2501 ±0.0124 E 組 23.06 ±3.36* 0.0826 ±0.0068*0.0688 ±0.0057*F 組 10.98 ±2.28△#0.0734 ±0.0075*0.3016 ±0.0172#
3 討論
細胞凋亡經典途徑之一的線粒體途徑由含BH3結構域的Bcl-2家族成員Bid、Bad等在接受到胞內的死亡信號后激活。這些含BH3結構域的Bcl-2家族成員與另外的Bcl-2家族成員(Bax亞家族成員Bax、Bak等,主要松散的結合在線粒體外膜表面或存在于胞質)作用,導致后者的寡聚并插入線粒體,引起線粒體膜通透性改變,跨膜電位丟失,釋放Cyt-c和其他促凋亡因子,進而啟動Caspase級聯反應,完成相應底物的剪切,引起細胞凋亡[3,4]。Bcl-2家族中的抗凋亡蛋白Bcl-2可與促凋亡蛋白形成二聚體,保護線粒體外膜的完整性,使促凋亡和抗凋亡作用相互中和,如果促凋亡蛋白占優勢,則導致促凋亡因子從線粒體調控性的釋放,從而促進凋亡,反之則抗凋亡[5]。可見,Bcl-2的蛋白水平變化與細胞凋亡過程聯系密切。
更多的研究表明,在多種腫瘤組織中,hTERT的表達與Bcl-2的表達水平呈正相關[6,7]。我們的前期研究顯示,在HeLa細胞中靶向hTERT的RNA干擾可以下調Bcl-2的蛋白水平,而且能誘導HeLa細胞凋亡。為了證明這種誘導凋亡作用是否與Bcl-2的蛋白水平下調有關,本研究將siRNA-hTERT序列與pcDNA3.1-Bcl-2表達載體共轉染HeLa細胞進行驗證。Western結果顯示,4個對照組之間的hTERT和Bcl-2的蛋白表達水平沒有明顯差異,說明轉染過程及非特異因素對蛋白表達影響可忽略不計。E組的hTERT和Bcl-2的蛋白表達水平與對照組相比顯著下調,說明實現了靶向hTERT的RNA干擾進而下調Bcl-2的蛋白表達水平。F組的Bcl-2水平與E組相比顯著性增高,說明pcDNA3.1-Bcl-2載體的轉染逆轉了RNAi-hTERT引起的Bcl-2表達下調。可見本研究的蛋白干預實驗是成功的。流式細胞術分析結果顯示,4個對照組之間的細胞凋亡率沒有明顯差異,說明轉染過程及非特異因素對細胞凋亡沒有顯著影響。E組的細胞凋亡率與4個對照組比較顯著升高,說明hTERT的蛋白表達下調可促進HeLa細胞凋亡,這與我們的前期研究結果相一致。F組的細胞凋亡率與E組比較是顯著降低的,說明Bcl-2水平的下調確實在RNAi-hTERT誘導HeLa細胞凋亡過程中發揮作用。而F組與4個對照組相比,凋亡率是顯著升高的,說明Bcl-2不是惟一在這一過程中發揮作用的凋亡相關因子。
總之,本研究進一步明確了 Bcl-2在 RNAihTERT誘導HeLa細胞凋亡過程中發揮重要作用,但不是全部作用。而其表達變化受hTERT調節的分子機制以及在這一凋亡過程中還有哪些其他因子發揮作用,還需深入研究。
[1]王建,任常山.hTERT基因沉默對HeLa細胞癌癥相關基因轉錄的影響[J].山東醫藥,2008,48(9):84-85.
[2]Wang J,Ren CS.Mechanism of induction of apoptosis by siRNA targeting hTERT in HeLa cells[J].Chin J Cancer Res,2008,20(2):115-120.
[3]Eskes R,Desagher S,Antonsson B,et al.Bid induces the oligomerlzation and insertion of Bax into the outermitechondrial membrane[J].Mol Cell Bid,2000,20(3):929-935.
[4]Miramas MD,Costantini P,Ravagnan L,et al.NADH oxidnse activity of mitechondrlal apoptesis-inducing factor[J].J Binl Chem,2001,276(19):16391-16398.
[5]Jin CY,Moon DO,Choi YH,et al.Bcl-2 and caspase-3 are major regulators in Agaricus blazei-induced human leukemic U937 cell apoptosis through dephoshorylation of AKT[J].Biol Pharm Bull,2007,30(8):1432-1437.
[6]劉亮,陳建,劉鳳軍.結腸癌中hTERT的表達及其與Survivin和Bcl-2表達的關系[J].中國現代普通外科進展,2010,13(3):173-176.
[7]鐘英強,沈溪明,李海剛,等.hTERT在人胰腺癌組織中的表達及其與COX-2、P-gp、Bcl-2蛋白表達和臨床病理特征的關系[J].中華臨床醫師雜志,2008,2(8):14-18.

