骨髓間充質干細胞抑制Wistar大鼠脊髓損傷區神經元凋亡的實驗研究
李東君,賈全章*,陳玉丙,孫景海,吳傳真,王風華,徐 爽,劉麗萍,姜大偉,高德萱
(1.解放軍第208醫院,吉林 長春130062;2.吉林大學附屬第二醫院,吉林 長春130041)
骨髓間充質干細胞(Bone Mesenchymal Stem cells,BMSCs)具有強大的增殖能力和多向分化潛能,在特定的誘導環境條件下可以向骨、心肌、神經元等多胚層方向分化[1-4]。細胞凋亡是脊髓繼發性損傷的重要形式之一,受多種凋亡相關蛋白的調控[5]。有研究報道BMSCs移植能改善脊髓損傷大鼠的運動功能[6,7]。本實驗探討BMSCs移植對脊髓損傷大鼠凋亡調控蛋白Caspase-3、Bax、Bcl-2表達。
1 材料
1.1 實驗動物與分組 清潔級Wistar大鼠120只,雌性,體重(260±20)g,隨機分為4組各30只:對照1、2組,治療1組、2組。出生5天的Wistar乳鼠(8.0-10.0 g)5只。均購自吉林大學實驗動物中心。
1.2 主要儀器與試劑 MC01751IF型CO2培養箱(日本SANYO);FACScan流式細胞儀(美國BD公司);DMEM 培養基(美國Gibco公司);胎牛血清(美國Hyclone公司);兔抗鼠CD34熒光直標抗體(美國BD公司),激光共聚焦顯微鏡(日本OLYMPUS公司),濃縮型DAB試劑盒(北京中山)。
1.3 實驗方法
1.3.1 BMSCs的提取、分離、培養 Wistar乳鼠5只,頸椎脫臼法處死,無菌下取股骨和脛骨的骨髓細胞,采用貼壁篩選法結合差速貼壁法分離、純化BMSCs,貼壁培養法進行培養,原代培養后按1∶3比例傳代共3代。
1.3.2 BMSCs的鑒定 每次傳代后行形態學觀察,并測定表面標志物的表達以鑒定細胞。
(1)BMSCs的形態學觀察 使用倒置相差顯微鏡逐日觀察原代及傳代培養的細胞,記錄細胞生長、增殖情況及形態特征。
(2)細胞表面分子表型檢測進行FACS檢測分析。細胞表面標志MHC-Ⅰ、Ⅱ常規切片(片厚5 μ m),光鏡下觀察。
1.3.3 脊髓損傷模型的建立 實驗組采用改良的Allen's打擊法建立脊髓損傷模型,術后常規方法籠內飼養護理。
1.3.4 BMSCs的移植方法
(1)治療1組采用靜脈回輸治療 于建模當天行BMSCs移植,用0.3%戊巴比妥鈉(30mg/kg)腹腔麻醉,1 ml注射器作尾靜脈穿刺,緩推注濃度為1×106個/ml的MSCs 1 ml,連續注射兩天。
(2)治療2組采用局部移植治療 于建模后縫合前用微量注射器約45度斜角將BMSCs細胞懸液沿后中央溝緩慢注人到脊髓損傷區頭側和尾側損傷臨近區域的灰白質交界處(距脊髓表面約1mm)共2點,每點5μ l,濃度為4×107/ml,留針5分鐘,醫用生物蛋白膠封閉注射孔。
1.3.5 免疫組化染色法檢測各組Caspase-3、Bax、Bcl-2的表達 按試劑盒說明書操作。
每組制作每種切片各6張,每張切片于40×10倍鏡下隨機取5個視野,mIgae-or-Plus生物醫學圖像分析系統進行圖像分析,在40×10倍鏡下對凋亡相關蛋白caspase-3、Bax和Bcl-2的免疫組化結果進行半定量的分析,計算平均灰度值。結果用均值±標準差(±s)表示,采用SPSS13.0軟件包處理數據,用t檢驗進行統計學處理。
2 結果
2.1 BMSCs體外培養的形態學特征 轉種至塑料培養瓶內的原代細胞經換液后,即可見呈單個分散或幾個細胞克隆的貼壁細胞,細胞形態較均勻,呈多邊形,立體感較強(圖1.A)。7天后,懸浮細胞、圓形血細胞明顯減少,少量梭形或紡錘樣細胞開始出現(圖1.B)。根據生長情況每4-7天進行一次傳代,傳代培養3代時,細胞形態變得較為一致,絕大部分為細長梭形細胞,也有扁平形帶突起的細胞,似成纖維樣細胞,細胞可散在生長,有明顯的梭形細胞集落呈克隆樣生長(圖1.C)。觀察表明,體外分離的BMSCs得到了進一步的純化及擴增。

圖1 Wistar大鼠BMSCs培養的形態學特征(×100)
2.2 BMSCs表面標志物的表達 流式細胞儀檢測結果見圖2,三代BMSCs基本不表達CD34、CD45,表達CD44。光鏡下見三代BMSCs基本不表達MHC-Ⅱ ,表達MHC-Ⅰ(圖3)。
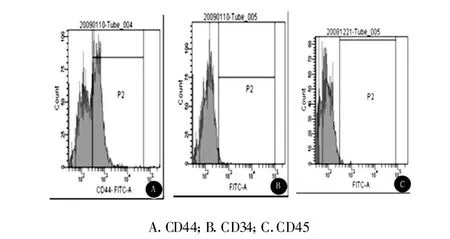
圖2 流式細胞儀測定BMSCs表面標志物的表達
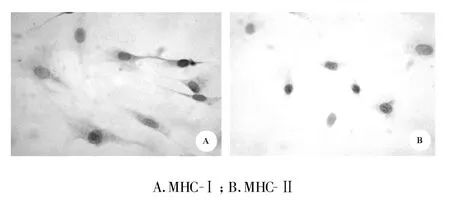
圖3 光鏡下BMSCs表面標志物的表達(×200)
2.3 BMSCs對模型大鼠脊髓損傷區 Bcl-2、Bax、Caspase-3表達的影響 結果見表1、圖4。
3 討論
神經細胞的凋亡在脊髓損傷中占重要地位,脊髓損傷后不但存在急性期的細胞壞死,也存在亞急性的細胞凋亡。Emery等[8]首先證實了在人類創傷性脊髓損傷后存在細胞凋亡。此后,對嚙齒類動物脊髓損傷模型的研究也證實了細胞凋亡在脊髓損傷中的作用[9]。Li等[10]的研究發現SCI后長纖維束軸突表達Bcl-2,但凋亡的少突膠質細胞未見Bcl-2的上調。在凋亡信號傳導過程中,通常認為Bcl-2作用于Caspase-3的上游,通過抑制Caspase-3激活而發揮作用。
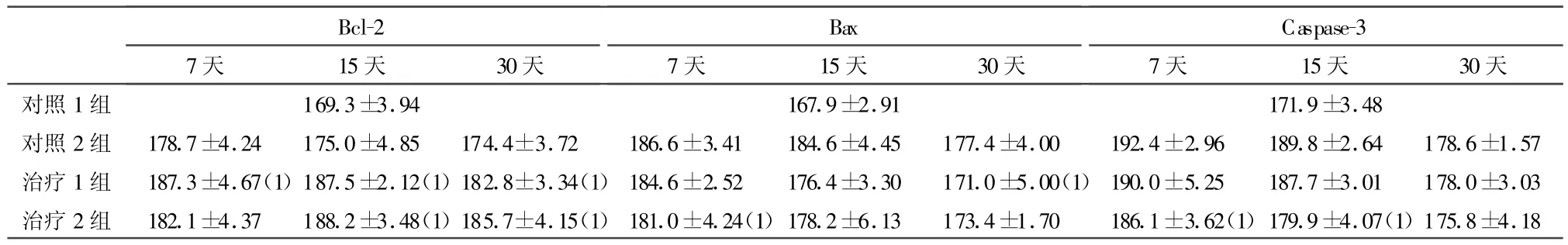
表1 各組術后損傷區Bcl-2、Bax、Caspase-3表達
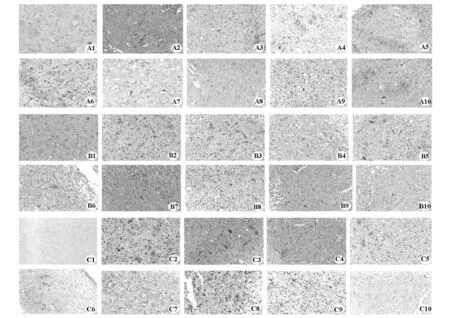
圖4 各組不同時間點凋亡調控蛋白(Bcl-2、Bax、Caspase-3)的表達(DAB,×100)
Caspases家族對細胞,特別是神經元凋亡程序的啟動具有核心作用。它直接水解激活與DNA斷裂等凋亡特征性改變密切相關的蛋白,又稱為死亡蛋白酶。迄今已發現14個家族成員,其中Caspases-3是凋亡過程中最重要的蛋白酶,是多種凋亡途徑的共同下游效應部分,是細胞凋亡蛋白酶級聯反應的必經之路[11]。Bcl-2家族已有成員達15種之多,包括凋亡抑制基因(Bcl-2,bcl-XI等)和促進凋亡基因(Bax,Bac等),它們共同組成一個細胞凋亡調控體系,在調節神經細胞凋亡過程中起著重要作用。研究發現,脊髓損傷后Bcl-2蛋白僅有少量表達,而Bax蛋白大量表達。說明脊髓損傷后促進凋亡因子占優勢,而保護因子不足從而使神經細胞向凋亡相關基因的表達,如何調控凋亡相關基因表達,對保護神經元也具有重要意義。
本研究發現,通過靜脈或局部移植的BMSCs,在不同時間點可不同程度的上調Bcl-2蛋白表達,下調Caspase-3、Bax表達,具有抗凋亡作用。兩移植組間因處理因素不同,無比較意義。細胞凋亡是一很復雜的機制,涉及許多基因的調控及眾多凋亡因子介導的信號轉導過程,因此BMSCs對細胞凋亡的作用機制還需通過基因及細胞信號轉導等角度進行更深層次的研究以闡明其機理。進一步研究凋亡發生的調控機制并利用細胞凋亡規律有效地調控細胞凋亡是治療脊髓損傷的新思路、新途徑。而通過不同方法移植BMSCs獲得陽性結果也為其在臨床應用上奠定了基礎。
[1]Prockop DJ.Marrow stromal cells as stem cells for non-hematopoietic tissues[J].Science,1997,276(5 309):71.
[2]PittengerMF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5 411):143.
[3]Azizi SA,Strokes D,Augelli BJ,et al.Engraftment and migration of human bone marrow stromal cells implanted in the brain of albino rats similarities to astrocyte grafts[J].Proc Natl Acad SciUSA,1998,95(7):3908.
[4]Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mousebrains[J].Proc NatlAcad Sci SUA,1999,96(19):10.
[5]ChrysisD,Calikoglu AS,Ye P,et al.Insulin-like growth factor-1 overexpression att-enuates cerebralapoptosis by altering the expression of Bcl family protein in a de-velopmentally specificmanner[J].J Neurosc,2001,21:1481.
[6]De Haro J,Zurita M,ayllon L,et al.Detection of in-oxine-labeled bone marrow stromal cells after intravenods or intralesional administration in chronic paraplegic rat[J].Neurosci Lett,2005,377:7.
[7]Zurita M,Vaquero.Bone marrow stromal cells can achieve cure of chronic paraplegic rats;functional and morphological outcome one year after transplantation[J].Neurosci Ixtt,2006,402;51.
[8]Emery E,.Aldana P,Bunge MB,et al.Apoptosis after traumatic human spinal curd injury[J].J Neurosurg,1998,89:911.
[9]Casha S,Yu WR,Eehlings MG.Oligodendroglial apoptosis occurs along degenerating axon,and is associated with FAS and p75 expression following spinal cord injury in the rat[J].Neuroscience,2001,103:203.
[10]Li CL,Brudin G,Farooque M,et al.Apoplosis and expression of Bcl-2 after compression trauma to ral spinal cord[J].J Neuropathol Exp Neurol,1996,55:280.
[11]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion us ing the NYU weight drop device versus transaction[J].Exp Neurol,1996,139:244.

