中國紅豆杉內生放線菌En-1的分離、鑒定及其次生代謝物的研究
林嵐,李靖
東南大學醫學院生物工程系,江蘇 南京 210009
植物與微生物的關系多種多樣,植物相關的微生物包括菌根菌(多為真菌)、根際微生物、病原菌、內生菌等等。植物內生菌是生活在健康植物活體內、不會導致宿主出現病害癥狀的微生物[1],內生菌類群涵蓋細菌、放線菌以及真菌。在不同的宿主植物體內存在不同種類的內生菌,它們對宿主的選擇存在一定專一性。其共同特征是能定殖在健康植物細胞間隙或細胞內, 并與宿主植物建立和諧的共生關系。
紅豆杉Taxus又名紫杉,是公認的瀕臨滅絕的天然珍稀植物[2]。作為抗癌藥物紫杉醇的重要生源,紅豆杉一直倍受藥學家、天然產物化學家的重視。自20世紀90年代Strobel等[3]從短葉紅豆杉中分離得到一株產紫杉醇的內生真菌以來,紅豆杉內生菌分離與研究成為一個熱點,許多內生真菌相繼被分離得到。
目前紅豆杉內生菌的研究方面,內生細菌的報道遠少于內生真菌,放線菌的報道更少,迄今僅見于意大利學者Quaroni S.研究團隊[4-5]和中國學者Wu et al[6]的研究文章。基于此,本文著手從藥用植物紅豆杉嫩枝與葉中分離內生的原核微生物(細菌、放線菌),并圍繞一株內生放線菌En-1展開研究,優化其培養條件,并對其次生代謝產物的結構和抗菌活性進行篩選,為發現結構新穎和活性獨特的內生菌代謝產物奠定良好基礎,而且為研究內生菌是否影響植物藥用成分(如紫杉醇及其前體)的生物合成相關研究提供新的切入點。
1 材料與方法
1.1 材料
1.1.1 實驗材料
采自中山植物所藥用植物園的中國紅豆杉Taxus chinensis莖、葉;供試菌大腸桿菌Escherichia coli、金黃色葡萄球菌Staphyloccocus aureus、枯草芽孢桿菌Bacillus subtilis、白色念球菌(又名:白假絲酵母)Canidia albicans、黑曲霉Aspergillus niger均為本實驗室保存的中國藥典標準菌株,分別代表G-腸道菌、G+球菌、G+桿菌、酵母狀真菌和絲狀真菌。
1.1.2 試劑
卡那霉素、制霉菌素、吐溫-20均購自上海生工公司,苯酚購自國藥集團化學試劑公司,NaClO溶液(有效氯含量34.0%~46.0%)、乙醇購自南京化學試劑有限公司。
1.1.3 培養基
高氏一號合成培養基、PDA培養基和牛肉膏蛋白胨培養基成分及配制參見文獻[7]。
1.2 方法
1.2.1 樣品預處理、表面消毒和內生菌分離
紅豆杉嫩枝和葉用自來水流水沖洗后,在加有3~4滴吐溫-20的水中浸泡20~25 min,再用流水沖凈。然后依次 φ=75%乙醇(1 min)、w=2.0%次氯酸鈉(20 min)、φ=75%乙醇(1 min)處理,乙醇、次氯酸鈉兩種消毒劑處理之間以無菌水清洗3遍,最后無菌水清洗3~4遍,無菌濾紙吸取多余水分。
將上述植物材料表面消毒的末次清洗的無菌水作為對照,與植物樣本的葉汁(0.1 mL)在同等條件下鋪板,以檢查表面消毒的徹底性;同時將經表面消毒的一批植物材料取幾個平行樣,以其外表面分別在牛肉膏蛋白胨培養基和高氏1號合成培養基平板上輕緩滾動后移走,目的也是檢查表面消毒是否徹底。
將表面消毒的植物材料用無菌剪刀剪碎, 置于無菌研缽內,加10 mL生理鹽水研磨充分并靜置5~10 min,吸取1 mL清亮的葉汁移至另一無菌試管,依次10倍稀釋,得到一系列稀釋液,分別進行涂板(0.2 mL/平板)。每個稀釋度的樣品,做3個重復[9]。分離內生細菌,采用含50 μg·mL-1制霉菌素(以抑制真菌生長)的牛肉膏蛋白胨培養基[10];分離內生放線菌,采用含50 μg·mL-1卡那霉素、50 μg·mL-1制霉菌素、φ=0.25%酚(以抑制真菌和細菌的生長)的高氏1號合成培養基[9-10]。上述抗生素各自配成100 mg·mL-1的貯存液, 并經0.22 μm濾膜除菌。在分離到的內生菌中,有一株放線菌(命名為En-1)引起特別關注,其菌落形態、顯微觀察 (參見1.2.2) 和產土腥素能力提示En-1為鏈霉菌。將該菌株凍存于φ=20%甘油中(-70 ℃)。
1.2.2 內生放線菌的顯微觀察
采用插片法制作放線菌 En-1自然生長情況下的鏡檢片[7],在光學顯微鏡下觀察放線菌的菌絲和孢子, 并拍照。
1.2.3 內生菌En-1的分子生物學鑒定
以放線菌通用引物 F-primer (5’-AGAGTT TGATCMTGGCTCAG) 和 R-primer (5’-TACG GYTACCTTGTTACGACTT) PCR擴增全長的16S rRNA 基因(~1.5 kb)。PCR 反應體系(50 μL):1 μL F-primer (20 μmol·L-1),1 μL R-primer (20 μM),5 μL 10×酶緩沖液(不含 Mg2+),4 μL dNTPs (2.5 mmol/L),3 μL MgCl2(25 mmol·L-1),0.5 μL Taq 酶(5 U·μL-1)和 1 μL 模板 DNA 及 34.5 μL MiniQ 超純水。PCR 反應參數:94 ℃ 5 min;95 ℃ 40 s,52 ℃30 s,72 ℃ 2 min,27 個循環;72 ℃延伸 5 min。瓊脂糖凝膠電泳檢測擴增的目的條帶。純化的PCR產物由南京金斯特生物科技公司進行 16S rDNA測序。
將獲得的16S rDNA序列通過Blast在GenBank上進行相似性序列檢索,將其序列與其高同源性(>99%)的已知菌株16S rDNA序列在Mega 4.0軟件中進行分析,用neighbor-joining方法構建系統發育樹。
1.2.4 紅豆杉浸出液對En-1菌生長的影響
紅豆杉針葉沖凈后,加入裝有適量雙蒸水的500 mL三角瓶中煮沸15~20 min,經過濾得到宿主植物浸出液。以添加宿主植物紅豆杉針葉浸出物的培養基作為實驗組,未添加的培養基作為對照組,分別進行內生放線菌的震蕩培養。培養1周后,離心法收獲菌體,稱量菌體鮮質量、干質量(以其生物量為生長指標),比較實驗組和對照組的生長量,以考察宿主植物針葉浸出物是否影響內生放線菌En-1的體外生長。
1.2.5 En-1菌發酵液上清的抗菌活性測試
將滅菌的瓊脂培養基完全融化倒在培養皿內,待其凝固作為下層。然后將融化的營養瓊脂冷至約50 ℃混入供試菌,將混有供試菌的培養基約10 mL加到已凝固的下層瓊脂上待凝(上層)。再在上層含菌培養基對稱放置4個牛津杯,杯中加入離心收集的、并經濾膜(0.22 μm)除菌的En-1菌培養13~14 d的發酵液上清0.2 mL,置適宜溫度下培養(若供試菌為細菌,則37 ℃培養18~24 h;若供試菌為真菌,則28 ℃培養28~48 h),觀察抑菌圈大小。
1.2.6 內生放線菌的液體培養與粗提取物
內生放線菌En-1分別接種于高氏1號、PDA液體培養基各1 L,每500 mL液體培養基接入8小塊含孢子的瓊脂塊 (4 mm×4 mm),于28 ℃,140 r/min振蕩培養13~14 d后,收獲培養物。離心,棄沉淀,收集上清。將合并的上清分別用等體積的乙酸乙酯萃取有機成分,然后在旋轉蒸發儀(EYELAN-1000)蒸去乙酸乙酯,再通過除鹽、除蠟后,得到的樣品即為粗提取物。
“山高皇帝遠啊,我就給你說,我們這兒擺個攤兒……政府都要管制你的,他們(購物店的人)不管的,人民幣,實話實說。”○15四川省松潘縣川主寺鎮商店店主。
1.2.7 液體培養基的優化以及抗菌活性測試
采用不同C、N源與pH值的組合#1–9(見表1),除了表中成分外,培養基中其余成分如下:K2HPO4·3H2O 0.5 g·L, NaCl 0.5 g·L, FeSO4·7H2O 0.01 g·L-1, MgSO4·7 H2O 0.5 g·L-1, 每種配方設 3 個重復,分裝于250 mL三角瓶中。搖瓶接種、振蕩培養以及培養物的提取方法, 同1.2.6。將不同培養基中發酵產物的粗提物各20 mg分別溶于1 mL甲醇: 水(50:50,體積比),經0.22 μm濾膜除菌后,取0.2 mL用于牛津杯抗菌測試, 同體積(0.2 mL)的φ=50%甲醇作為對照。
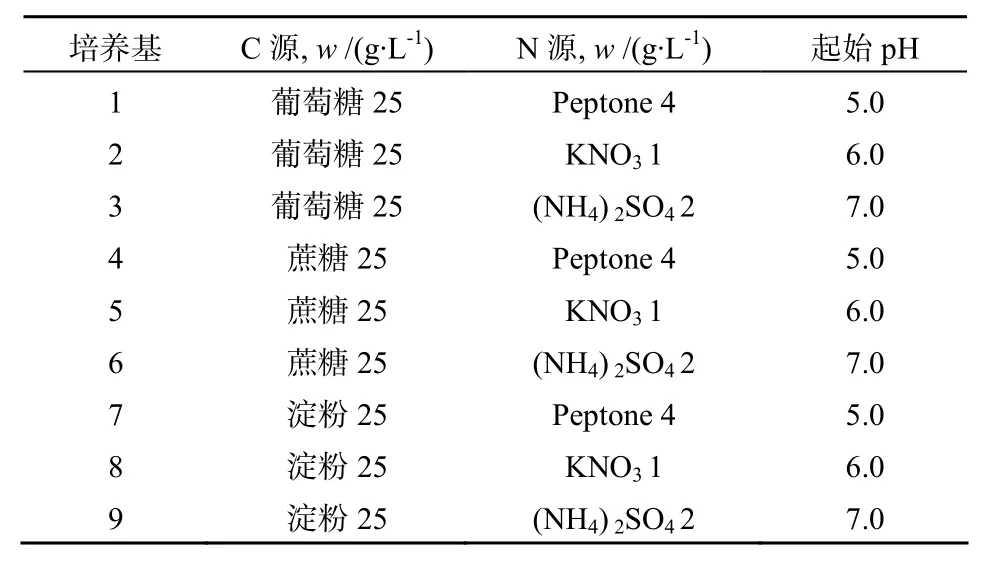
表1 內生放線菌的發酵培養基優化
1.2.81H-NMR測試
采用1H-NMR測試法對內生菌粗提物的結構多樣性進行篩查。5~10 mg的粗提物溶于氘代氯仿(1H-CHCl3)或氘代二甲亞砜(1H-DMSO)溶劑,以四甲基硅烷(TMS)作為內標,在Bruker DRX-500核磁共振儀進行波譜測定。
1.2.9 統計學分析
1.2.4 中實驗組和對照組En-1菌生物量的數據處理采用Excel軟件計算Mean ± SD, 并用SPSS 17.0進行差異顯著性分析,P <0.01被認為差異顯著。
2 結果與分析
2.1 內生放線菌的分離純化與顯微觀察
通過設計選擇性培養基,分離得到了3株內生細菌和1株放線菌。其中放線菌(命名為En-1)引起關注,因為放線菌次生代謝物極具多樣性,迄今發現的抗生素有2/3來源于放線菌, 而且有關紅豆杉內生放線菌的研究報道尚少見。放線菌En-1,在高氏1號合成培養基上生長良好,幼齡時為淺灰色、表面干燥的小菌落,在生長中期,菌落顏色加深并且其上出現白色孢子堆,菌落表面出現皺褶,而培養基因為En-1分泌的色素呈現淺褚色(圖1a),隨菌齡增長,色素顏色轉深,變成紅褐色。這株放線菌在PDA平板上生長,呈表面濕潤的淡黃色菌落,無色素分泌。但在接種時,發現其菌落與PDA培養基結合致密,不易用接種環挑取。可能PDA培養基不利于該菌產孢。一般而言,高氏1號合成培養基是公認的放線菌生長的適宜培養基。
放線菌在經過了生長旺盛期后,進入次生代謝(一般13~14 d)。色素為典型的放線菌次生代謝產物,故我們可通過色素的合成和分泌,判斷放線菌是否處于次生代謝階段。高氏1號合成培養基中碳源是淀粉,適于放線菌產孢。孢子堆積,使放線菌菌落形態呈現干粉狀。在顯微鏡下觀察,清晰可見波曲狀的孢子鏈以及散落的單個圓形孢子, 孢子表面光滑(圖1b)。綜合平板培養特征、產生揮發性的土腥素(賦予其特殊的土腥味)和顯微觀察, 初步鑒定該菌為鏈霉菌屬。
2.2 基于16SrDNA序列的內生放線菌En-1鑒定
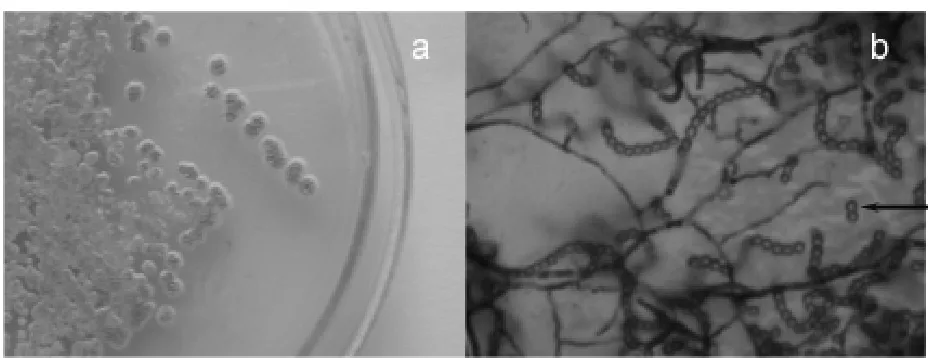
圖1 內生放線菌En-1的平板培養和孢子的顯微觀察Fig. 1 The plating culture of endophytic actinomycete En-1 and microscopic observation of its spores
序列結果在Genbank上Blast比對后,構建的系統發育樹如圖2所示。基于16S rDNA序列的系統發育分析表明,與En-1菌株親緣關系最近的是Streptomyces pseudogriseolus和 Streptomyces althioticus,可以確定En-1菌株為鏈霉菌Streptomyces sp.。
2.3 宿主植物浸出液促進內生放線菌En-1生長
通過添加浸出物(添加組)和未加浸出物(對照組)的搖瓶培養物生物量之比較,可考察宿主植物浸出液對內生放線菌菌體生長的影響。如圖3所示,添加組中放線菌鮮質量、干質量均大于對照組(P<0.005),表明宿主組織浸出物對其該菌的初生代謝(菌體生物量)有極顯著的促進作用,提示在自然生境中內生菌在宿主植物體內定殖有利于其自身生長增殖。
2.4 內生放線菌En-1發酵產物的抑菌活性
內生放線菌En-1在高氏1號培養基中震蕩培養13 d,得到發酵液上清,通過瓊脂擴散法測試其抑菌活性。5株供試菌分別為 3株細菌[大腸桿菌(G-)、金黃色葡萄球菌和枯草桿菌(G+)]、1株酵母狀真菌(白色念球菌)、1株絲狀真菌(黑曲霉)。以上供試菌因其非致病性和標準性,常用作實驗室篩選人或動物病原菌的抗生素的敏感菌株。實驗結果表明(圖4),在黑曲霉平板上牛津杯放置的周圍出現明顯的抑菌圈,而其它的供試菌平板上沒有出現可見的抑菌圈,說明 En-1菌發酵液上清對黑曲霉生長具有抑制作用。提示 En-1菌能產生抑制絲狀真菌生長的次生代謝物,因而該菌可作為進一步提純抗絲狀真菌化合物的資源菌。
2.5 內生放線菌En-1液體培養與粗提取物
該放線菌En-1在高氏1號合成培養基的搖瓶培養物, 經離心、乙酸乙酯萃取,有機相呈亮黃色,多次萃取,至萃取相無色。該菌在 PDA搖瓶培養物, 經同樣處理,萃取相呈灰黃–土黃色,萃取一次即可。提示該菌在高氏1號比在PDA培養基中產生更具多樣化的次生代謝物。這點也由粗提物的NMR譜圖(圖5)佐證。
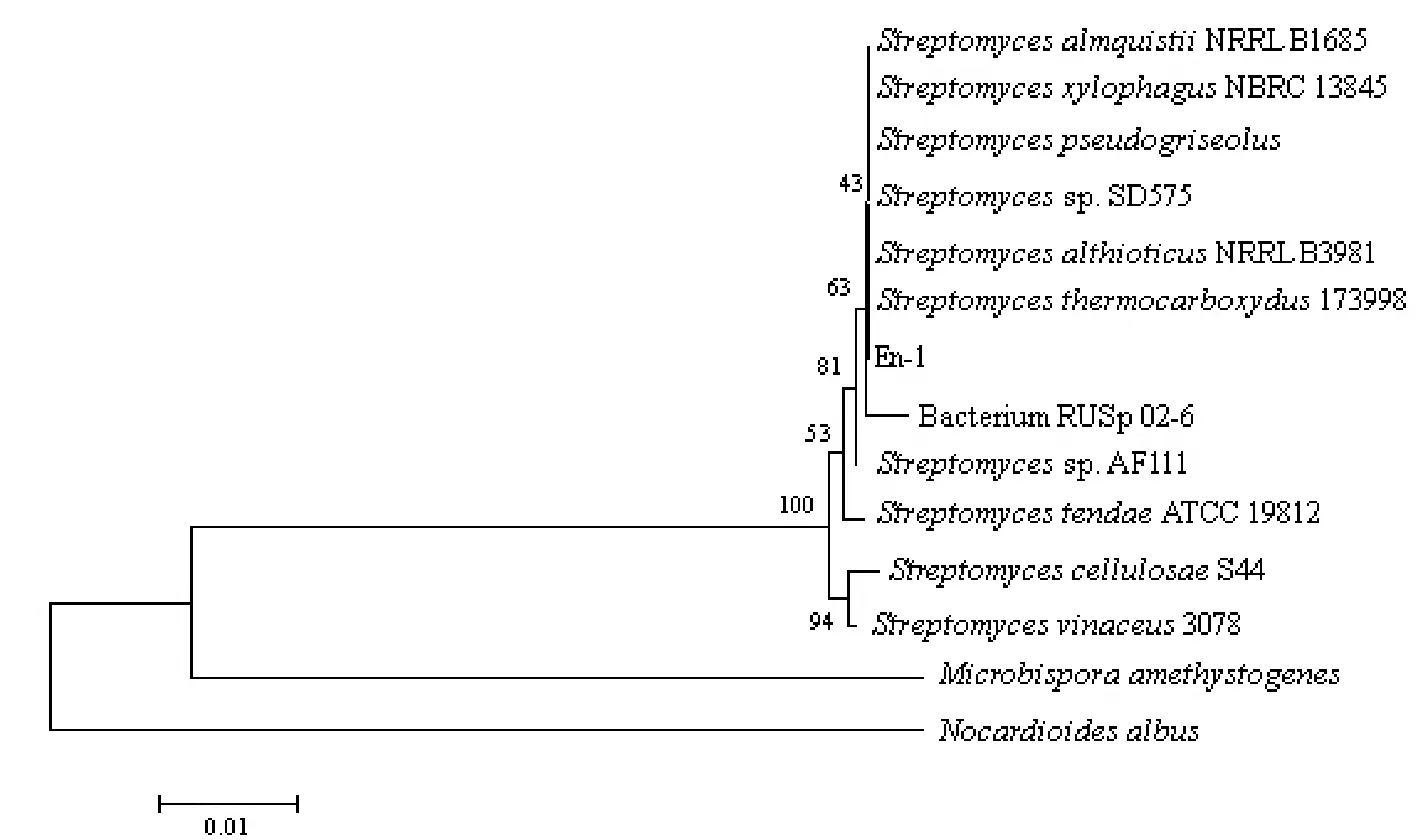
圖2 基于16S rDNA序列的內生菌株En-1的系統發育樹Fig. 2 The phylogenetic tree of endophytic actinomycete strain En-1 based on 16S rDNA sequences
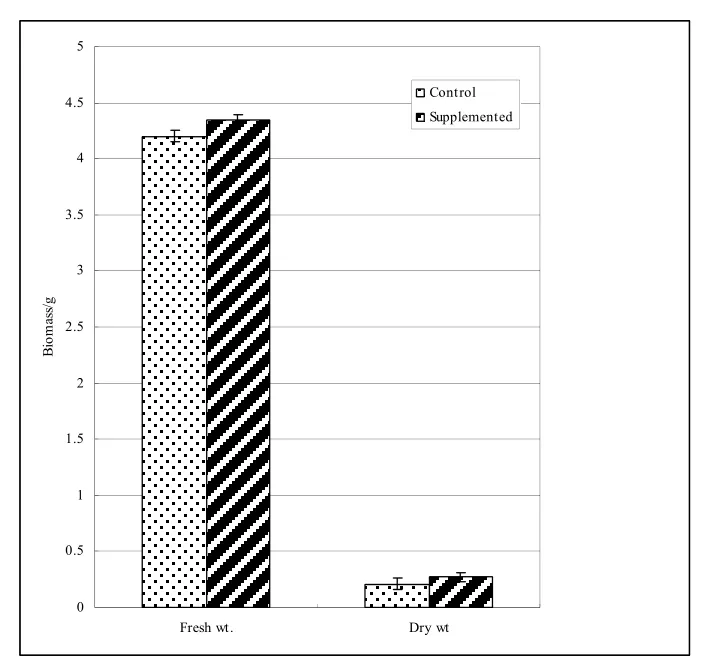
圖3 紅豆杉針葉浸出物對內生放線菌En-1生長的影響Fig.3 The effects of Taxus needle leaf extracts on the biomass of En-1
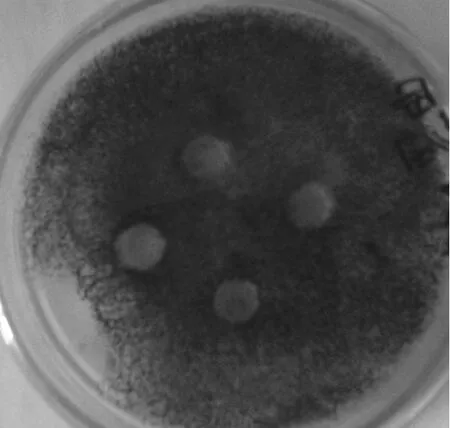
圖4 內生放線菌En-1發酵產物的抑菌活性測試Fig. 4 The inhibitory effects of the En-1 fermentative products against Aspergillus niger
2.6 培養條件的優化
在9種不同培養基配方中,#1–3配方均以葡萄糖為碳源,第#1、#3培養基中該菌發酵產物的結構多樣性明顯優于#2培養基(圖6a, 6c vs圖6b)。#4–6配方均以蔗糖為碳源,第#4、#6培養基中該菌發酵產物的結構多樣性(圖 6d, 6f)明顯少于#5培養基(圖 6e);#5中的發酵產物(圖 6e)在 δH5.0~5.5有一吸收峰, 可能是-C=C-上的不飽和H所致; #5中發酵產物在δH8.0左右有多個小峰, 可能是芳烴上的氫或者-N-H-、-OH基上的活潑氫所致,而且δH3~4間出現多峰。
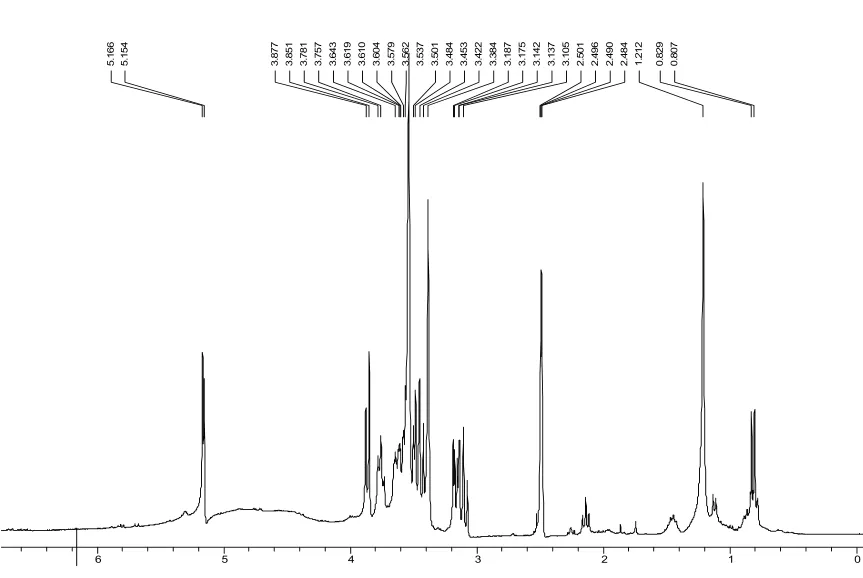
圖5 內生放線菌En-1的乙酸乙酯粗提物的1H-NMR譜Fig. 5 The spectrum of ethyl acetate extracts of the fermentative filtrate of En-1 strain by 1H-NMR analysis in which the specimens were dissolved in 1H-DMSO and TMS was used as internal standard
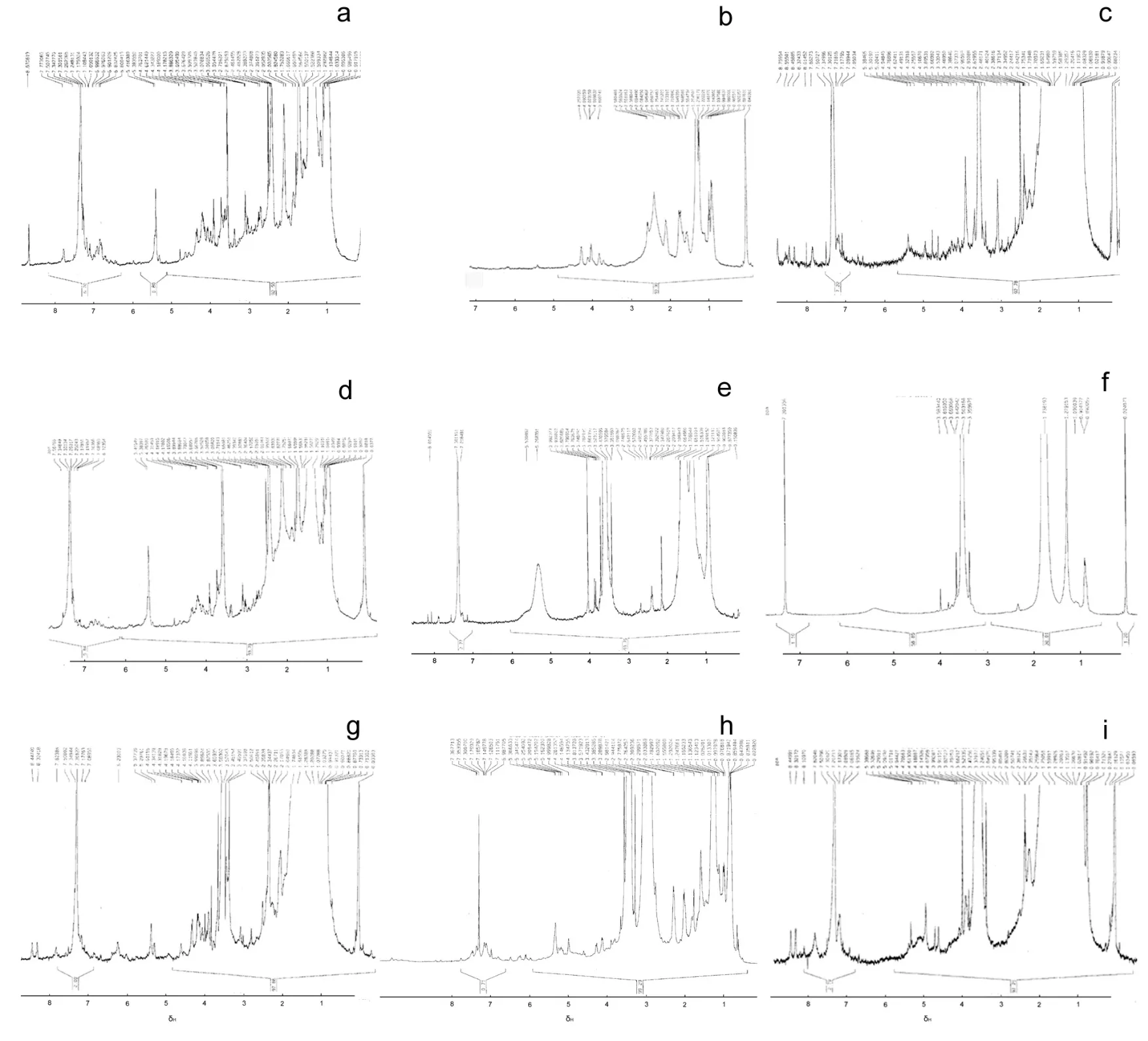
圖6 內生放線菌En-1在不同培養基中發酵液粗提物的1H-NMR圖譜Fig. 6 The 1H-NMR spectra of crude extracts derived from fermentative products of En-1 in different culture media with altered formulations
#7–9配方均以淀粉為碳源,#8培養基中發酵產物的結構多樣性(圖 6h)明顯優于#7和#9(圖 6g,6i)。如圖所示,#8中發酵產物的NMR譜(圖6h)在δH3.5~5.0間有多個小峰, 按常理推斷是糖基所致,但是 NMR測試之前樣品以乙酸乙酯萃取, 后續處理也沒有帶入水相成分, 再之,培養基中碳源物質為淀粉(多聚物), 若淀粉被微生物分解產生少量葡萄糖等單糖成分, 也會作為速效碳源優先于遲效碳源(淀粉)被菌吸收和代謝, 況且收獲發酵液時該菌已處于次生代謝期, 因此排除了該處信號峰來自培養基成分殘留的可能性。文獻[19]認為,δH3.5~5.0間的多重峰也可能來自C聯O上的或C聯N上的H。#8產物在δH5.0~5.5間的吸收峰可能來自不飽和鍵-C=C-上的H; 在δH6.0~8.0之間,除溶劑 CDCl3造成的吸收峰之外, 還有多個小峰, 提示苯環氫的存在; δH大于8.0的低場區還有很小的峰。總之,#8配方適于該菌次生代謝產物的產生,其產物的化學結構表現出多樣性。
對不同培養基配方#1– #9中的En-1菌發酵液上清進行牛津杯抗菌試驗。結果表明(圖7),來自#7、#8、#9配方的放線菌En-1產物具有抑制黑曲霉的活性,以#8配方中產物的抑菌圈直徑最大;而其它培養基配方中 En-1菌次生代謝物則無抑菌圈出現。
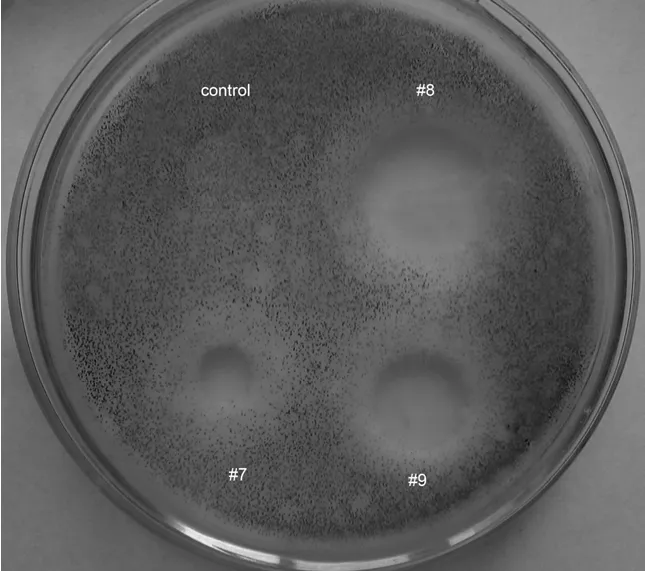
圖7 En-1菌在不同培養基中發酵產物的抗菌活性測試Fig.7 The anti-microbial effects of the En-1 fermentative products derived from different culture media
基于以上結構篩查和抗菌測試結果,#8配方為En-1菌次生代謝物的最佳發酵培養基。
3 討論
在內生菌的分離過程中, 植物樣本的預處理步驟至關重要。我們用流水沖洗去掉植物材料表面的塵土,再以添加表面活性劑的水溶液處理材料表面,以便酒精、漂白粉溶液更好移去含蠟質的植物樣本(如針葉)上附生菌。本文采用w=2.0%NaClO溶液處理20 min,優于HgCl2稀溶液短時處理的效果。丁小維等[11]用 w=0.1% HgCl2溶液浸泡 8 min來處理紅豆杉的莖,分離得到2株內生細菌,但該文獻未見內生放線菌的報道。我們采用相對溫和的NaClO代替HgCl2作為主要消毒劑,避免HgCl2對植物組織的毒性,而且能達到預期消毒效果。我們采取的表面消毒程序經兩種不同方法(末次清洗的水樣涂板、植物樣本滾動的平板培養對照實驗)的驗證,是徹底的、有效的。通過選擇分離培養方法得到4株原核微生物,其中1株放線菌經鑒定為鏈霉菌Streptomyces sp.。
通過1H-NMR技術測定產物的化學結構,可知放線菌隨培養條件變化,其次生代謝產物的結構也發生改變。雖然波譜分析的仍是混合物,但能給出重要結構信息:通過各成分所含H的不同化學位移(δ),推斷放線菌次生代謝物的結構多樣性;提示我們在篩選新化合物時,有目的進行發酵條件的優化。一般而言,菌體增長快的時期(生物量快速積累時期)絕非該菌次生代謝物合成旺盛的時期,初生代謝和次生代謝的不同步是我們在進行次生代謝物研究時必需考慮的重要因素[12-13]。可通過改變培養條件,使微生物從初生代謝轉入次生代謝,產生多樣化的次生代謝物;也可通過一些前體飼喂或誘導子處理,提高人們所需要的次生代謝物的產量;還可通過基因工程方法改造微生物次生代謝途徑中關鍵酶,使微生物過量合成和/或積累某種次生代謝物[14]。
內生菌次生代謝產物的化學結構多樣性蘊藏著生物活性的多樣性,在制藥業、農業上具有重要的應用潛力。放線菌作為藥用化合物的重要來源,倍受學者和研發人員的重視[15]。從傳統來源比如土壤放線菌中篩到的新藥物的速度正在減緩[16-17],重復分離到已知化合物的幾率在不斷上升,因此尋找新的放線菌來源變得極為重要。植物內生放線菌因其生長在植物活體內,生態環境獨特,與宿主植物共同進化并定殖于宿主組織細胞間隙或細胞內的放線菌必然有獨特的策略來競爭和生存,通常它們會分泌化學物質或信號分子來獲取營養(但對宿主植物不會產生有害影響,二者和平共處)、或者通過誘導宿主產生新的代謝產物來抵御逆境,爭取生存資源,這使得內生放線菌成為結構新穎和療效獨特的藥物先導化合物的重要資源之一。
在這一資源庫中往往會發現一些全新的應用價值很高的抗菌化合物。Strobel研究小組近年曾在澳大利亞北部土著部落附近的藥用植物蛇藤Kennedia nigriscans中分離到一株新的鏈霉菌 Streptomyces NRRL 30562,該菌能產生新穎的多肽抗生素munumbicins A、B、C和D,這些抗生素具有廣譜抗菌以及抗瘧原蟲活性[19]。同一研究小組隨后從澳大利亞北部的有葉蕨類植物Grevillea pteridifolia中分離到一株新的內生鏈霉菌Streptomyces sp. NRRL 30566, 它能產生一種具有廣譜抑菌活性的新型抗菌素kakadumycins, 特別針對G+細菌抑菌能力強,因此對治療耐藥性 G+菌引起的感染癥有重要價值[20]。這些都彰顯了利用植物內生放線菌篩選藥用抗菌活性物質的巨大潛力[6,21]。
本文報道的內生鏈霉菌En-1能產生抑真菌活性的次生代謝物,具有較大的應用潛力。因為En-1生活在植物體內、不對植物產生危害作用, 其產物經過與植物(高等生物)漫長的共進化過程,證明是對高等真核生物是無毒的,即宿主植物作為內生菌代謝產物的天然毒性選擇系統,推斷后者對于高等真核細胞的生物安全性。有研究認為[18], 以內生菌為資源庫,獲得對人類細胞低毒藥劑的幾率將大大增加。En-1菌分泌抗絲狀真菌的代謝物,對于宿主植物而言是有益的,為該裸子植物(紅豆杉)提供抵御真菌感染的物質基礎。今后需要進一步對該菌抗菌活性物質的化學結構進行研究以及探明其抑菌機理,特別是活體內(in vivo)抑菌機制。
4 結論
通過選擇性分離方法從表面消毒的中國紅豆杉嫩枝、葉中分離得到內生鏈霉菌En-1。實驗表明宿主紅豆杉葉浸出物能促進 En-1菌的體外生長,而且該菌次生代謝物對5株標準供試菌中的黑曲霉具有抑制活性。En-1菌株發酵培養基優化實驗并結合波譜法測定產物的結構多樣性,結果顯示,8# 配方(淀粉 25 g·L-1, KNO31 g·L-1, K2HPO4·3H2O 0.5 g·L-1, NaCl 0.5 g·L-1, FeSO4·7H2O 0.01 g·L-1,MgSO4·7H2O 0.5 g·L-1)為其產生次生代謝物的最佳培養基。
[1] STROBEL G, DAISY B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiology and Molecular Biology Reviews, 2003, 67 (4): 491-502.
[2] 張炯炯.紅豆杉植物資源的開發利用[J].生物學雜志,2000, 17(4):30-31.ZHANG Jiongjiong. The exploitation and utilization of Taxus plant resources [J]. Journal of Biology, 2000, 17(4):30-31.
[3] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J].Science ,1993, 260(5105): 214-216.
[4] CARUSO M, COLOMBO A L, FEDELI L, et al. Isolation of endophytic fungi and actinomycetes taxane producers [J]. Annals of Microbiology, 2000, 50: 3-13.
[5] CARUSO M, COLOMBO A L, CRESPI-PERELLINO N, et al.Studies on a strain of Kitasatospora sp. paclitaxel producer [J]. Annals of Microbiology, 2000, 50: 89-102.
[6] WU Yingying, LU Chunhua, QIAN Xiaoming, et al. Diversities within genotypes, bioactivity and biosynthetic genes of endophytic actinomycetes isolated from three pharmaceutical plants [J]. Current Microbiology, 2009, 59(4): 475-482.
[7] 沈萍,陳向東.微生物學實驗[M].4版.北京:高等教育出版社, 2008.SHEN Ping, CHEN Xiangdong. Experiment of Microbiology [M]. 4th ed. Beijing: High Education Press, 2008.
[8] WANG Y, ZHANG Z, Ruan J. Phylogenetic analysis reveals new relationships among members of the genera Microtetraspora and Microbispora [J]. International Journal of Systemic Bacteriology,1996, 46(3): 658-663.
[9] GYANESHWAR P, JAMES EK, MATHAN N, et al. Endophytic colonization of rice by a diazotrophic strain of Serratia marcescens [J].Journal of Bacteriology, 2001, 183(8): 2634-2645.
[10] WANG Y, ZHANG Z S, RUAN J S, et al. Investigation of actinomycete diversity in the tropical rainforests of Singapore[J].Journal of Industrial Microbiology and Biotechnology, 1999,23(3):178-187.
[11] 丁小維, 劉開輝, 鄧百萬, 等. 中國紅豆杉內生細菌的分離鑒定及活性研究[J]. 微生物學通報, 2008, 35(10): 1577-1580.DING Xiaowei, LIU Kaihui, DENG Baiwan, et al. The isolation and identification of endophytic bacteria from Taxus chinensis and the studies of their activity[J]. Microbiology Bulletin, 2008, 35(10):1577-1580.
[12] 劉志恒, 姜成林. 放線菌現代生物學與生物技術[M]. 北京: 科學出版社, 2004.LIU Zhiheng, JIANG Chenglin. The Modern Biology and Biotechnology of Actinomycetes [M]. Beijing: Science Press, 2004.
[13] 劉志恒. 放線菌: 微生物藥物的重要資源[J]. 微生物學通報, 2005,32(6): 143-145.LIU Zhiheng. Actinomycetes: important source of drug[J].Microbiology Bulletin, 2005, 32(6): 143-145.
[14] 周軍, 唐雅君, 張惠展. 放線菌次生代謝途徑的設計[J]. 生物工程進展, 1999, 19(5): 40-45.ZHOU Jun, TANG Yajun, ZHANG Huizhan. The design of actinomycete secondary metabolic pathways [J]. Progress in Biotechnology, 1999, 19(5): 40-45.
[15] 黃麟, 許嚴偉, 匡巖巍, 等. 土壤放線菌Streptomyces sp.2215代謝物的分離鑒定及抗腫瘤活性研究[J]. 天然產物研究與開發, 2009,21(2): 235-238.HUANG Lin, XU Yanwei, KUANG Yanwei, et al. Purification and identification of antitumor secondary metabolites from soil Streptomyces sp. 2215[J]. Natural Product Research and Development,2009, 21(2): 235-238.
[16] WANG J, SOISSON SM, YOUNG K, et al. Platensimycin is a selective FabF inhibitor with potent antibiotic properties[J]. Nature, 2006,441(7091): 358-361.
[17] CLARDY J, FISCHBACHM A, WALSH C T. New antibiotics from bacterial natural products[J]. Nature Biotechnology, 2006, 24(12):1541-1550.
[18] 李強,劉軍,周東坡, 等. 植物內生菌的開發與研究進展[J]. 生物技術通報, 2006, 3: 33-37.LI Qiang, LIU Jun, ZHOU Dongpo, et al. Advance on exploitation and research of endophyte [J]. Biotechnology Bulletin, 2006, 3: 33-37.
[19] CASTILLO U F, STROBEL G A, FORD E J, et al. Munumbicins,wide-spectrum antibiotics produced by Streptomyces NRRL 30562,endophytic on Kennedia nigriscans[J]. Microbiology, 2002, 148(9):2675-2685.
[20] CASTILLO U F, JAMES K H, GARY A S, et al. Kakadumycins, novel antibiotics from Streptomyces sp. NRRL 30566, an endophyte of Grevillea pteridifolia [J]. FEMS Microbiology Letters, 2003, 224(2):183-190.
[21] EL-SHATOURY S, ABDULLA H, EL-KARAALY O, et al.Bioactivities of endophytic actinomycetes from selected medicinal plants in the world heritage site of Saint Katherine, Egypt [J].International Journal of Botany, 2006, 2(3): 307-312.

