朱黃青霉α-1,6-葡聚糖酶在畢赤酵母中的分泌表達
莊靈習,段 然,陳龍軍,凌雪萍,盧英華,*
(1.廈門大學化學化工學院,福建廈門361005; 2.廣州甘蔗糖業研究所,廣東廣州510316)
朱黃青霉α-1,6-葡聚糖酶在畢赤酵母中的分泌表達
莊靈習1,段 然1,陳龍軍2,凌雪萍1,盧英華1,*
(1.廈門大學化學化工學院,福建廈門361005; 2.廣州甘蔗糖業研究所,廣東廣州510316)
α-1,6-葡聚糖酶是專一作用于α-1,6糖苷鍵產生小分子葡聚糖的一類水解酶,廣泛的運用于制糖工業和啤酒工業中。采用PCR法擴增朱黃青霉(Penicillium minioluteum)C12114的α-1,6-葡聚糖酶基因,將其插入畢赤酵母表達載體pPIC9K。經Sac I酶線性化電擊轉入畢赤酵母基因組,構建重組酵母GS115/pPIC9K-dex。對構建成功的轉化子進行1.5%的甲醇誘導表達,在30℃條件下培養7d時酶活達到最大值,為88.35U/mL。
α-1,6-葡聚糖酶,朱黃青霉,畢赤酵母,誘導
1 材料與方法
1.1 實驗材料
朱黃青霉C12114和大腸桿菌E.coli DH5α 由本實驗室保存;畢赤酵母表達載體pPIC9K和畢赤酵母菌株GS115 Invitrogen公司;膠回收試劑盒、酵母基因組提取試劑盒 深圳尚能生物科技有限公司;限制性內切酶、pMD18-T載體系統和T4 DNA連接酶 日本TaKaRa公司;DNA相對分子質量標準、Taq DNA聚合酶 大連寶生物工程公司;質粒提取試劑盒、無氨基酸的硫酸銨酵母氮源培養基、抗生素G418、蛋白分子標準 上海生工生物工程技術服務有限公司;測序及引物合成 由上海生工生物工程技術服務有限公司完成;其他生化試劑 國產分析純;朱黃青霉斜面培養基PDA(g/L) 酵母膏5,葡萄糖10,瓊脂20,自然pH;朱黃青霉菌絲體液體培養基(g/L) 玉米漿20,蔗糖20,酵母膏5,CaCO35,pH 5.8;LB培養基用于大腸桿菌DH5α培養,YPD、MD培養基用于重組畢赤酵母的篩選,BMG和BMM培養基用于重組畢赤酵母的培養表達,具體配方見Invitrogen公司的畢赤酵母操作手冊[8];引物 使用引物序列如表1所示,其中 F1、F2為朱黃青霉C12114中α-1,6-葡聚糖酶基因的上下游引物,在上游引物F1的5’端引入EcoR I酶切位點,下游引物F2的5’端引入Not I酶切位點(表中劃線部分)。

表1 實驗相關引物
1.2 實驗方法
1.2.1 朱黃青霉的菌體培養、DNA的提取及dex基因的獲得 將PDA斜面培養基(30℃恒溫培養)上的朱黃青霉C12114接種至菌絲體液體培養基中,30℃,150r/min搖床培養約3~4d。離心收集菌絲,無菌水沖洗,液氮速凍,研磨后參照吳發紅等[9]使用SDS法提取朱黃青霉的總DNA。
以獲得的總DNA為模板,PCR擴增dex基因。反應體系含4μL 25mmol/LMgCl2、0.5μL 10mmol/L dNTP、0.5μL(2.5U)Taq DNA聚合酶、各 0.5μL 10μmol/L的上下游引物(F1和F2)和總DNA模板0.5μL,擴增條件見表2。PCR產物經瓊脂糖凝膠電泳后,回收預期大小的片段,與pMD-T載體連接,轉化入大腸桿菌DH5α感受態細胞,涂布在含氨芐青霉素LB平板上,挑選陽性克隆,提質粒進行測序驗證。
1.2.2 重組畢赤酵母表達載體的構建 將測序正確定義的α-1,6-葡聚糖酶基因用EcoR I和Not I雙酶切,并與同樣經過 EcoR I和 Not I雙酶切的載體pPIC9K連接,連接產物轉化感受態大腸桿菌DH5α,得到的轉化子經氨芐抗性和卡那霉素選擇篩選出陽性克隆。提取質粒進行測序驗證,構建重組載體pPIC9K-dex,如圖1所示。
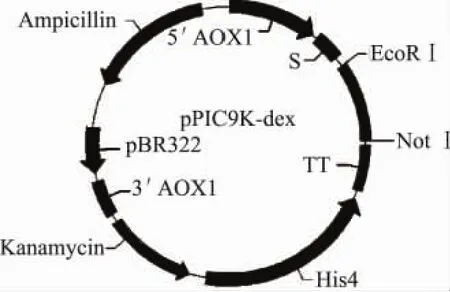
圖1 重組質粒pPIC9K-dex
1.2.3 重組畢赤酵母的轉化和篩選 將活化后的畢赤酵母 GS115菌株接種到30mL YPD培養基中,30℃、200r/min下培養過夜至 OD600為1.0~1.5。取5mL 4℃離心并收集菌體,用預冷的無菌水和1mol/L山梨醇分別洗滌菌體兩次,將所得菌體懸浮于80μL預冷的1mol/L山梨醇溶液中。加入20μL經Sac I線性化的重組表達載體充分混勻,將上述混合液移至0.2cm電擊杯中,冰浴5min,用電轉化儀電擊,條件為1500V,25μF。電擊結束后向電擊杯內加入1mL預冷的1mol/L山梨醇溶液,分別取200、300、500μL涂布于缺少組氨酸的MD平板,30℃條件下培養至轉化子出現。以不含載體的GS115為陰性對照。
用滅菌牙簽挑取轉化子分別點種到含0.25、0.5、1.0、1.5、2g/L G418的YPD培養基平板上,30℃培養2d,在高濃度G418平板上生長的即為高拷貝轉化子。獲得的高拷貝轉化子點種于篩選培養基MM和MD平板上,確定其甲醇利用表型,在MD和MM上均能正常生長的轉化子為Mut+(methanol utilization plus)型,指可利用甲醇為唯一碳源的野生型菌株。將獲得的高拷貝轉化子點種于MM-藍色葡聚糖T2000平板,出現透明水解圈則是表達成功的陽性轉化子。
1.2.4 重組畢赤酵母菌株的誘導表達 將陽性轉化子接種于含30mL BMG培養基的250mL搖瓶中,30℃、200r/min搖床培養24h。離心收集菌體,將菌體轉移至30mL BMM誘導培養基中,30℃、200r/min繼續培養168h,每24h補加適量甲醇至體積分數1%。每24h取樣,10000r/min離心5min,收集上清液即為粗酶液。
1.2.5 SDS-PAGE檢測表達產物 將粗酶液進行SDS-PAGE(分離膠12%,濃縮膠5%),粗酶液加入4×上樣緩沖液,沸水浴5min后上樣10μL進行電泳。電泳結束后采用銀染法顯色[10]。
1.2.6 重組畢赤酵母表達產物分析 采用DNS法[11]測定重組α-1,6-葡聚糖酶的活性。酶活定義在pH5.0,溫度37℃下,將每分鐘催化產生1μmol還原糖所需的酶量定義為一個酶活力單位(U)。
1.2.7 重組畢赤酵母搖瓶優化 以BMG培養基為生長培養基,BMM為誘導培養基,分別考察誘導溫度和甲醇濃度對蛋白表達的影響。選擇誘導溫度分別為25、28、30、32℃進行優化;分別在誘導過程中添加0.5%、0.75%、1.0%、1.5%、2.0%體積分數的甲醇,測定重組α-1,6-葡聚糖酶的活性,選擇合適的甲醇添加濃度。
2 結果與討論
2.1 dex基因的獲得
經菌絲體培養基培養朱黃青霉后,采用液氮-SDS法提取總DNA,結果如圖2所示。圖2中泳道1和2分別為未添加及添加液氮研磨的結果。在研磨過程中由于液氮對細胞內物質結構的保護作用,可以看出泳道2的條帶比較亮,DNA提取效果較好。
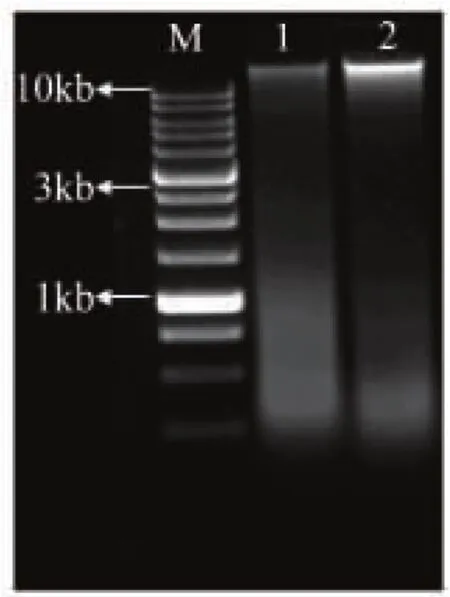
圖2 朱黃青霉C12114的總DNA
提取的總DNA經溫度梯度PCR擴增得到目的基因約為1800bp,結果如圖3所示。經測序后,與朱黃青霉α-1,6-葡聚糖酶基因具有100%同源性,至此成功獲得dex基因。將dex基因連入T載體,挑取含氨芐青霉素平板上的陽性轉化子提取質粒,成功得到載體pMD18-T-dex(圖略)。
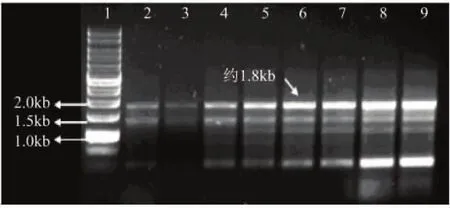
圖3 α-1,6-葡聚糖酶基因擴增結果注:1-DNA ladder;2~9-不同退火溫度40、42、44、46、48、50、52、54℃擴增片段。
2.2 重組載體pPIC9K-dex的構建
將重組體pMD18-T-dex和載體pPIC9K分別經EcoR I和Not I雙酶切,回收相應片段、連接產物轉化大腸桿菌DH5α,挑取轉化子擴增并抽提質粒。將抽提的質粒經EcoR I和Not I雙酶切,得到了1800bp左右和9000bp左右的條帶(見圖4),證實dex基因成功插入載體pPIC9K,將重組質粒命名為pPIC9K -dex。
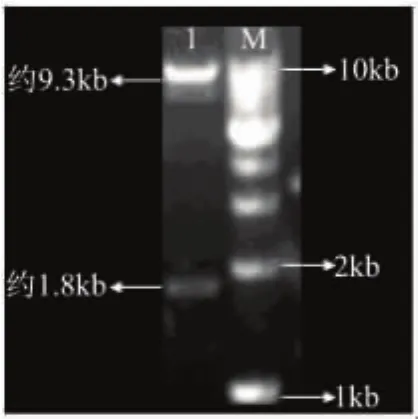
圖4 雙酶切驗證重組質粒pPIC9K-dex注:M-DNA ladder;1-經EcoR I和Not I雙酶切片段。
2.3 重組畢赤酵母GS115/pPIC9K-dex的構建與篩選
重組質粒用Sac I酶切線性化,電擊轉化畢赤酵母GS115,涂布于MD平板上篩選目的基因整合到宿主菌染色體上的轉化子。考慮到基因拷貝數的增加一般可以提高基因產物的表達量,首先利用載體上的G418抗性基因篩選高基因拷貝的轉化子。將MD平板上獲得的轉化子點種于含0.25、0.5、1、1.5和2g/L G418的 YPD平板上,30℃培養 3d后,篩選出抗1.5mg/mL G418的 5株菌,一般每抗 0.25mg/mL G418即為一個拷貝數,因此最終得到約6個拷貝數的重組畢赤酵母。從MD平板點種到MM上的轉化子都能生長且菌落比MD平板上的小,故判斷其甲醇利用表型為Mut+。
將篩選得到的陽性轉化子點板于MM-藍色葡聚糖T2000平板,結果見圖5。在菌落周圍可以明顯見到透明水解圈,證明dex基因不僅已經整合進酵母基因組中,而且成功實現了在畢赤酵母中的活性表達。

圖5 MM-藍色葡聚糖T2000平板
2.4 SDS-PAGE電泳檢測表達產物
挑取表達菌株接種于30mL BMG的培養基中,30℃振蕩培養約24h,離心收集菌體,用含1%甲醇的BMM培養基重懸菌體,誘導表達。不同時間取樣,發酵液上清溶于5×上樣緩沖液,SDS-PAGE檢驗結果見圖6。從圖6中可見,在66ku附近有一相應條帶,其與天然的朱黃青霉α-1,6-葡聚糖酶理論分子量相符(67ku),而陰性對照中沒有相應條帶。畢赤酵母對重組蛋白的糖基化作用可能是目的蛋白分子量稍大的原因。
2.5 溫度和甲醇濃度對重組畢赤酵母表達的影響
以1%甲醇為碳源誘導重組畢赤酵母進行表達,α-1,6-葡聚糖酶活性隨時間變化曲線如圖7所示。圖7中顯示培養基中的α-1,6-葡聚糖酶活性在誘導120h時可達到42.51U/mL。
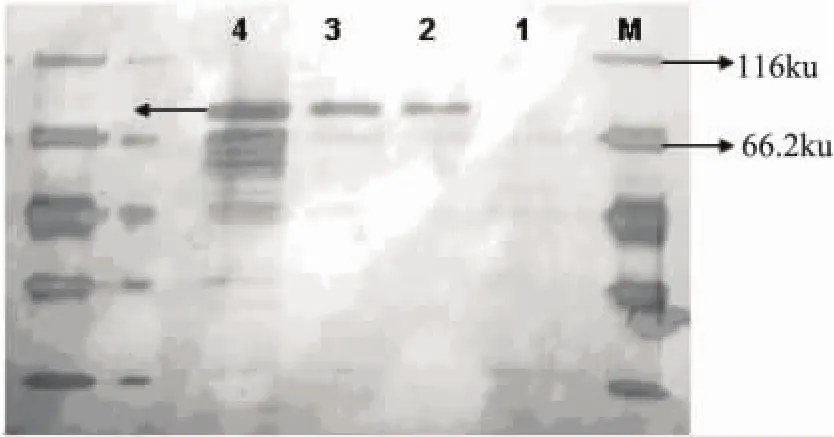
圖6 重組酵母的表達產物SDS-PAGE電泳結果注:1-P.pastoris GS115的上清;2~4-經甲醇誘導24、72、120h的P.pastoris GS115/pPIC9K-dex上清。

圖7 重組畢赤酵母在BMM培養基中的產酶曲線
溫度是影響微生物生長和表達的最為關鍵的因素之一。溫度升高,有利于微生物的生長代謝和蛋白表達,但溫度過高也會使菌體過早衰老,發酵周期縮短,降低蛋白表達量和活性。因此,必須選擇合適的溫度,而且在不同階段,應選擇不同的溫度。圖8為誘導溫度對重組畢赤酵母產酶的影響。28℃與30℃對產酶的影響不大,當溫度為32℃時,目的蛋白的表達遠遠低于其他三個溫度,與文獻報道的畢赤酵母在超過32℃的情況下生長緩慢,衰退提前,已造成菌體過早死亡,表達低下[12]等相符。由于實驗室搖床溫度限制,故后續實驗溫度選擇30℃。
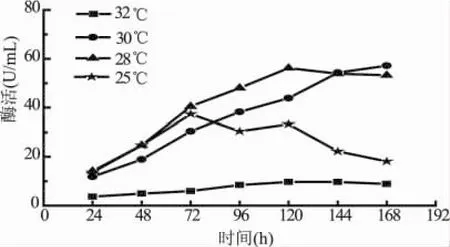
圖8 誘導溫度對表達外源α-1,6-葡聚糖酶的影響
培養基的組成特別是碳源直接影響菌體生長和誘導表達,故選擇合適的碳源及濃度也對重組畢赤酵母表達十分重要。甲醇作為外源蛋白表達的誘導劑,也是誘導過程中的碳源。在甲醇連續添加的情況下,可能造成甲醇蓄積,對菌體產生毒害作用,添加量不足,又會造成碳源不足,影響菌體生長。通過優化甲醇添加濃度發現1.5%體積分數的甲醇添加量對α-1,6-葡聚糖酶的表達最為合適,在144h時酶活達到88.35U/mL,見圖9。
3 結論

圖9 甲醇濃度對表達外源α-1,6-葡聚糖酶的影響
α-1,6-葡聚糖酶在醫療、牙科及制糖工業中具有十分重要的應用[13],但目前國內外關于α-1,6-葡聚糖酶的研究相對于其他類型的葡聚糖酶類如β-1,3-葡聚糖酶等并不深入。本研究通過PCR技術從朱黃青霉C12114菌株中成功擴增出α-1,6-葡聚糖酶基因,通過基因重組在畢赤酵母中成功表達α-1,6-葡聚糖酶基因。此外,對利用畢赤酵母誘導培養基BMM對α-1,6-葡聚糖酶的表達的溫度和甲醇誘導濃度進行簡單的優化,結果表明:30℃,1.5%體積分數的甲醇添加量為α-1,6-葡聚糖酶最適表達條件,最高酶活可達到88.35U/mL。畢赤酵母作為高效表達外源蛋白的表達系統,可高密度發酵是其重要的優點,今后將結合搖瓶培養的優化結果指導重組畢赤酵母GS115/pPIC9K-dex的發酵罐培養,使α-1,6-葡聚糖酶能夠高效表達。
[1]葡聚糖對制糖工業的影響及其測定方法[J].甘蔗糖業,1985(1):30-42.
[2]Eggleston G,Monge A.Optimization of sugarcane factory application of commercial dextranases[J].Process Biochemistry,2005,40:1881-1894.
[3]Khalikova E,Susi P,Korpela T.Microbial dextran-hydrolyzing enzymes:fundamentals and applications[J].Microbiol Mol Biol R,2005,69:306-325.
[4]Walker G J.Dextrans[J].Biochemistry of Carbohydrates II,1978,16:75-126.
[5]Raices M,Molerio M C,Li I M,et al.Purificacion parcial de una enzima dextranasa a partir de una cepa de hongo del genero Penicillium[J].Biotechnol,1991(8):248-255.
[6]Sue M P,Mariana L F,Brian,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[7]李洪淼,王紅寧,許欽坤.畢赤酵母高密度發酵研究進展[J].生物技術通訊,2005,16(2):210-212.
[8]陳苗,商漢橋.畢赤酵母表達操作手冊[M].美國: Invitrogen公司,2002.
[9]吳發紅,黃東益,周鑫,等.幾種內生真菌DNA提取方法的比較[J].中國農學通報,2009,25(8):62-64.
[10]沃興德.蛋白質電泳與分析[M].北京:軍事醫學科學出版社,2009.
[11]Ghose T K.Measurement of cellulase activities[J].Pure and App Chem,1987,59(2):257-268.
[12]林俊涵.畢赤酵母高密度發酵工藝的研究[J].中國生物工程雜志,2009,29(5):120-125.
[13]Lin Chen,Xiangshan Zhou,Weimin Fan,et al.Expression,purification and characterization of a recombinant Lipomyces starkey dextranase in Pichia pastoris[J].Protein Expression and Purification,2008,58:87-93.
Expression of α-1,6-dextranase from Penicillium minioluteum in P.pastoris
ZHUANG Ling-xi1,DUAN Ran1,CHEN Long-jun2,LING Xue-ping1,LU Ying-hua1,*
(1.College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China; 2.Guangzhou Sugarcane Industry Research Institute,Guangzhou 510316,China)
α-1,6-dextranase,which can hydrolyze dextran specifically by cutting off the α-1,6-glycosidic bond to release shorter saccharides,was widely used in many fields such as sugar industry and beer industry.The gene of α-1,6-dextranase(dex)was amplified through PCR by using Penicillium minioluteum C12114 genomic DNA as template.The amplified gene was cloned into vector pPIC9K and the recombinant plasmid pPIC9K-dex was linearzed with Sac I,then transformed into P.pastoris GS115 by electroporation.The positive transformant was induced to express the enzyme with 1.5%methanol for 7 days under the 30℃,and the activity of the enzyme could reach 88.35U/mL.
α-1,6-dextranase;Penicillium minioluteum;P.pastoris;induction
TS201.3
A
1002-0306(2011)11-0194-04
α-1,6-葡聚糖(Dextran)是α-D-吡喃型葡萄糖的聚合物,主要通過α-1,6糖苷鍵連接,含有少量的α-1,2、α-1,3和α-1,4糖苷鍵。葡聚糖在醫療上可以代替血漿,控制藥物釋放;在牙科中,葡聚糖會與唾液中的糖蛋白形成牙菌斑;而在制糖工業中,腸系膜狀白念珠菌(Leuoconostoc mesenteroides)利用蔗糖合成葡聚糖,造成糖分損失,使糖汁粘度增高導致過濾困難,蔗糖的結晶效率降低,糖的精煉質量下降等[1-2]。α-1,6-葡聚糖酶能夠切斷葡聚糖中的α-1,6-糖苷鍵,產生異麥芽糖或異麥芽三糖以及分子量較小的葡聚糖,使其失去親水性和粘性,提高精糖的質量和制糖效率。真菌中的青霉菌、油脂酵母、黑曲霉以及細菌中的鏈球菌、芽孢桿菌都能產生α-1,6-葡聚糖酶[3]。真菌中的朱黃青霉(Penicillium minioluteum)產生的α-1,6-葡聚糖酶具有較高的熱穩定性,適合運用于制糖工業中[4]。朱黃青霉來源的α-1,6-葡聚糖酶屬于糖苷水解酶類的GH49類,分子大小為67ku,等電點為3.88,其最適反應pH為5.0[5]。由于青霉菌的生長較慢,產物的活性和產量較低,提取純化不易,難以適合工業化生產。畢赤酵母(P.pastoris)表達系統是近年來發展起來的一種優秀的真核表達系統,不僅能夠大量表達異源蛋白,而且也能對外源蛋白進行翻譯后修飾如適度糖基化、正確折疊、形成二硫鍵等,從而保持異源蛋白的生物活性[6-7]。本實驗將朱黃青霉C12114的α-1,6-葡聚糖酶基因導入畢赤酵母表達載體pPIC9K中構建重組菌,研究α-1,6-葡聚糖酶在畢赤酵母中的表達,以提高 α-1,6-葡聚糖酶的產量用于工業化生產。
2010-11-17 *通訊聯系人
莊靈習(1986-),女,碩士,在讀研究生,研究方向:微生物發酵。
廣東省科技計劃項目。

