片狀和顆粒狀γ-Bi2MoO6的水熱合成及可見光催化性能
杜永芳,宋繼梅,王 紅,張 蕙
(安徽職業技術學院化學工程系,安徽合肥 230001)
片狀和顆粒狀γ-Bi2MoO6的水熱合成及可見光催化性能
杜永芳,宋繼梅,王 紅,張 蕙
(安徽職業技術學院化學工程系,安徽合肥 230001)
采用水熱法及檸檬酸輔助水熱法分別制備了片狀的和顆粒狀的γ-Bi2MoO6,利用X射線粉末衍射(XRD)、場發射掃描電子顯微鏡(FESEM)和UV-vis漫反射光譜(DRS)對產物進行了表征和檢測,探討了片狀的和顆粒狀的γ-Bi2MoO6可能的形成機理.以太陽光為光源對結晶紫溶液進行光催化降解.實驗結果表明:顆粒狀的γ-Bi2MoO6的光催化活性略優于片狀的γ-Bi2MoO6.
γ-Bi2MoO6;片狀;顆粒狀;檸檬酸;光催化
0 引 言
通式為Bi2An-1BnO3n+3(其中A=Ca,Sr,Ba,Pb,Na,K,B=Ti,Nb,Ta,Mo,W,Fe)的Aurivillius結構的化合物,由于特殊的層狀結構和性能而引起人們的廣泛關注[1-3].γ-Bi2MoO6是Aurivillius結構中n=1時最簡單的一種[4],由于其優異的物理化學性能而在離子導體[5]、太陽能電池[6]、氣敏[7]和催化[8-9]等方面有著廣闊的應用前景.近年來,γ-Bi2MoO6顯示了優越的可見光催化性能.例如Kudo等[10]分別用水熱法和回流法制備了γ-Bi2MoO6,并研究了其在AgNO3溶液中制氧的性能.Bi[11]、A.Martínez-de la Cruz[12]和Zhang[13]等分別用溶劑熱法、共沉淀法和水熱法制備了γ-Bi2MoO6.研究表明,在可見光照射下,γ-Bi2MoO6對于羅丹明B顯示了較好的降解效果.然而,大多數研究者合成的產物均是片狀,很少有其它形貌的,這可能與γ-Bi2MoO6本身的生長習性有關.
本文采用水熱法及檸檬酸輔助水熱法制備了片狀的和顆粒狀的γ-Bi2MoO6,利用XRD、SEM、DRS對產物進行表征,探討了片狀的和顆粒狀的γ-Bi2MoO6可能的生長機理;光催化性能測試結果表明:顆粒狀的γ-Bi2MoO6的光催化活性略優于片狀的γ-Bi2MoO6.
1 實 驗
1.1 Bi2MoO6納米片的制備
將2mmol的Bi(NO3)3·5H2O和1mmol的Na2MoO4·2H2O分別溶于20mL濃度為1mol/L的HNO3和NaOH中.在強攪拌下,使兩種溶液混合,并調節pH到7左右,繼續攪拌30min,轉移至60mLTeflon內膽的不銹鋼反應釜中,150℃下反應24h.自然冷卻至室溫,離心過濾,用去離子水和無水乙醇洗滌數次,60℃真空干燥6h,得到亮黃色粉末,標為產物1.
1.2 Bi2MoO6顆粒的制備
將2mmol的Bi(NO3)3·5H2O和1mmol的Na2MoO4·2H2O分別溶于20mL濃度為1mol/L的HNO3和NaOH中,然后在Bi(NO3)3溶液中加入2mmol的檸檬酸.在強攪拌下,使兩種溶液混合,并調節pH到7左右,繼續攪拌30min,轉移至60 mL Teflon內膽的不銹鋼反應釜內,150℃下反應24h.自然冷卻至室溫,離心過濾,用去離子水和無水乙醇洗滌數次,60℃真空干燥6h,得到亮黃色粉末,標為產物2.
1.3 光催化性能測試
將0.05g合成產物分別放入100mL質量濃度為10mg/L的自配結晶紫(染料)溶液,在日光下照射3h,每隔30min取上層清液,在結晶紫的最大吸收波長下測吸光度A.在實驗所選用的濃度范圍內,結晶紫溶液的吸光度與結晶紫的濃度成正比.以染料的脫色率[D=(A0-A)/A0×100%,A0、A分別為光照前、后結晶紫溶液]在最大吸收波長處的吸光度值表征產物的光催化性能.
2 結果與討論
2.1 產物的表征
圖1a和圖1b分別為產物1和產物2的X射線衍射譜圖.從圖1可以看出,二者均與標準卡片(21-0102)吻合.所有衍射峰均被指認,沒有雜質峰出現,說明在本實驗條件下可以得到純的γ-Bi2MoO6.
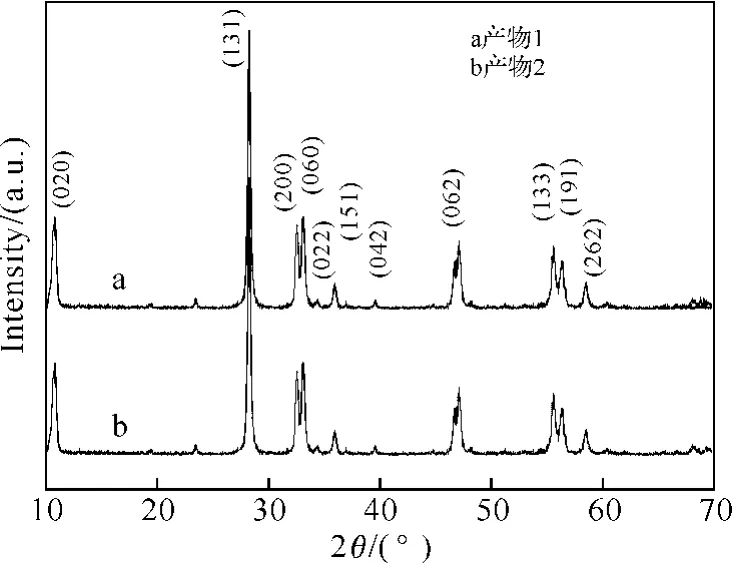
圖1 合成產物的XRD衍射譜圖Fig.1 XRD patterns of as-prepared products
為了觀察合成產物的形貌和尺寸,通過場發射掃描電子顯微鏡觀察并拍攝了產物的照片.圖2給出的是產物1的FESEM照片.由圖可知,產物1的形貌是不規則的片,且部分的片疊加在一起.圖3是產物2的全景SEM照片,產物2是由許多的納米顆粒組成,且顆粒大小均勻.

圖2 產物1的FESEM照片Fig.2 FESEM images of sample1

圖3 產物2的FESEM照片Fig.3 FESEM images of sample 2
2.2 Bi2MoO6納米片和納米顆粒可能的形成機理
檸檬酸是一種常見的絡合劑,能與多種金屬形成配合物.在沒有檸檬酸存在下,Bi3+和MoO42-快速反應,形成不規則的納米顆粒成為γ-Bi2MoO6的初級晶核.隨后,晶體開始生長,根據Gibbs-Thomson方程[14],由粒子大小尺寸之間的自由能之差,小顆粒的溶解度大于大顆粒的溶解度,尺寸較小的晶體將通過溶解而逐漸被消耗,向尺寸較大的顆粒提供物質供應,而尺寸較大的晶體將逐漸長大.由于水熱條件下晶體的生長是在非受迫的情況進行,晶體可以按照本征的晶體結構習性自由生長,各個面族的生長習性可以得到充分的顯露.前人[15]的研究表明,γ-Bi2MoO6是由MoO6八面體層和(Bi2O2)2+層構成的層狀結構,八面體的Mo鏈等同地沿著a和b軸延伸,并且垂直于八面體的Mo鏈的兩個面具有較高的表面能,按照晶體學知識,表面能高的晶面生長速度較快,而表面能低的晶面生長速度較慢,隨著晶體的逐漸長大,生長速度較快的晶面逐漸減小直至消失,生長速度較慢的晶面則逐漸增大得以保留,最終形成由低表面能晶面形成的穩定晶體,故而晶體優先沿著層的方向生長.所以,在這個條件下,γ-Bi2MoO6容易長成二維的片狀結構.
當有檸檬酸存在時,溶液中的Bi3+首先與檸檬酸形成配合物,溶液中游離的Bi3+濃度減小.此時,Bi3+和MoO42-的碰撞幾率減小,從而降低Bi2MoO6的生長和成核速率.在生長速率相對較慢地情形下,Bi2MoO6的初級晶核優先團聚成小球以減少它的表面能[16],最終,產物的形貌為納米顆粒.
2.3 紫外——可見漫反射光譜
圖4是產物1和產物2的紫外-可見漫反射譜.Bi2MoO6具有吸收可見光的性能,其吸收譜有陡峭的邊緣,說明它的光吸收是由于能帶隙的躍遷引起的.由圖4可知,樣品在紫外區具有強烈的吸收,并且部分延伸至可見光區,產物1和產物2的吸收邊緣分別位于440nm和470nm左右,產物2的紫外-可見吸收峰發生了明顯的紅移,這與兩種產物的尺寸大小不同有關,尺寸越小,紫外-可見吸收峰越向高能量的方向移動.對于半導體晶體,在能帶附近的吸收滿足公式:αhν=A(hν-Eg)n/2.公式中α,ν,Eg和A分別是吸收系數,光的頻率,能帶和常數.根據這個公式,利用固體紫外可見光譜可以計算得到樣品的帶隙能(Eg),產物1和產物2的帶隙能分別為2.58eV和2.49eV.基于密度泛函理論的計算,Bi2MoO6能帶結構理論計算表明:光激發后的電子是從O2p和Bi6s雜化軌道向Mo5d軌道遷移的,Bi2MoO6可見光的吸收是由于Bi6s軌道與O2p軌道雜化變窄引起的.這種雜化的能帶結構使得價帶呈現出很大程度的發散,能夠增大光生空穴以及價帶頂附近電子的活動性.
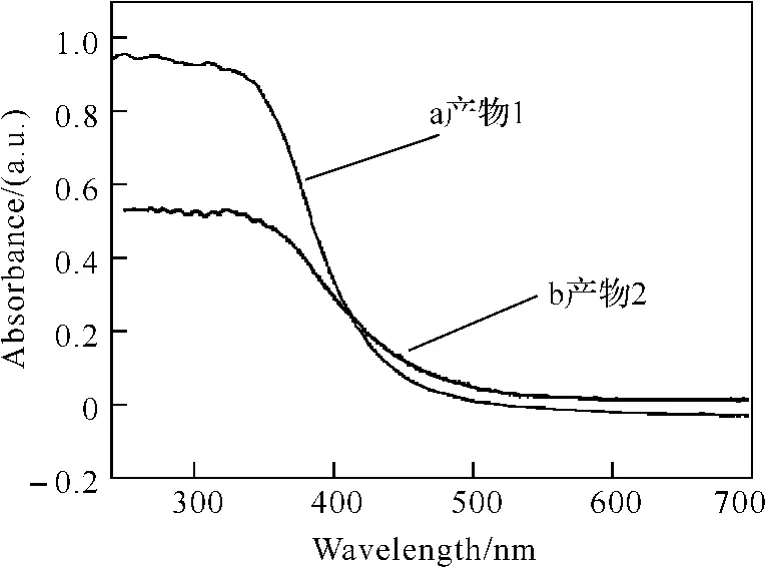
圖4 產物的UV-vis漫反射光譜圖Fig.4 UV-Vis diffused reflectance spectra of samples
2.4 合成產物對結晶紫的光催化性能
為了探討兩種產物的光催化性質,本文研究了在太陽光照射下,光催化降解結晶紫溶液的能力.圖5顯示了結晶紫溶液在降解過程中,其紫外可見吸收光譜隨時間的變化.隨著反應時間的延長,結晶紫溶液的最大吸收峰明顯的降低.當反應時間達到100min,產物1對結晶紫溶液的降解率達到51.45%,而對于產物2則達到了63.16%,產物2的光催化性能稍好于產物1.
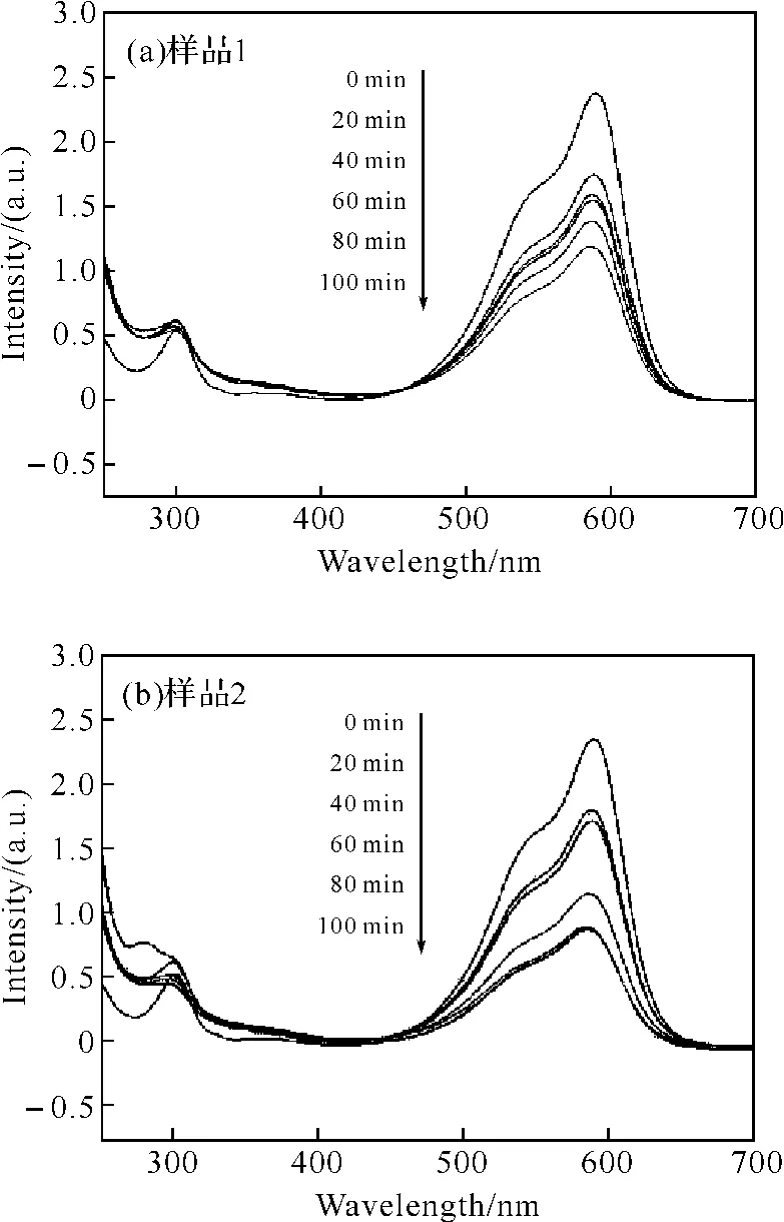
圖5 結晶紫溶液隨時間變化的紫外可見吸收光譜Fig.5 The temporal evolution of the absorption spectrum of the crystal violet solution
通常,半導體氧化物的光催化活性主要由如下因素影響決定:晶體結構和帶結構、結晶度、晶粒尺寸及形貌等.產物1和產物2均為γ-Bi2MoO6,但其帶隙能和晶粒形貌不同,產物2的帶隙能(2.49eV)比產物1的帶隙能(2.58eV)稍小,吸收的可見光光子數量較多,因而光催化性能較好;再者產物1的形貌是不規則的片,且部分的片疊加在一起,而產物2是由許多大小均勻納米顆粒組成的,這也可能導致兩種產物的光催化性能不同.
3 結 語
采用檸檬酸輔助水熱法制備了片狀的和顆粒狀的γ-Bi2MoO6,探討了片狀的和顆粒狀的γ-Bi2MoO6可能的形成機理.片狀γ-Bi2MoO6的形成是由于Bi2MoO6本身的生長習性決定的,而顆粒狀的γ-Bi2MoO6是因為Bi3+與檸檬酸形成配合物,導致溶液中游離的Bi3+濃度大大降低,進而降低Bi2MoO6的生長和成核速率.在生長速率相對較慢的情形下,Bi2MoO6的初級晶核優先團聚成小球以減少它的表面能,最終產物的形貌為納米顆粒.以太陽光為光源對結晶紫溶液進行光催化降解研究,結果表明:顆粒狀的γ-Bi2MoO6的光催化活性略優于片狀的γ-Bi2MoO6.
[1]Tsunoda Y,Shirata M,Sugimoto W,et al.Preparation and HREM Characterization of a Protonated Form of a Layered Perovskite Tantalate from an Aurivillius Phase Bi2SrTa2O9via Acid Treatment[J].Inorg Chem,2001,40(23):5768-5771.
[2]Kim J Y,Chung I,Choy J H,et al.Macromolecular Nanoplatelet of Aurivillius-type Layered Perovskite Oxide,Bi4Ti3O12[J].Chem Mater,2001,13:2759-2761.
[3]Tsunoda Y,Sugimoto W,Sugahara Y.Intercalation Behavior of n-Alklamines into a Protonated Form of a Layered Perovskite Derived from Aurivillius Phase Bi2SrTa2O9[J].Chem Mater,2003,15:632-635.
[4]Buttrey D,Vogt T,White B.High-Temperature Incommensurate-to-Commensurate Phase Transition in the Bi2MoO6Catalyst[J].Solid State Chem,2000,155:206-215.
[5]Murugan R.Investigation on Ionic Conductivity and Raman Spectra of Gamma-Bi2MoO6[J].J Phys Chem B,2004,352:227-232.
[6]Man Y,Zong R,Zhu Y.Preparation and Photoelectrochemical Properties of Bi2MoO6Films[J].物理化學學報,2007,23(11):1671-1676.
[7]Le M,Kovanda M,Myslik V,et al.Pulsed Laser Deposition and Dip-Coating echniques in the Fabrication of Bismuth Molybdate Gas Sensors[J].Thin Solid Films,2006,497:284-291.
[8]Jung J,Kim H,Kim Y,et al.Catalytic Performance of Bismuth Molybdate Catalysts in the Oxidative Dehydrogenation of C4Raffinate-3to 1,3-Butadiene[J].Appl Catal A,2007,317:244-249.
[9]Klisinska A,Mamede A S,Gaigneaux E M.Bismuth Molybdates Model Catalysts with Controlled Crystallinities Spin-Coated on Si(100)[J].Catal Today,2007,128:145-152.
[10]Shimodaira Y,Kato H,Kobayashi H,et al.Photophysical Properties and Photocatalytic Activities of Bismuth Molybdates under Visible Light Irradiation.J Phys Chem B,2006,110(36):17790-17797.
[11]Bi J,Wu L,Li J,et al.Simple Solvothermal Routes to Synthesize Nanocrystalline Bi2MoO6Photocatalysts with Different Morphologies[J].Acta Mater,2007,55(14):4699-4705.
[12]Martínez-de la Cruz A,Obregón Alfaro S.Synthesis and characterization ofγ-Bi2MoO6prepared by coprecipitation:Photoassisted degradation of organic dyes under vis-irradiation[J].Mol Catal A:Chem,2010,320:85-91.
[13]Zhang L W,Xu T G,Zhao X,et al.Controllable synthesis of Bi2MoO6and effect of morphology and variation in local structure on photocatalytic activities[J].Appl Catal B:Environ,2010,98:138-146.
[14]Mullin J W.Crystallization[M].3rd Ed.U K Oxford:Butterworth-Heinemanm,1997.
[15]Peng Z,Peng X.Nearly Monodisperse and Shape-Controlled CdSe Nanocrystals via Alternative Routes:Nucleation and Growth[J].J Am Chem Soc,2002,124:3343-3353.
[16]Chen J Y,Herricks T,Geissler M,et al.Transbilayer Complementarity of Phospholipids.A Look beyond the Fluid Mosaic Model.J Am Chem Soc,2004,126,10854-10860.
Hydrothermal synthesis and photocatalytic properties ofγ-Bi2MoO6
DUYong-fang,SONGJi-mei,WANGHong,ZANGHui
(Department of Chemical Engineering,Anhui Vocational and Technical College,Hefei 230001,China)
Flake-like and nanoparticlesγ-Bi2MoO6were prepared by a hydrothermal method using citric acid as the capping agent.The obtained products were characterized by X-ray diffraction,scanning electron microscopy,and UV-vis diffuse reflectance spectroscopy.A possible formation mechanism of the flake-like and nanoparticlesγ-Bi2MoO6was proposed.Photocatalytic experiments showed that nanoparticlesγ-Bi2MoO6exhibited good photocatalytic activities for degradation of crystal violet solution under sunlight irradiation.
γ-Bi2MoO6;flake-like;nanoparticles;citric acid;photocatalytic
O61X5
A
10.3969/j.issn.1674-2869.2011.10.017
16742869(2011)10007304
20110918
杜永芳(1963),女,安徽肥東人,副教授.研究方向:無機納米材料的合成.
本文編輯:龔曉寧

