小鼠止血帶休克后腎組織ACE/ACE2表達變化及意義*
王建軍, 楊秀紅, △, 鄧 巍, 王銀環, 劉英超, 耿 菲, 王建輝, 秦 川, 張連元
(河北聯合大學基礎醫學院1生理教研室,2機能實驗室,河北 唐山 063000;3中國醫學科學院,北京協和醫學院實驗動物研究所,北京 100021)
小鼠止血帶休克后腎組織ACE/ACE2表達變化及意義*
王建軍1, 楊秀紅1, 2 △, 鄧 巍3, 王銀環2, 劉英超1, 耿 菲2, 王建輝2, 秦 川3, 張連元2
(河北聯合大學基礎醫學院1生理教研室,2機能實驗室,河北 唐山 063000;3中國醫學科學院,北京協和醫學院實驗動物研究所,北京 100021)
目的: 通過觀察小鼠止血帶休克(TS)后,不同時點血管緊張素轉換酶(ACE)和血管緊張素轉換酶2(ACE2)在腎臟的表達變化與腎損傷程度的關系,探討ACE/ACE2表達失衡在TS后腎損傷中的作用。方法復制小鼠TS模型,Western blotting測肢體缺血再灌注后12 h內腎組織ACE和ACE2蛋白的表達;利用化學比色方法測定血清和腎組織丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性;制作腎病理切片,觀察腎組織形態變化,并利用免疫組織化學方法觀察ACE和ACE2的表達部位。結果Western blotting結果顯示,各時點與對照組比較,TS后ACE表達升高,ACE2表達降低;與對照組比較血清和腎MDA水平增高(Plt;0.05),SOD活性降低(Plt;0.05);HE病理切片顯示,TS后各時點腎組織有充血、炎細胞浸潤等不同程度損傷;免疫組化結果顯示,ACE在腎小管上皮細胞胞漿表達,TS后表達明顯增強;ACE2主要在腎小管上皮細胞管腔膜表達,TS后表達明顯降低。結論TS后腎組織ACE表達升高,ACE2表達降低,ACE/ACE2表達失衡可能與腎損傷有關。
休克,止血帶; 血管緊張素轉換酶; 血管緊張素轉換酶2; 腎損傷
各種原因所致休克發生機制極為復雜,體液因素在休克過程中發揮了重要作用,其中腎素血管緊張素系統(renin-angiotensin system, RAS)活性增高并參與休克發生,主要是血管緊張素轉換酶(angiotensin converting enzyme 2,ACE)催化的縮血管通路過度激活引起血管收縮,造成局部組織器官缺血缺氧導致多器官損傷。近年來研究發現,RAS系統還存在血管緊張素轉換酶2(angiotensin converting enzyme 2,ACE2)[1]催化的舒血管通路,ACE2能夠起到拮抗ACE的作用,保護休克時對局部器官的損傷。本研究以小鼠止血帶休克(tourniquet shock,TS)為模型,觀察TS后ACE、ACE2的表達變化與腎損傷的關系,旨在探討RAS穩態失衡在休克發生機制中的作用。
材 料 和 方 法
1材料
1.1主要試劑 蛋白提取試劑盒、蛋白濃度測定試劑盒、Western blotting蛋白marker、ECL發光劑、定影劑和顯影劑均為碧云天試劑公司產品。超氧化物歧化酶(superoxide dismutase,SOD)試劑盒和丙二醛(malondialdehyde,MDA)試劑盒均購自南京建成生物工程研究所。ACE抗體、ACE2抗體和β-actin抗體均購自Abcam。免疫組化II抗購自北京中杉金橋生物技術公司。
1.2動物 雄性健康ICR小鼠42只,月齡6個月,由北京實驗動物研究所提供。
2方法
2.1模型復制 采用我室常規復制小鼠TS模型,水合氯醛按3 mL/kg腹腔注射麻醉小鼠,用橡皮帶環繞結扎小鼠雙后肢根部,阻斷血流2 h后松開橡皮帶使血流再灌注,于不同時點摘眼球放血處死小鼠,取血漿和雙側腎組織,-70 ℃冰箱或固定液中保存待各指標測定。
2.2動物分組 隨機分為7組:(1)對照組(control)常規飼養,不結扎雙后肢,其余操作同模型組。(2)止血帶休克組(TS組)根據再灌注時間不同分為6組,分別為0.5 h組、1 h組、2 h組、4 h組、6 h組和12 h組。
2.3Western blotting測定腎組織ACE、ACE2蛋白表達 按照蛋白提取試劑盒說明進行操作。將一側腎組織100 mg放入玻璃勻漿器,加入1 mL蛋白裂解液勻漿,12 000 r/min離心5 min,留取上清。用BCA法測定蛋白濃度,用裂解液將各蛋白配成濃度為6 g/L,取10 μL蛋白樣品與5×上樣緩沖液混勻,煮沸5 min后SDS-PAGE電泳,轉硝酸纖維素膜3~5 h,5%BSA室溫封閉1 h,I抗孵育1 h,TBST洗膜3次,每次5 min,Ⅱ抗孵育0.5 h,TBST洗膜3次,每次5 min。ECL發光試劑均勻鋪于膜上孵育2 min,曝光后顯影、定影。結果用ImageJ圖像分析軟件分析處理。
2.4HE染色觀察腎臟病理損害 將另一側腎浸于10%甲醛中充分固定后,按常規方法脫水、包埋、切片和HE染色,顯微鏡下觀察。
2.5免疫組織化學方法檢測腎組織ACE、ACE2的表達部位 將腎組織石蠟切片,常規二甲苯脫蠟、梯度乙醇水化。3%H2O2室溫下孵育10 min,枸櫞酸緩沖液中高溫修復2~3 min,冷卻至室溫,加入Ⅰ抗孵育1.5 h,PBS沖洗5 min×3次,加入Ⅱ抗試劑Ⅰ37 ℃孵育15 min,PBS沖洗5 min×3次,加入Ⅱ抗試劑Ⅱ37 ℃孵育15 min,PBS沖洗5 min×3次,DAB顯色,脫水、透明、封片,顯微鏡下觀察。
2.6SOD活性、MDA含量測定 待全血凝固后,3 000 r/min離心5 min取上清。將腎組織勻漿,離心、提取上清。根據試劑盒說明,用酶標儀測定血清和腎組織SOD活性及MDA含量。
3統計學處理
結 果
1Westernblotting結果
Western blotting結果顯示,在180 kD處可見到ACE表達條帶,TS后各時點組小鼠腎組織ACE蛋白表達量比對照組增高。在120 kD處可見到ACE2表達條帶,TS后各時點組小鼠腎組織ACE2蛋白表達量比對照組降低,見圖1A。ACE/ACE2比值于再灌注后2 h最大,見圖1B。

Figure 1. The change of ACE and ACE2 expression in the kidney after TS observed by Western blotting. A: the protein expression of ACE and ACE2; B: the ratio of ACE to ACE2.*Plt;0.05,**Plt;0.01 vs control (0 h).
2HE結果
HE病理切片顯示,與正常對照組(圖2A)比較,TS后腎組織有不同程度損傷,再灌注早期腎小球毛細血管明顯擴張充血,炎細胞浸潤,再灌注4 h炎癥最為明顯,可以看到大量炎細胞浸潤;再灌注晚期近曲小管上皮細胞水腫,細胞體積增大,官腔變窄,偶見上皮細胞壞死,見圖2B。
3免疫組織化學結果
免疫組化結果顯示,ACE在腎小管上皮細胞胞漿表達,TS后表達明顯增強;ACE2主要在腎小管上皮細胞管腔膜表達,TS后表達明顯降低。利用BI 2000醫學圖像分析系統對結果進行分析,測定吸光度值,進行統計分析,結果顯示:與對照組相比,TS后腎組織ACE和ACE2表達均有顯著差異(Plt;0.05),見圖3。

Figure 2. The kidney injury after TS observed by HE staining (×100). A: normal kidney; B: the injured kidney after TS.

Figure 3. The expression of ACE2 and ACE in the kidney(immunohistochemical staining,×200).A:the expression of ACE2 in normal kidney;B:the expression of ACE2 in the kidney after TS;C: the expression of ACE in nomal kidney, D: the expression of ACE in the kidney after TS. ±s.n=6.*Plt;0.05 vs control.
4SOD活性和MDA含量測定結果
與對照組比較,各時點TS后血清、腎組織SOD活性均顯著降低(Plt;0.05或Plt;0.01),見表1;MDA含量均顯著增高(Plt;0.05或Plt;0.01),見表2。
討 論
休克的發病機制非常復雜,其最根本機制是循環系統功能紊亂,特別是急性微循環障礙導致多器官功能衰竭。體液因素在休克過程中發揮了重要作用,其中腎素血管緊張素系統激活與休克的發生有密切關系。近年來研究發現,RAS包括兩條通路:一條是由ACE催化的縮血管通路,ACE將血管緊張素(angiotensin,Ang)Ⅰ轉換成AngⅡ,AngⅡ與血管緊張素Ⅱ1型受體(angiotensin Ⅱ type 1 receptor,AT1R)結合產生縮血管、促炎癥等作用[2];另一條是由ACE2催化的舒血管通路,ACE2的主要作用是分解AngⅡ并產生Ang(1-7),Ang(1-7)可與MAS受體結合可產生舒張血管[3]、調節血壓[4]、提高缺血再灌耐受性等作用[5]。兩條軸的平衡在維持機體體液平衡、血壓穩定、細胞增殖、心和腎功能的調節中發揮著重要作用。休克時可造成局部組織器官的損傷,尤其是心、肺、腎等重要器官的損傷,可能與局部器官兩條通路的失調有關。
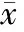
表1 TS后各時點SOD活性
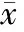
表2 TS后各時點MDA含量
ACE是縮血管通路的關鍵酶,休克時其活性過度增高,催化底物產生大量AngⅡ,作用于AT1R發揮相應作用,Gupta等[6]研究表明內毒素休克大鼠腎ACE和AngⅡ表達增高,并出現腎小管周圍毛細血管血流量減少,血尿素氮增高等急性腎衰竭癥狀,活化蛋白C(activated protein C, APC)可以通過下調AngⅡ和ACE mRNA的表達來增加腎血流量和減少血尿素氮,從而減輕腎損害。有研究表明,腎缺血2 h,再灌4 h可對腎組織造成嚴重損傷,同時ACE和AngⅡ表達升高[7]。Nitescu等[8]研究表明AT1R抑制劑坎地沙坦能夠使內毒素休克大鼠腎內血流量和氧分壓增高,從而減輕休克時造成的腎損害。然而也有研究發現ACE抑制劑依那普利并沒有改變內毒素血癥黏附分子的水平[9]。
ACE2是舒血管通路的關鍵酶,其活性增高可分解AngⅡ并產生具有舒血管作用的Ang(1-7) 。休克時ACE2的低表達可能會進一步升高AngⅡ水平對機體造成不利影響。研究表明,脂多糖誘導的內毒素休克大鼠可出現腎衰竭癥狀,APC可以通過上調ACE2 mRNA的表達水平來緩解內毒素休克引起的腎衰竭[6]。腎缺血再灌注損傷時組織ACE2表達明顯下降[7]。在其它疾病所致的腎損傷中也發現與ACE/ACE2表達失衡有關。Shiota等[10]研究表明在鏈霉素誘導的糖尿病中,ACE2基因敲除小鼠腎損傷發生的較早而且損傷更加嚴重。有研究表明,腎組織ACE2降低可能提高AngⅡ水平引起腎氧化應激,導致炎癥和纖維化等腎損傷性疾病[11]。
目前有關ACE/ACE2在TS中的作用研究尚未見報道。本實驗的前期實驗發現[12],TS后腎損傷可能與內皮源性NO表達降低有關。本實驗結果顯示,TS后各時點腎組織有不同程度的炎癥性損傷,其中以4 h損傷最為嚴重。具有抗氧化作用的酶SOD活性降低,而過氧化產物MDA含量卻增高。同時實驗結果還顯示TS后腎組織ACE的表達升高,ACE2的表達降低,ACE/ACE2表達失衡。這提示腎組織ACE/ACE2表達失衡可能是引起TS后腎損傷的因素之一,ACE/ACE2表達失衡是否與內皮源性NO表達降低有關有待進一步研究。
[1]Tipnis SR, Hooper NM, Hyde R, et al. A human homolog of angiotensin-convertingenzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. Biol Chem, 2000, 275(43): 33238-33243.
[2]Kirimura K, Takai S, Jin D, et al. Role of chymase-dependent angiotensin II formation in regulating blood pressure in spontaneously hypertensive rats[J]. Hypertens Res,2005,28(5):457-464.
[3]Muthalif MM, Benter IF, Uddin MR, et al. Signal transduction mechanism involved in angiotensin(1-7) stimulated arachidonic acid release and prostanoid synthesis in rabbit aortic smooth cells[J]. J Pharmacol Exp Ther, 1998, 284(1): 388-398.
[4]吳逸南,葛志明,姜 虹,等. 血管緊張素轉換酶2在自發性高血壓大鼠腎臟表達與血壓的關系研究[J]. 中國病理生理雜志,2006, 22(4):818-820.
[5]Kucharewicz I, Pawlak R, Matys T, et al. Antithrombotic effect of captopril and losartan is mediated by angiotensin-(1-7) [J]. Hypertension, 2002, 40(5): 774-779
[6]Gupta A, Rhodes GJ, Berg DT, et al. Activated protein C ameliorates LPS-induced acute kidney injury and downregulates renal iNOS and angiotensin 2[J]. Am J Physiol Renal Physiol, 2007, 293(1): F245-F254.
[7]da Silveira KD, Pompermayer KS, Diniz LR,et al. ACE2-angiotensin-(1-7)-Mas axis in renal ischaemia/reperfusion injury in rats[J]. Clin Sci (Lond), 2010, 119(9): 385-394.
[8]Nitescu N, Grimberg E, Guron G. Low-dose candesartan improves renal blood flow and kidney oxygen tension in rats with endotoxin-induced acute kidney dysfunction[J]. Shock, 2008, 30(2): 166-172.
[9]Graninger M, Marsik C, Dukic T,et al. Enalapril does not alter adhesion molecule levels in human endotoxemia[J]. Shock, 2003, 19 (5): 448-451.
[10]Shiota A, Yamamoto K, Ohishi M, et al. Loss of ACE2 accelerates time-dependent glomerular and tubulointerstitial damage in streptozotocin-induced diabetic mice[J]. Hypertens Res,2010 , 33(4): 298-307.
[11]Zhong J,Guo D, Chen CB, et al. Prevention of angiotensin II-mediated renal oxidative stress, inflammation, and fibrosis by angiotensin-converting enzyme 2 [J]. Hypertension, 2011,57(2):314-322.
[12]段國賢,周開順,趙利軍,等. 一氧化氮在大鼠肢體缺血/再灌后腎組織細胞凋亡中的意義[J]. 中國應用生理學雜志, 2009, 25(2):281-282.
ChangeofACE/ACE2expressioninmousekidneyaftertourniquetshock
WANG Jian-jun1, YANG Xiu-hong1, 2, DENG Wei3, WANG Yin-huan2, LIU Ying-chao1, GENG Fei2, WANG Jian-hui2, QIN Chuan3, ZHANG Lian-yuan2
(1DepartmentofPhysiology,2LaboratoryofFunctionalScience,SchoolofBasicMedicalSciences,HebeiUnitedUniversity,Tangshan063000,China;3InstituteofLaboratoryAnimalScience,ChineseAcademyofMedicalScienceandPekingUnionMedicalCollege,Beijing100021,China.E-mail:yangxiuhong38@yahoo.com.cn)
AIM: To investigate the change of angiotensin-converting enzyme/angiotensin-converting enzyme 2(ACE/ACE2) expression in mouse kidney after tourniquet shock (TS) and to study the effects of ACE/ACE2 imbalance on the kidney of TS mice.METHODSThe male ICR mice were used in the study. The model of TS was made using bilateral tourniquets placed high in the inguinal region on both hind legs for 2 h to induce ischemia, and reperfusion was initiated by cutting latex rings. The expression of ACE/ACE2 in the kidney at different time points was determined by Western blotting and immunohistochemistry. The content of malondialdehyde (MDA) and the activity of superoxide dismutase (SOD) in the kidney were determined by chemical colorimetric method. The morphological changes of the kidney were observed under microscope with HE staining.RESULTSWestern blotting showed that ACE was increased and ACE2 was decreased in the kidney after TS. MDA was increased and SOD was decreased in TS groups as compared with control group. The kidney of TS groups displayed distinct injuries including inflammatory cell infiltration and degeneration of tubule epithelial cells. The results of immunohistochemistry showed that ACE expressed in endochylema of the renal tubular epithelial cells was increased and ACE2 expressed in epithelium of proximal tubules was decreased in the TS mice.CONCLUSIONBoth ACE and ACE2 are expressed in the kidney. The imbalance of ACE/ACE2 expression in the kidney after TS may be related to the kidney injury.
Shock,tourniquet; Angiotensin-converting enzyme; Angiotensin-converting enzyme 2; Renal injury
1000-4718(2011)12-2399-04
R363
A
10.3969/j.issn.1000-4718.2011.12.031
2011-06-08
2011-11-17
衛生部人類疾病比較醫學重點實驗室開放課題(No. ZDS200801);唐山市科學技術研究與發展計劃(No.10150204A-10)
△通訊作者 Tel:0315-3726387;E-mail:yangxiuhong38@yahoo.com.cn

