BCR-ABL-SEA DNA疫苗誘導BALB/c小鼠的免疫應答*
高永鵬, 林 晨△, 田紅霞, 陳 琛, 秦雅楠, 周羽竝, 李揚秋
(暨南大學醫學院1 微生物與免疫學系, 2生物化學系,3血液病研究所, 廣東 廣州 510632)
BCR-ABL-SEA DNA疫苗誘導BALB/c小鼠的免疫應答*
高永鵬1, 林 晨1△, 田紅霞1, 陳 琛1, 秦雅楠1, 周羽竝2, 李揚秋3
(暨南大學醫學院1微生物與免疫學系,2生物化學系,3血液病研究所, 廣東 廣州 510632)
目的了解BCR-ABL-SEA雙表達DNA疫苗誘導BALB/c小鼠特異性細胞和體液免疫應答效應。方法用已成功構建的重組雙表達BCR-ABL 多肽和 SEA多肽的質粒BCR-ABL-pIRES-SEA (B-P-S)免疫小鼠,間隔14 d共3次。相同方法用單表達BCR-ABL 多肽或 SEA多肽的質粒BCR-ABL-pIRES 和SEA-pIRES免疫小鼠作對照。利用CCK-8 比色法檢測小鼠脾臟T 細胞對K562細胞株的殺傷活性;流式細胞術測定小鼠脾臟CD4+與CD8+T細胞表達情況;ELISA法檢測小鼠血清中干擾素γ(IFN-γ)和白細胞介素4(IL-4)生成情況;間接免疫熒光法檢測血清中抗BCR-ABL抗體。結果免疫后第7周時,雙表達重組質粒B-P-S組小鼠脾臟CTL細胞針對K562殺傷率、血清中INF-γ含量均明顯高于單表達BCR-ABL-pIRES組和SEA-pIRES組(P<0.05);CD4+/CD8+T細胞比值、血清中IL-4含量各組之間無明顯差異(P>0.05);熒光顯微鏡檢測到血清中有抗BCR-ABL抗體。結論所構建的BCR-ABL-SEA重組雙表達質粒可誘導小鼠產生特異性細胞和體液免疫應答效應。
白血病; 基因,BCR-ABL融合; 葡萄球菌腸毒素A; 疫苗,DNA
微小殘留病灶(minimal residual disease,MRD)仍然是慢性粒細胞白血病(chronic myeloid leukemia,CML)治療緩解后復發的一個重要因素,特異性免疫治療通過免疫監測和清除殘留白血病細胞對預防CML復發以及延長生存期有重要作用[1,2]。CML患者具有特征性的BCR-ABL融合基因,研究發現表達BCR-ABL融合基因的細胞及其融合蛋白多肽可以誘導T細胞克隆性增殖,由于單獨BCR-ABL多肽免疫原性較弱[3],因此尋找適合的免疫佐劑是臨床應用亟待解決的重大問題。本課題組前期研究已經顯示,超抗原金黃色葡萄球菌腸毒素A(staphylococcal enterotoxin A,SEA)可以有效增強多肽抗原誘導特異性T細胞克隆[4,5]。DNA疫苗能夠同時誘導體液和細胞免疫,而且具備傳統疫苗無法比擬的諸多優點而成為新一代最有潛力的疫苗之一[6]。本研究是利用已成功構建的BCR-ABL-pIRES-SEA的真核表達疫苗免疫BALB/c小鼠,進一步分析其體內刺激細胞和體液免疫應答效應,為發展特異性免疫治療提供研究資料。
材 料 和 方 法
1材料
1.1質粒 本課題組成功構建的BCR-ABL-pIRES-SEA(B-P-S)(專利申請號為201010160423.1)真核雙表達重組質粒及SEA-pIRES(S-P)和BCR-ABL-pIRES(B-P)單表達重組質粒[7]。
1.2動物和分組 BALB/c小鼠由中山大學動物實驗中心提供(編號為SCXK20040011),雄性,6-8周,18-22 g。隨機分為5組:(1)N組:生理鹽水;(2)P組:pIRES質粒;(3)B-P-S組:雙表達BCR-ABL-pIRES-SEA質粒;(4)B-P組:單表達BCR-ABL-pIRES質粒;(5)S-P組:單表達SEA-pIRES質粒。各組小鼠分別于第0、2、4周在雙側股四頭肌各注射1次,每次注射劑量為200 μg,免疫前1 d同一部位注射1%普魯卡因40 μL。初次免疫后第7周處死小鼠。
2方法
2.1CTL 殺傷活性實驗
① 靶細胞 K562細胞株作為殺傷性實驗的靶細胞,培養體系含10%滅活胎牛血清、1×105U/L青-鏈霉素的RPMI-1640培養基,37 ℃、體積分數5% CO2培養箱常規培養;NB4細胞株作為殺傷性實驗陰性對照,以檢測細胞毒作用的特異性。
② 效應細胞 在無菌條件下,取小鼠脾臟置研磨器中加EZ-SepTMmouse 1×小鼠淋巴細胞分離液2 mL共研磨后,細胞懸液移至離心管,離心分離單個核細胞層,計數并用RPMI-1640液調整細胞2×1010cells/L上樣至96孔板,加入K562細胞株作為刺激源而進行混合淋巴細胞培養4 h。
③ 按效靶比為40∶1加入靶細胞,于96孔培養板內100 μL/well,微量混合器振蕩5 min,以促進效、靶細胞之間接觸;同時分別設效應細胞對照組和靶細胞對照組(100 μL/well)。每組均設3個平行孔。各組于37 ℃、5% CO2飽和濕度培養箱中培養4 h。繼而在各孔內加入10 μL的CCK-8試劑,在培養箱內培養4 h后,以450 nm為檢測波長,600 nm 為參考波長,于酶標儀上測定各孔吸光度(A)值。
對靶細胞的殺傷百分率=
2.2流式細胞術檢測CD4+/CD8+T 細胞比值 直接免疫熒光染色及流式細胞術檢測CD4+和CD8+T細胞比值變化情況。收集各組小鼠誘導培養4 h后的T 細胞,洗滌計數后,待測100 μL細胞懸液分別加入FITC-CD4和PE-CD8標記單抗各5 μL,其中生理鹽水組作為陰性對照組,室溫避光染色15 min。用洗滌液洗滌2次,加入終濃度2%多聚甲醛固定,流式細胞儀檢測,利用MultiSET V 1.1.1軟件進行分析。
2.3小鼠血清中IFN-γ和IL-4測定 按試劑盒說明書操作,按1 000、500、250、125、62.5、31.25、15.625、7.8、0 ng/L進行對倍稀釋以制作標準曲線。生物素化抗體工作液配制:以生物素化抗體稀釋液稀釋濃縮生物素化抗體(1∶100)。酶結合物工作液配制:以酶結合物稀釋液稀釋濃縮酶結合物(1∶100)。取出所需板條,除空白孔,分別將標本或不同濃度標準品(100 μL/well)加入相應孔中,每樣品設2復孔,用封板膠紙封住反應孔,37 ℃孵箱孵育90 min,洗板4次。除空白孔外,每孔加入生物素化抗體工作液100 μL。用封板膠紙封住反應孔,37 ℃孵箱孵育60 min,洗板4次。除空白孔外,每孔加入酶結合物工作液100 μL。封住板孔37 ℃孵箱孵育30 min。洗板4次。加入顯色劑100 μL/well,避光37 ℃孵箱孵育10-15 min,加入終止液100 μL/well,混勻后即刻在450 nm酶標儀測定標本的吸光度A450值(5 min內)。
2.4間接免疫熒光檢測血清中抗BCR-ABL抗體 收集對數生長期的K562細胞,PBS洗滌2次,1 500 r/min離心3 min,去上清調整細胞濃度約1×109cells/L,分別加入各組小鼠血清作為Ⅰ抗,以生理鹽水組作為陰性對照。37 ℃孵育1 h,PBS洗滌,離心。 加入羊抗鼠FITC標記Ⅱ抗,37 ℃孵育1 h,PBS洗滌,點片。用熒光顯微鏡觀察并拍照。
3統計學處理
結 果
1免疫小鼠CTL殺傷活性檢測
各組小鼠CTL對K562細胞和對照組NB4細胞的殺傷率見表1。對照組NS組和P組兩組之間沒有明顯差別,且組內對2種靶細胞的殺傷率之間也無明顯差別(P>0.05)。B-P組對K562細胞殺傷活性高于對照N組,而且也顯著高于同組對NB4細胞的殺傷效果(P<0.05)。S-P組不僅可以對K562細胞有殺傷活性,同時對NB4產生明顯的殺傷作用,但兩者之間的殺傷活性沒有顯著差異。B-P-S組對K562細胞殺傷活性明顯高于B-P組和S-P組,而且殺傷效果高于同組對NB4細胞株的殺傷效果(P<0.05)。此外,與B-P組和S-P組對NB4細胞殺傷活性比較,B-P-S組也對NB4細胞有顯著的殺傷活性(P<0.05)。

表1 免疫小鼠CTL針對K562和NB4細胞的殺傷率
2CD4+/CD8+細胞比值變化
對小鼠CD4+、CD8+T細胞亞群的百分比的影響見表2和圖2,各組間無明顯差異(P>0.05)。但B-P-S組CD4+/CD8+T 細胞比值降低趨勢比較明顯。
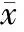
表2 免疫小鼠CD4+和CD8+T細胞亞群的百分比變化情況
3免疫后小鼠血清中IFN-γ的檢測
結果見表3,組間兩兩比較差異顯著(P<0.01)。B-P-S組明顯高于質粒B-P組、S-P組(P<0.05),B-P組有升高但與陰性對照比無明顯差異。
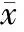
表3 免疫后小鼠血清中IFN-γ的含量
4免疫后小鼠血清中IL-4的檢測
結果見表4,組間無明顯差別(P>0.05)。
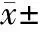
表4 免疫后小鼠血清中IL-4的含量
5小鼠血清中抗BCR-ABL抗體的檢測
B-P-S組、B-P組K562細胞株表面有綠色的熒光,在其余各組和陰性對照組均未見到熒光,見圖2。

Figure 1. The CD4 and CD8 surface markers on the spleen T cells were detected by flow cytometry(FCM) in BALB/c mice after immunization. B-P-S group:BCR-ABL- pIRES-SEA, the reconstructed BCR-ABL- pIRES-SEA plasmids, which were developed previous in our laboratory, were injected into BALB/c mice at 14-d intervals for 3 cycles.The upper left quadrant represents CD8+T cells,while the lower right quadrant is on behalf of CD4+T cells. The CD4/CD8 ratio in B-P-S group was lower than that in negative control group.

Figure 2. The effect of the antibody against target K562 cells in BALB/c mice after immunization(×200).The surface of K562 cells indicates green fluorescence in B-P-S group and B-P group, but not in other groups. A: normal saline group under ordinary microscope; B: normal saline group under fluorescence microscope;C: P(pIRES) group under ordinary microscope; D: P(pIRES) group under fluorescence microscope; E: B-P-S(BCR-ABL-pIRES-SEA) group under ordinary microscope; F: B-P-S(BCR-ABL-pIRES-SEA) group under fluorescence microscope; G: B-P(BCR-ABL-pIRES) group under ordinary microscope; H: B-P(BCR-ABL- pIRES) group under fluorescence microscope; M: S-P(SEA- pIRES) group under ordinary microscope; N: S-P(SEA- pIRES) group under fluorescence microscope.
討 論
特異性免疫治療通過誘導機體細胞免疫和體液免疫為清除腫瘤微小殘留病灶成為新的治療手段。DNA疫苗能夠在體內有效表達,并同時誘導細胞和體液免疫效應,被抗原提呈細胞攝取后在真核細胞中翻譯成蛋白質,以多肽形式與MHC分子結合,并被呈遞到細胞表面被T細胞受體所識別,從而特異性激活T細胞引起細胞毒T細胞效應及體液免疫效應[8]。因此有可能成為治療CML比較理想的治療方法。
正常情況下,c-ABL蛋白主要存在于細胞的胞核內,與細胞的凋亡有關,而在CML細胞內,BCR-ABL蛋白在細胞內定位紊亂,主要分布于胞質中,發揮著抗凋亡作用。BCR-ABL融合基因是由t(9;22)異常核型形成,其分子生物學本質是9號染色體長臂上的ABL基因易位至22號染色體長臂的斷裂點簇集區BCR,形成BCR-ABL融合基因,與CML的發生密切相關。其表達產物融合蛋白是CML發病的分子基礎,因此,也是CML患者理想的免疫治療靶抗原。已有研究表明利用BCR-ABL融合基因構建的DNA疫苗,能夠成功在小鼠體內誘導出特異性抗細胞毒性細胞效應,也進一步證明了用BCR-ABL融合基因疫苗治療CML的可行性[9]。免疫原性弱是目前BCR-ABL融合基因疫苗研究中普遍存在的問題,已有研究顯示SEA作為佐劑能夠顯著增強肽疫苗的免疫原性,可以提高疫苗的治療效果,我們前期研究也證明了SEA有增強PML-RARα多肽誘導外周血T細胞TCR Vβ亞家族克隆性增殖的能力,并具有增強CTL作用[4,5]。有研究表明將表達細胞因子基因與目的基因一起插入到同一質粒中,由于二者作用的微環境相同,能夠進一步增強DNA疫苗的免疫原性[10],但也發現同一種細胞因子與不同的抗原共同免疫時其作用可能也不同,甚至出現相反作用[11],而且大多數細胞因子的體內半衰期短,活性容易受內環境影響。因此,鑒于上述DNA疫苗的不足之處,本課題組前期構建了BCR-ABL-SEA的真核雙表達質粒,該重組質粒在體外轉染真核細胞后,能夠在真核細胞中正常地轉錄,并利用點雜交和SDS-PAGE等檢測技術證明了這些重組質粒能夠在真核細胞中成功翻譯出相應蛋白[7]。本研究在此基礎上,進一步將所構建的重組質粒作為DNA疫苗免疫BALB/c小鼠,檢測其體內抗原特異性抗體和細胞免疫效應。結果表明B-P組在效靶比40∶1條件下,誘導外周血T細胞對CML細胞株K562細胞表現出特異性的殺傷作用。S-P組在同樣的條件下也能增強T細胞對2種白血病細胞株的殺傷效應,但缺乏特異性。B-P-S重組雙表達質粒在相同條件下,可以誘導出對K562細胞特異性殺傷作用更高的T細胞,這可能是BCR-ABL融合蛋白誘導出特異性的T細胞克隆大量增殖,SEA與優勢增殖的特異性T細胞克隆TCR Vβ片段非特異性結合,進一步刺激細胞活化,并產生多種細胞因子,放大所誘導的具有特異性殺傷作用的T細胞增殖。
CD4+Th細胞和CD8+Tc在免疫應答中發揮著其各自作用,因此,T淋巴細胞亞群的數量和相對比值的變化,可以成為衡量機體免疫狀態的重要指標。本實驗中經疫苗誘導后,對各組小鼠CD4+T和CD8+T 細胞亞群比例的檢測均沒有發現有明顯改變(表2),提示SEA具有同時活化CD4+T和CD8+T 細胞作用[12]。但本實驗B-P-S組誘導T 淋巴細胞活化增殖結果顯示,CD4+/CD8+T 細胞比值降低趨勢最為明顯,是否存在誘導后CD8+T細胞活化增殖能力更強一些?這值得進一步研究證實。機體抗腫瘤效應十分復雜,細胞免疫機制在機體抗腫瘤效應機制中發揮極為重要的作用。腫瘤抗原特異性CD4+T細胞活化后,可分泌IL-2、IL-4、IL-5、IL-6、IFN-γ和TNF等細胞因子。我們以IFN-γ水平間接反映Th1活化增殖情況,IL-4水平反映Th2活化增殖情況。IFN-γ主要由CD4+Th1細胞和CD8+T細胞所產生,能夠誘導單核細胞、巨噬細胞及樹突狀細胞等MHC-Ⅱ類抗原的表達,使其參與抗原提呈和特異性免疫的識別過程。增強抗原提呈細胞(antigen presenting cell,APC)與T細胞的相互作用,進而增強T細胞輔助抗體和細胞毒T細胞產生的能力,IFN-γ也誘導某些腫瘤細胞表達MHC-Ⅱ和MHC-Ⅰ類分子的作用,增強細胞毒T細胞殺傷靶細胞的能力,同時,還具有巨噬細胞激活因子(macrophage activating factor, MAF)的作用,能引發巨噬細胞的殺腫瘤效應。而IL-4屬于Th2細胞產生的特征性細胞因子,主要是促進體液免疫,增強特異性和非特異性的殺傷功能[13]。它能增強B細胞對T細胞的抗原提呈作用,增加B細胞與T細胞的相互作用,促進體液免疫應答。同時能誘導NK細胞、巨噬細胞增殖,促進其提呈抗原和殺傷腫瘤細胞的功能。本實驗結果顯示:B-P-S重組表達質粒誘導Th1作用更加明顯。各組小鼠血清中IL-4含量雖然沒有表現出明顯差異,但B-P-S組仍是最高。B-P-S組、B-P組小鼠血清中還是發現有抗BCR-ABL抗體。機體抗腫瘤免疫應答中,體液免疫應答與細胞免疫機制相互協調和補充,共同執行免疫監視功能,具體調節機制涉及多種因素,相互形成網絡共同作用產生最終效應。
綜上,本研究表明所構建的BCR-ABL-pRIES-SEA雙表達重組質粒能在小鼠體內誘導產生細胞免疫反應和體液免疫反應,而且較單表達BCR-ABL-pRIES質粒的效果要好,初步評價該DNA疫苗具有一定的保護效力。DNA疫苗已經成為新一代最有前景的疫苗之一,如何增強DNA疫苗的免疫原性是DNA疫苗領域亟待解決的問題, 另外,重組質粒注射的劑量以及免疫途徑,也影響免疫的效果。本結果為進一步研制出更安全、更有效的預防性疫苗,提供了可行性數據資料。
[1] John AM, Thomas NS, Mufti GJ, et al. Targeted therapies in myeloid leukemia[J]. Semin Cancer Biol,2004,14(1):41-62.
[2] Robin M, Schlageter MH, Chomienne C, et al. Targeted immunotherapy in acute myeloblastic leukemia: from animals to humans[J].Cancer Immunol Immunother, 2005, 54(10): 933-943.
[3] Posthuman EF, van Bergen CA, Kester MG, et al. Proteosomal degradation of BCR/ABL protein can generate an HLA-A*0301-restricted peptide, but high-avidity T cells recognizing this leukemia-specific antigen were not demonstrated[J]. Haematologica, 2004, 89(9):1062-1071.
[4] Cho JW, Cho SY, Lee KS. Roles of SEA-expressingStaphylococcusaureus, isolated from an atopic dermatitis patient, on expressions of human β-defensin-2 and inflammatory cytokines in HaCaT cells[J]. Int J Mol Med, 2009, 23(3):331-335.
[5] 林 晨,白 雪,高 珂,等. 超抗原SEA 增強PML-RARα多肽體外誘導特異性CTL 殺傷活性的機制[J].腫瘤防治研究,2008,35(9):627-629.
[6] 司少艷,胡沛臻,黃 楊,等. 腺病毒介導的肝癌靶向SEA-CD80基因治療及免疫學機制的初步研究[J]. 細胞與分子免疫學雜志, 2008, 24(3):278-281.
[7] 田紅霞,林 晨,查顯豐,等.BCR/ABL和SEA雙基因重組載體的構建和表達[J]. 暨南大學學報, 2010,31(4):336-340.
[8] Parker SE, Monteith D, Horton H, et al. Safety of a GM-CSF adjuvant-plasmid DNA malaria vaccine[J]. Gene Ther, 2001, 8(13):1011-1023.
[9] Yaghmaie M, Ghaffari SH, Ghavamzadeh A, et al. Frequency of BCR-ABL fusion transcripts in Iranian patients with chronic myeloid leukemia[J]. Arch Iranian Med, 2008, 11(3): 247 - 251.
[10]劉建欣,鄭學昌 主編.現代免疫學[M].第1版.北京:清華大學出版,2002.320-340.
[11]Chen HW, Pan CH, Huan HW, et al. Suppression of immune response and protctive immunity to a Japaneses encephalitis virus DNA vaccine by coadministration of an IL-12-expressing plasmid[J]. J Immunol, 2001, 166(12):7419-7426.
[12]葉 菁,隋延仿,吳道澄,等. SEA毫微粒對小鼠T細胞亞群的影響及抗肝癌作用的研究[J]. 癌癥,2003, 22(6):582-585.
[13]湯 彥,林敏娟,鄒威鳳.神經生長因子和白血病抑制因子上調哮喘大鼠脾淋巴細胞IL-4、IL-5的表達[J].中國病理生理雜志,2010,26(5):865-870.
ImmuneresponsesinducedbyDNAvaccineofBCR-ABL-SEAinBALB/cmice
GAO Yong-peng1, LIN Chen1, TIAN Hong-xia1, CHEN Chen1, QIN Ya-nan1, ZHOU Yu-bing2, LI Yang-qiu3
(1DepartmentofMicrobiologyandImmunology,2DepartmentofBiochemistry,3InstituteofHematology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tlinc@jnu.edu.cn)
AIM: To evaluate the immune responses induced by a DNA vaccine expressing both BCR-ABL and SEA peptides in mice.METHODSThe vaccine plasmid of BCR-ABL-pIRES-SEA, which expressed both BCR-ABL and SEA peptides and was constructed previously in our laboratory, was intramuscularly injected into BALB/c mice at 14-day intervals for 3 cycles. The plasmids of BCR-ABL-pIRES and SEA-pIRES, which were only expressed either BCR/ABL peptide or SEA peptide, were also used in the same procedure for comparison. The cytotoxicity of T-cells from mouse spleen against K562 cell line was examined by cell counting kit-8(CCK-8). The ratio of CD4+to CD8+on the harvested T cells was detected by flow cytometry. The serum levels of interferon-γ(IFN-γ) and interleukin 4(IL-4) were measured by ELISA. The antibodies against BCR-ABL were detected by the technique of immunofluorescence.RESULTSSeven weeks after immunization, the specific cytotoxicity of T-cells against K562 cells and the level of INF-γ in co-expression of BCR-ABL-pIRES-SEA group were significantly higher than those in mono-expression of BCR-ABL-pIRES group and SEA-pIRES group(P<0.05). The ratio of CD4+to CD8+on the harvested T-cells and the level of IL-4 in vaccinated mouse serum were not significantly different among the groups(P>0.05). The specific antibody against BCR-ABL was detected in BCR-ABL-pIRES-SEA group and BCR-ABL-pIRES group but not in SEA-pIRES group by indirect immunofluorescene analysis.CONCLUSIONThe recombinant BCR-ABL-pIRES-SEA vaccine induces specific humoral and cellular immune responsesinvivo.
Leukemia; Genes, BCR-ABL fusion; Staphylococcal enterotoxin A; Vaccines,DNA
R363
A
10.3969/j.issn.1000-4718.2011.02-028
1000-4718(2011)02-0361-06
2010-07-12
2010-11-30
廣東省自然科學基金資助項目(No.06025169);廣州市科技支撐計劃資助項目(No.2009Z1-E161)
△通訊作者 Tel:020-85220257;E-mail: tlinc@jnu.edu.cn

