大孔吸附樹脂純化小米酚類化合物的工藝條件研究
王若蘭 田志琴 孔祥剛 李東嶺
大孔吸附樹脂純化小米酚類化合物的工藝條件研究
王若蘭 田志琴 孔祥剛 李東嶺
(河南工業大學糧油食品學院,鄭州 450052)
為了分離純化小米多酚粗提物,選取4種大孔吸附樹脂,分別采用靜態吸附、解吸試驗比較其對小米多酚的吸附分離效果,篩選出吸附分離小米多酚粗提物效果較優的大孔樹脂,并對其動態吸附性能進行考察,結果表明:AB-8型樹脂對小米多酚粗提物具有較好的吸附和解吸效果,其最佳工藝條件為,吸附過程:上柱速率2 mL/min、上樣液pH 4左右、上樣液質量濃度在0.12~0.14 mg/mL范圍內;洗脫過程:采用體積分數為70%的乙醇溶液以1 mL/min洗脫速率進行洗脫。
小米 多酚化合物 大孔樹脂 純化
從小米中提取的多酚類物質包括兩類:羥基苯甲酸和羥基肉桂酸。羥基苯甲酸直接來源于苯甲酸(安息香酸),包括沒食子酸、對羥基苯甲酸、香草酸、紫丁香酸和原兒茶酸;羥基肉桂酸含有C6—C3結構,包括香豆酸、咖啡酸、阿魏酸和芥子酸[1]。G Sripriy等[2]、Prashant等[3]、Sanaa 等[4]都報道了小米中的多酚提取物對各種自由基具有清除作用。但目前我國對小米多酚的研究也僅限于提取,而天然產物的開發利用很難僅經提取得到的粗品實現,按文獻中的方法提取出的小米多酚,實際上是一種多酚含量較低的粗品,單寧、低分子質量多酚、簡單酚、黃酮類化合物,甚至糖類和色素等其他物質也包含在內[5-6],因而以這種粗品的形式,酚類物質的獨特作用可能發揮不充分或達不到要求,無法做進一步研究。所以純化成為小米多酚利用過程中必不可少的一步。
目前,純化多酚類化合物的方法包括有機溶劑萃取法、沉淀分離法、層析分離法、膜分離技術、HPLC技術等[7]。大孔吸附樹脂由于具有選擇性好、機械強度高、再生處理方便、吸附速度快等優點,近年被廣泛用于天然產物,包括中藥的分離和富集及食品活性成分的分離和純化,如皂苷、黃酮、蛋白質、多肽和酚類等物質[8]。因此,采用大孔樹脂層析法來探討其對小米多酚粗提取純化的最佳工藝條件。
1 材料與方法
1.1 材料與儀器
小米:產地山西,品種為晉谷9號;小米籽粒經篩選除去雜質后粉碎過80目篩,脫脂后待用。
沒食子酸標準品:General Material公司;Foin-Ciocalteu顯色劑:自制;其他試劑均為國產分析純。
樹脂:AB -8、DM -130、DM -301、NKA -9,均購自天津市海光化工有限公司,各樹脂的物理特性見表1。
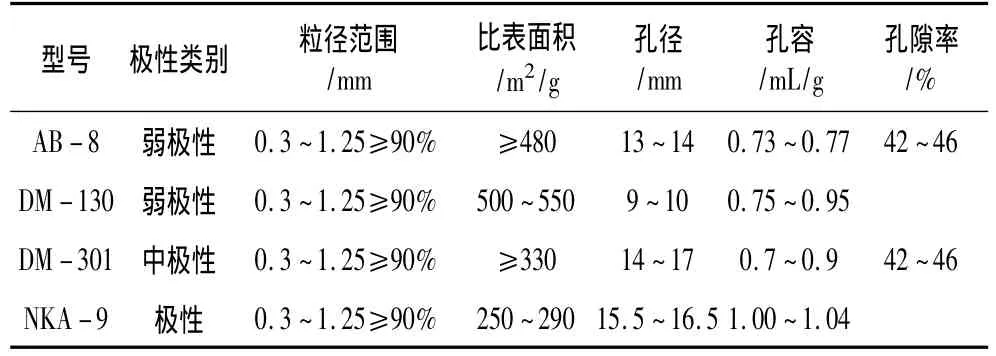
表1 大孔吸附樹脂的物理特性
JXFM110型錘式旋風磨:上海嘉定糧油儀器有限公司;M700美的微波爐:廣東美的微波爐制造有限公司;GL-20GⅡ型高速冷凍離心機:上海安亭科學儀器廠;PE-52型旋轉蒸發裝置:上海亞榮生化儀器廠;FD-1-50型真空冷凍干燥機:北京博醫康實驗儀器有限公司;KQ-250B超聲波清洗器:昆山市超生儀器有限公司;752N紫外可見分光光度計:上海菁華科技儀器有限公司;THZ-82B氣浴恒溫振蕩器:江蘇省金壇市醫療儀器廠;BS-160A自動部分收集器:上海市滬西機電廠;BT-200B數顯橫流泵:上海滬西分析儀器廠有限公司。
1.2 方法
1.2.1 樹脂的預處理
將市售各種樹脂先依次用丙酮、100%乙醇在室溫下密封浸泡48 h;然后用5%NaOH浸泡8 h,蒸餾水洗至中性;再用5%HCl浸泡8 h,用蒸餾水洗至中性;且洗出液與蒸餾水等量混合不顯渾濁為止。處理后的各樹脂密封保存,備用。
樹脂每次處理完多酚后要再生處理。再生時先用95%乙醇浸泡24 h,洗凈乙醇后再按預處理方法用5%NaOH與5%HCl溶液處理即可。
1.2.2 供試液的制備
將脫脂的小米粉采用文獻[6]優化的方法提取多酚,于40℃下經旋轉蒸發器濃縮、真空冷凍干燥得小米多酚粗提取物,然后在超聲波輔助條件下,用水溶解,抽濾得清液待用。
1.2.3 小米中多酚類物質的測定方法
以沒食子酸作為標準物,采用Foin-Ciocalteu法[9-10]測定總酚含量,以沒食子酸作為標準物。
1.2.3.1 Foin -Ciocalteu 顯色劑的配置[11]
稱取50.0 g鎢酸鈉和12.5 g鉬酸鈉,用350 mL蒸餾水溶于1 000 mL回流瓶中,加入25 mL磷酸和50 mL濃鹽酸,充分混勻,微沸回流10 h;再加入75.0 g硫酸鋰,25 mL蒸餾水和數滴溴水,然后開口繼續煮沸15 min,使得嗅水完全揮發為止;冷卻后定容至500 mL,過濾,濾液呈黃綠色,置于棕色試劑瓶中保存備用。此液在冰箱中可長期保存,使用時加入1倍體積的蒸餾水稀釋即可。
1.2.3.2 提取液中總多酚含量的測定
移取待測提取液1 mL于10 mL容量瓶中,依次加入1 mL Folin-Ciocalteu顯色劑,搖勻后加入2 ml 15%Na2CO3溶液定容到10 mL,室溫下反映2 h后測定A760。以沒食子酸作標樣,制標準曲線,得回歸方程為 y=0.068 7x-0.000 4,其中 y為沒食子酸含量,x為吸光度,R2=0.999 0,具有良好的線性關系。根據標準曲線計算總多酚的沒食子酸當量,總酚含量以每100 g小米粉的沒食子酸當量(mg)表示。
1.2.4 大孔吸附樹脂對小米多酚的靜態吸附試驗
分別稱取預處理后的各樹脂2.0 g(用濾紙吸干)置于錐形瓶中,準確加入30 mL小米多酚粗品溶液,避光密封,置氣浴恒溫振蕩器中,于20℃、180 r/min條件下振蕩,定時從上清液中取樣,檢測多酚含量的變化,按公式(1)、公式(2)計算靜態吸附量和靜態吸附率,并繪制吸附曲線。
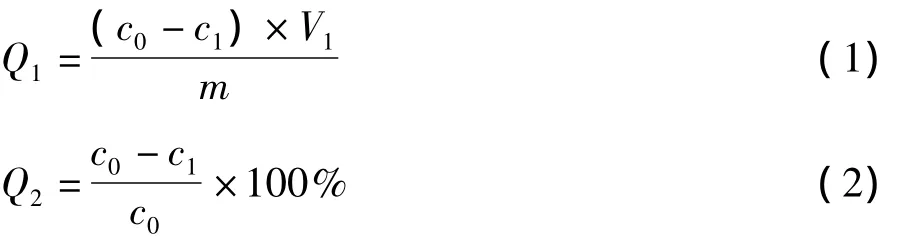
式中:Q1為吸附量/mg/g;Q2為吸附率/%;c0為吸附前供試液中小米多酚的質量濃度/mg·mL-1;c1為吸附后供試液中小米多酚的質量濃度/mg·mL-1;V1為供試液的體積/mL;m為樹脂濕重/g。
1.2.5 靜態解吸試驗
分別將上述充分吸附了小米多酚溶液的樹脂進行過濾,再將其置于錐形瓶中,加入體積分數為70%乙醇溶液40 mL,封口,置氣浴恒溫振蕩器中,于20℃、180 r/min條件下振蕩,24 h后從上清液中取樣,檢測多酚含量,由公式(3)計算靜態解吸率。

式中:P1為解吸率/%;c2為解吸液中小米多酚的質量濃度/mg·mL-1;V2為解吸液體積/mL。
1.2.6 動態吸附試驗
通過各種大孔樹脂對小米多酚的靜態吸附試驗,對篩選出一種理想的樹脂進行動態吸附試驗,將該樹脂裝入(16×700)mm玻璃層析柱中,柱床體積為60 mL,將一定濃度的小米多酚提取物上柱,控制上柱流速,分步收集流出液(5 mL/管),并檢測每單位流出液的小米多酚濃度,當流出液吸光度達上樣液的1/10時,認為小米多酚已透過,停止上樣,計算吸附量。
2 結果與討論
2.1 大孔吸附樹脂對小米多酚類物質的靜態吸附
4種樹脂對小米多酚的吸附與解吸結果見表2、圖1。
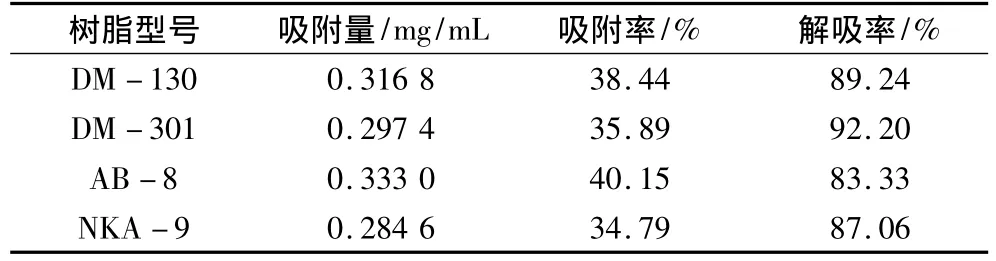
表2 4種樹脂對小米多酚的吸附與解吸
從表2中可以看出各樹脂對小米多酚的靜態吸附總量相差較大,4種大孔樹脂對小米多酚的吸附量的順序依次是:AB-8>DM-130>DM-301>NKA-9,這是因為小米多酚含有多酚結構,具有弱極性,AB-8、DM-130均為弱極性樹脂,一般弱極性吸附樹脂是含酰基的吸附樹脂,其表面兼有疏水和親水兩部分,既可由極性溶劑中吸附非極性物質,又可由非極性溶液中吸附極性物質[12]。因此較其他2種樹脂對小米多酚的吸附量大;而4種樹脂均具有較好的解吸率,都達到80%以上。
從圖1中可以看出,4種樹脂對小米多酚的吸附均為快速平衡型,起始階段吸附量都較大;且樹脂的吸附速率隨時間的增加而急劇下降,然后慢慢趨向飽和。10 h后均基本達到平衡,從總體上看AB-8型樹脂的吸附量始終優于另外3種樹脂。
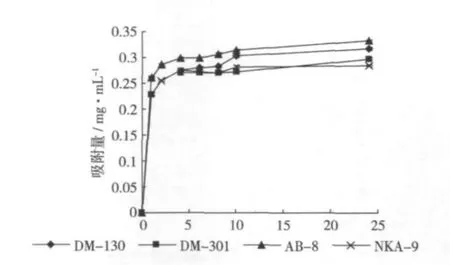
圖1 各樹脂對小米多酚的靜態吸附曲線
因此,綜合考慮各樹脂對小米多酚的吸附率和解吸率,選取AB-8型大孔樹脂作為吸附分離小米多酚的樹脂。
2.2 AB-8型樹脂對小米多酚類物質的動態吸附
2.2.1 動態吸附性能曲線的測定
為進一步了解AB-8型樹脂對小米多酚的吸附特性,進行動態吸附試驗,結果如圖2所示。從圖2可以看出,AB-8大孔樹脂對小米多酚具有良好的動態吸附性能,可處理2倍于柱體積的樣品溶液而無泄漏,并在較長的一段時間內保持低濃度泄漏。
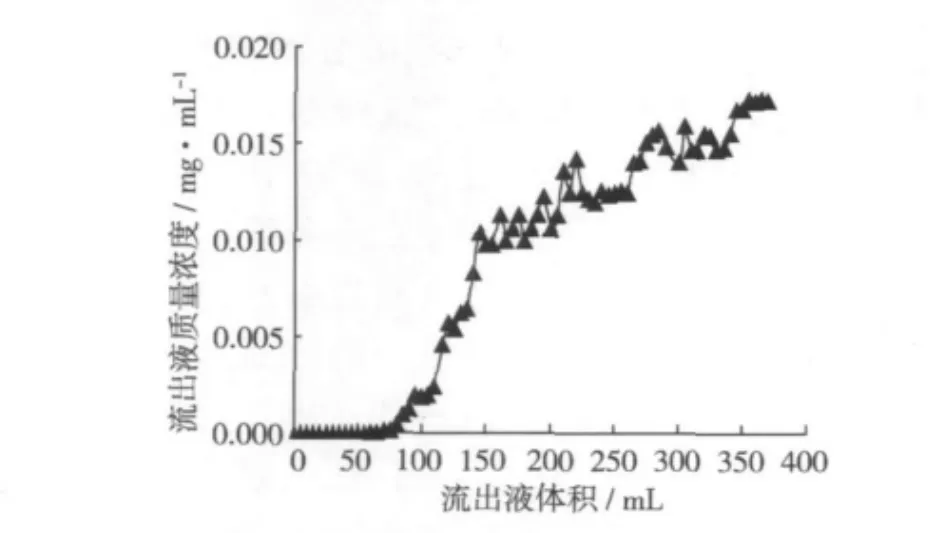
圖2 AB-8型樹脂對小米多酚的動態吸附曲線
2.2.2 上柱速率對吸附率的影響
控制上柱速率分別以 1、2、3、4、5 mL/min 的流速通過層析柱,以5 mL為單位收集流出液,并檢測每單位流出液的小米多酚濃度(當流出液中多酚濃度達到上柱液濃度的1/10時停止上樣),以上柱速率與動態吸附率作圖,考察上柱速率對AB-8大孔樹脂吸附小米多酚的影響,結果如圖3。
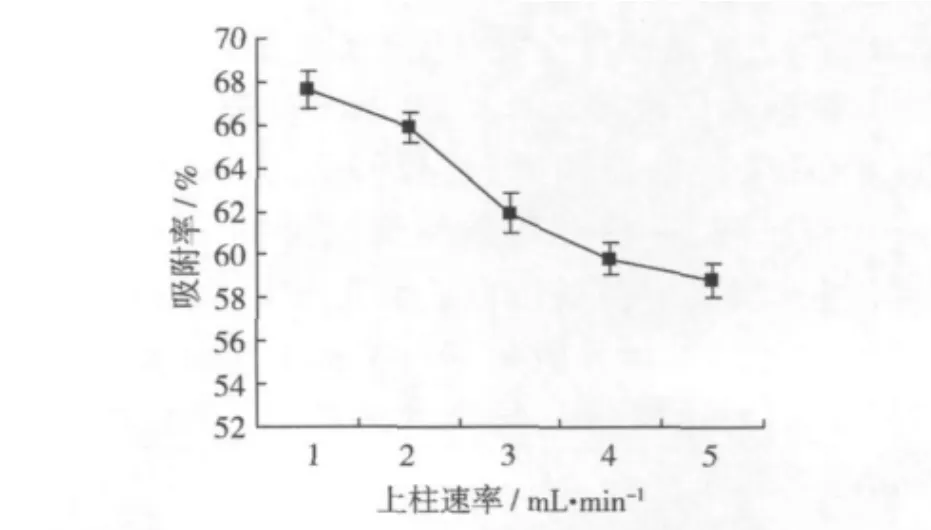
圖3 上柱速率對吸附率的影響
隨著上柱速率的增加,AB-8型樹脂對小米多酚的吸附率逐漸減小,當上柱速率為1 mL/min時,其動態吸附率為 67.62%,當上柱速率提高到5 mL/min時,其動態吸附率降至58.28%。因為多酚類化合物是一類大分子化合物,其擴散速度較慢,在較低的流速下,多酚類化合物有充分的時間進行膜擴散和顆粒內擴散,有利于提高樹脂的吸附量。如果上柱流速過大,則大量多酚類化合物還來不及被樹脂充分吸附便流出樹脂柱,樹脂的利用度大大降低。雖然較低的流速有利吸附的進行,但流速過低,操作時間又會延長。因此綜合考慮吸附率和生產效率,以上柱速率2 mL/min效果最佳。
2.2.3 樣液pH對吸附率的影響
量取不同pH的上樣液各100 mL,以2 mL/min的流速通過層析柱,以5 mL為單位收集流出液,并檢測每單位流出液的小米多酚濃度(當流出液中多酚濃度達到上柱液濃度的1/10時停止上樣),計算吸附率。考察上樣液pH對AB-8大孔樹脂吸附小米多酚的影響,結果如圖4。
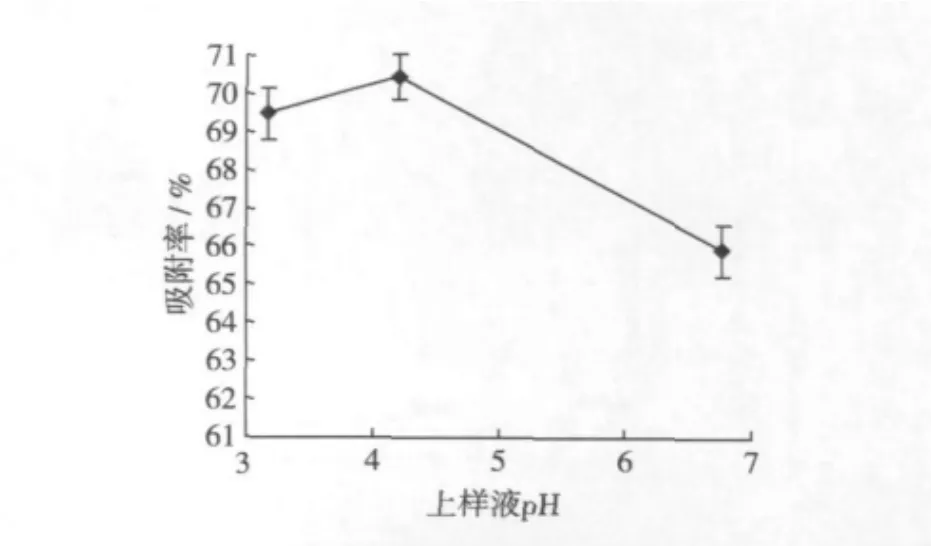
圖4 上樣液pH對吸附率的影響
在其他條件相同的情況下,上樣液的pH對小米多酚的吸附率有一定影響。小米多酚由于其具有多酚結構,顯弱酸性,因而,要達到較好的吸附效果,必須在弱酸或酸性條件下吸附。經測定,小米多酚粗提液的pH為4左右,而且比較穩定。
2.2.3 上樣液質量濃度對吸附率的影響
量取不同濃度、pH 4.20的上樣液各100 mL,以2 mL/min的流速通過層析柱,以5 mL為單位收集流出液,并檢測每單位流出液的小米多酚濃度(當流出液中多酚濃度達到上柱液濃度的1/10時停止上樣),計算吸附率。考察上樣液質量濃度對AB-8大孔樹脂吸附小米多酚的影響,結果如圖5。
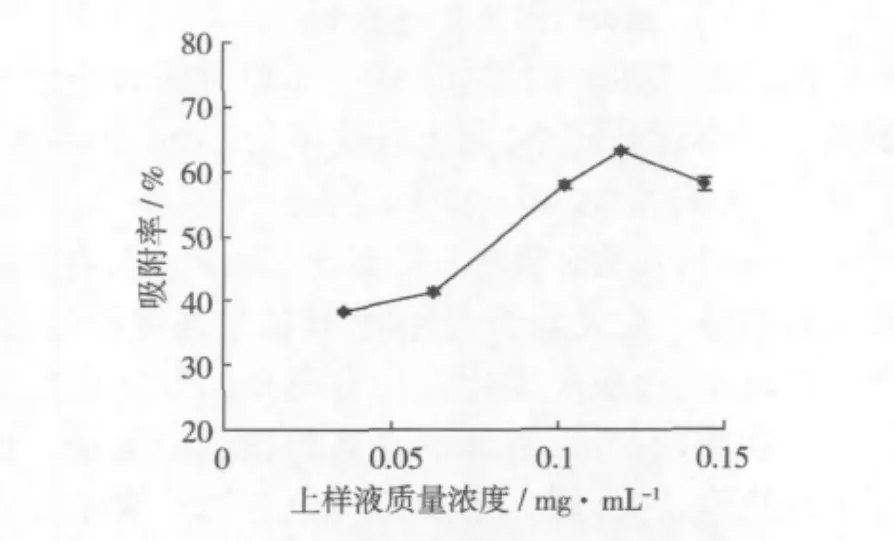
圖5 上樣液質量濃度對吸附率的影響
上樣液質量濃度較低時,隨濃度的增大,吸附量也增大,當上樣液質量濃度達到0.12 mg/mL時,吸附率略有下降,因此,上樣液質量濃度在0.12~0.14 mg/mL范圍內較合適。因為隨著多酚濃度的提高,與多酚競爭吸附的雜質量也隨之增加,加之流速恒定后,隨著料液濃度增加,可能使多酚等物質在樹脂內部擴散能力降低。
2.2.5 洗脫劑用量的選擇
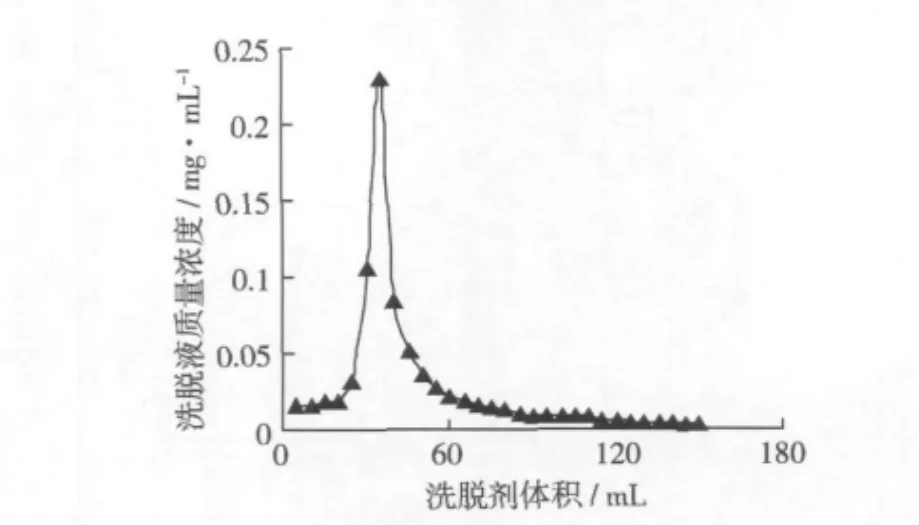
圖6 洗脫劑用量的選取
洗脫劑用量的選擇結果見圖6,當收集到2BV(柱床體積),即洗脫溶劑為120 mL時,小米多酚的洗脫率達到90%以上。洗脫劑用量過多,會造成乙醇的浪費,同時也為后續濃縮過程帶來一定的困難。因此,選取洗脫溶劑用量為120 mL即2BV。
2.2.6 洗脫劑流速對洗脫率的影響
量取濃度一定的上樣液100 mL,以2 mL/min的流速通過層析柱,吸附飽和后,分別用70%的乙醇以 0.5、1、1.5、2、2.5 mL/min 的流速洗脫,分步收集(每5 mL收集一次)乙醇洗脫液,并檢測每單位流出液的小米多酚濃度,計算解吸率,考察洗脫劑流速對洗脫率的影響。不同洗脫速率下的洗脫曲線見圖7、圖8。
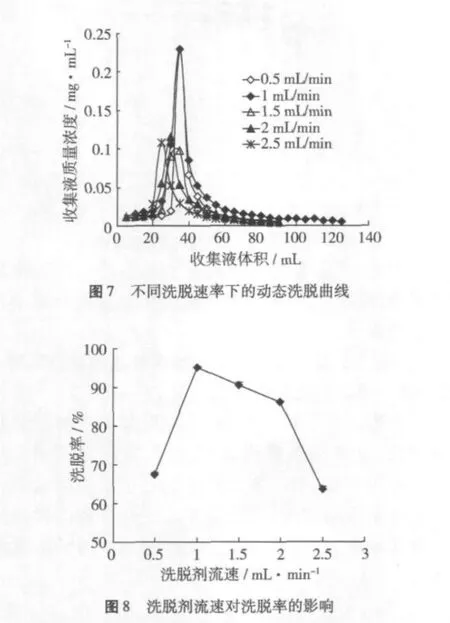
洗脫速度是影響樹脂吸附分離特性的一個重要因素。在解吸過程中,洗脫速度一般都比較慢,因為流速過快,洗脫性能差,洗脫帶寬,且拖尾嚴重,洗脫不完全;而流速過慢,又會延長生產周期,導致生產成本提高。從圖7可以看出,當洗脫劑的流速為0.5、1 mL/min時,洗脫峰相對集中,無明顯拖尾現象;當洗脫劑的流速為 1.5、2、2.5 mL/min時,雖然出峰較快,但洗脫帶寬,洗脫效果不太理想。因此,結合圖7、圖8,選擇1 mL/min洗脫速率為宜。
2.2.7 乙醇體積分數對洗脫率的影響
量取濃度一定的上樣液100 mL,以2 mL/min的流速通過層析柱,吸附飽和后,分別用體積分數為10%、30%、50%、70%、90%的乙醇水溶液及無水乙醇以1 mL/min的流速洗脫,分步收集(每5 mL收集一次)乙醇洗脫液,并檢測每單位流出液的小米多酚濃度,計算解吸率,考察乙醇體積分數對洗脫率的影響,結果如圖9、圖10。
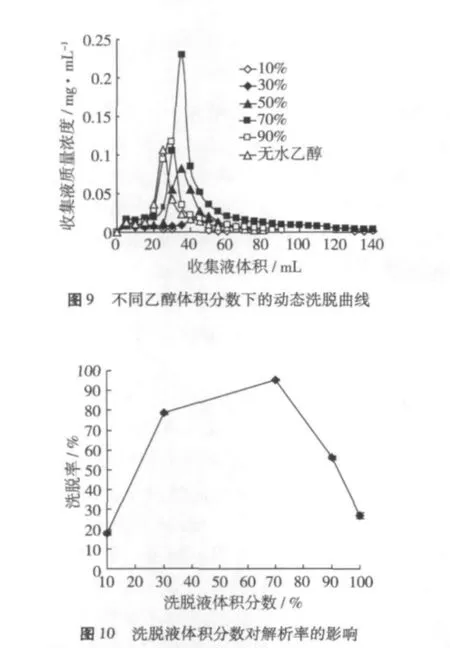
從圖9可看出,當洗脫液的體積分數為70%時,洗脫峰相對集中,無明顯拖尾現象;而體積分數為10%的乙醇溶液對AB-8型大孔樹脂吸附的小米多酚沒有解吸效果,當洗脫液用量為200 mL時,仍未檢測出小米多酚。這說明小米多酚具有一定的極性。從圖10可看出,隨著乙醇體積分數的增加,洗脫率逐漸增大,當乙醇體積分數達到70%時,洗脫率已達到95%,后隨乙醇體積分數的繼續增加,洗脫率逐漸減小。因此,結合圖9、圖10,選擇體積分數為70%的乙醇溶液作為洗脫劑。
3 結論
通過靜態吸附、解吸試驗表明:AB-8型樹脂是一種分離純化小米多酚類物質理想的樹脂,其吸附量為0.333 0 mg/mL,吸附率為 40.15%,解吸率為83.33%。
通過動態吸附、解吸試驗得到AB-8型樹脂分離純化小米多酚類物質的最佳工藝條件,吸附過程:上樣流速2 mL/min,上樣液質量濃度為0.12~0.14 mg/mL,上樣液pH 4左右;洗脫過程:以70%的乙醇為洗脫劑,洗脫流速為1 mL/min。
[1]Linda Dykes,Lloyd W Rooney.Sorghum and millet phenols and antioxidants[J].Journal of Cereal Science,2006,44:236-251
[2]G Sripriy,K Chandrasekharan,V SMurty,et al.ESR spectroscopic studies on free radical quenching action of finger millet(Eleusine coracana)[J].Food Chemistry,1996,57(4):537-540
[3]Prashant SHegde,T SChandra.ESR spectroscopic study reveals higher free radical quenching potential in kodo millet(Paspalum scrobiculatum)compared to other millets[J].Food Chemistry,2005,92:177 -182
[4]Sanaa Ragaee,El- Sayed M Abdel- Aal,Maher Noaman.Antioxidant activity and nutrient composition of Selected cereals for food use[J].Food Chemistry,2006,98:32 - 38
[5]薛月圓,林勤保.小米中總酚提取條件的優化[J].農產品加工·學刊,2007,4:24 -26
[6]王若蘭,田志琴,李東嶺,等.微波法提取小米中多酚類活性物質的研究[J].河南工業大學學報:自然科學版,2010,31(6):16 -21
[7]徐任生.天然產物化學[M].北京:科學出版社,1997:24-25
[8]羅艷玲,歐仕益.大孔樹脂在食品活性成分分離中的應用[J].食品與機械,2005,21(5):81 -83
[9]Bonoli M,Verardo V,Marconi E,et al.Antioxidant phenols in barley(Horde- um vulgare L.)flour:comparative spectrophotometric study among extraction methods of free and bound phenolic compounds[J].Journal of Agricultural and Food Chemistry,2004,52:5195 -5200
[10]張海暉,段玉清,倪燕,等.谷物中多酚類化合物提取方法及抗氧化效果研究[J].中國糧油學報,2008,23(6):107-110
[11]Singleton V L,Rossi JA.Colorimetry of total phenolics with phosphomolybdic- phosphotungstic acid reagents[J].The American Journal of Enology and Viticulture,1965,16:144-158
[12]董珂.大孔樹脂技術在中藥研究中的應用概況[J].藥學實踐雜志,2006,24(1):13 -16.
Purification Process of Polyphenol Compound from Foxtail Millet by Macroporous Resins
Wang Ruolan Tian Zhiqin Kong Xianggang Li Dongling
(College of Food Science and Engineering,Henan University of Tech-nology,Zhengzhou 450052)
In order to separate and purify polyphenol compound from foxtail millet,four types of macroporous resin were selected to compare their performances in absorbing and desorbing polyphenol compound from foxtail millet,the optimal absorbent material for polyphenol compound from foxtail millet was decided and its dynamic absorbing behavior was studied in this paper.The results showed that AB -8 resin possessed a higher absorption and desorption capacity and the optimal technological conditions of adsorption velocity was 2 mL/min,solution pH was about 4,solution concentration was 0.12 mg/mL to 0.14 mg/mL and the eluting solvent was 70%ethanol at 1 mL/min flow rate.
foxtail millet,polyphenol compound,macroporous resins,purification
TS202.1
A
1003-0174(2011)10-0035-06
2010-12-18
王若蘭,女,1960年出生,教授,碩士生導師,糧食儲藏及品質控制

