現(xiàn)代海底熱液場(chǎng)低溫彌散流區(qū)微生物生態(tài)的研究進(jìn)展*
李季偉,周懷陽,彭曉彤,陳智強(qiáng),孫治雷,李江濤,陳 順,章力學(xué)
(1.西南交通大學(xué) 地球科學(xué)與環(huán)境工程學(xué)院,四川 成都610031;2.中國科學(xué)院 廣州地球化學(xué)研究所,廣東 廣州510640;3.同濟(jì)大學(xué) 海洋地質(zhì)國家重點(diǎn)實(shí)驗(yàn)室,上海200092)
現(xiàn)代海底熱液場(chǎng)低溫彌散流區(qū)微生物生態(tài)的研究進(jìn)展*
李季偉1,2,周懷陽3,彭曉彤3,陳智強(qiáng)2,孫治雷2,李江濤3,陳 順3,章力學(xué)3
(1.西南交通大學(xué) 地球科學(xué)與環(huán)境工程學(xué)院,四川 成都610031;2.中國科學(xué)院 廣州地球化學(xué)研究所,廣東 廣州510640;3.同濟(jì)大學(xué) 海洋地質(zhì)國家重點(diǎn)實(shí)驗(yàn)室,上海200092)
現(xiàn)代海底低溫?zé)嵋簭浬⒘鲄^(qū)微生物生態(tài)的發(fā)育情況已經(jīng)成為當(dāng)前熱液系統(tǒng)研究關(guān)注的熱點(diǎn)之一。大量的分析表明在低溫?zé)嵋簭浬⒘鲄^(qū)賦存著豐富的化能自養(yǎng)微生物,以硫、鐵等元素的氧化還原反應(yīng)獲取新陳代謝能量,這些微生物的分布與低溫?zé)嵋毫黧w的物理化學(xué)條件有著密切的聯(lián)系。這些發(fā)現(xiàn)極大地豐富了我們對(duì)低溫彌散流區(qū)微生物生態(tài)、關(guān)鍵地球化學(xué)過程與微生物新陳代謝耦合關(guān)系的認(rèn)識(shí)。此外,低溫?zé)嵋毫黧w是研究洋殼深部生物圈的窗口,通過這個(gè)窗口可以了解地殼內(nèi)部生命的新陳代謝方式,進(jìn)而理解地球內(nèi)部微生物與洋殼內(nèi)部流體、巖石之間的相互作用機(jī)制。
低溫?zé)嵋簭浬⒘鳎晃⑸锷鷳B(tài);化能自養(yǎng)微生物;深部生物圈
(陳 靖 編輯)
20世紀(jì)70年代后期,科學(xué)家在東太平洋洋隆(EPR)和加拉帕戈斯擴(kuò)張中心發(fā)現(xiàn)了一種低溫?zé)嵋簭男滟|(zhì)基巖的裂隙中彌散溢出,在這些彌散流的溢出點(diǎn)周圍發(fā)育著大量的與硫氧化菌共生的管狀蠕蟲和雙殼貝類熱液生物群落[1]。此后的幾十年來,大量的現(xiàn)代海底熱液活動(dòng)相繼被報(bào)道,而在這些海底熱液場(chǎng)中,大范圍的低溫彌散流區(qū)域總是同時(shí)伴隨著高溫集中流出現(xiàn)[2-4]。這些熱液環(huán)境中發(fā)育的生態(tài)群落與地球上其它以光合作用為基礎(chǔ)的生態(tài)群落有所不同,它們是以化能合成的自養(yǎng)微生物為基礎(chǔ)。這些微生物通過氧化熱液流體中的還原性物質(zhì)(CH4,H2,H2S,F(xiàn)e2+和 Mn2+等),從而獲取新陳代謝的能量[5-7]。研究者采用比較測(cè)量等手段對(duì)熱液場(chǎng)進(jìn)行詳盡地分析后發(fā)現(xiàn),低溫彌散流的化學(xué)通量比高溫集中流大[8],熱通量也是高溫集中流的幾倍以上[9-10]。因此,低溫?zé)嵋簩?duì)于依靠流體中的化學(xué)物質(zhì)生長(zhǎng)與繁衍的熱液生態(tài)群落具有更重要的意義。然而相對(duì)高溫?zé)嵋簢娍诖罅康奈⑸飳W(xué)研究,人們對(duì)低溫?zé)嵋簭浬⒘鞯年P(guān)注程度仍非常低[11-12]。近年來,隨著對(duì)熱液系統(tǒng)的研究深入,人們逐漸認(rèn)識(shí)到低溫?zé)嵋簩?duì)海洋熱通量和化學(xué)通量的貢獻(xiàn),以及對(duì)生命起源和深部生物圈探索的意義,對(duì)低溫?zé)嵋簭浬⒘鞯奈⑸镅芯恳仓匾暺饋恚?3-17]。本研究綜述了近年來低溫?zé)嵋簭浬⒘鲄^(qū)域微生物生態(tài)的研究進(jìn)展,以及這些研究對(duì)深部生物圈探索的啟示。
1 海底低溫?zé)嵋簭浬⒘鞯男纬蓹C(jī)制與化學(xué)組成
研究低溫彌散流的形成機(jī)制與熱液地球化學(xué)環(huán)境參數(shù)的變化,對(duì)于理解低溫彌散流區(qū)域微生物多樣性與變化具有重要意義。研究者結(jié)合目前已經(jīng)發(fā)現(xiàn)的低溫?zé)嵋簭浬⒘鳠嵋簣?chǎng)的數(shù)據(jù),提出了低溫?zé)嵋毫黧w的3種形成機(jī)制:1)高溫?zé)嵋合喾蛛x的流體與洋殼中海水相互混合而被稀釋[11-12];2)高溫?zé)嵋毫黧w在淺層地殼中的傳導(dǎo)性冷卻;3)高溫流體、海水和被改造的海水的3組分相混合[18]。這3種機(jī)制中由第一種占據(jù)主導(dǎo)地位,共同控制現(xiàn)代海底熱液彌散流的形成[19]。
海底低溫?zé)嵋簭浬⒘黧w的化學(xué)組成復(fù)雜,通常富含CO2,CH4,H2,H2S和Si在一些樣品中也富含F(xiàn)e2+,Mn2+[4,20-24](表1)。它們的組成在時(shí)間和空間上是高度變化的[5,17,25-27],即使在同一個(gè)熱液區(qū)域,如東北太平洋形成的低溫?zé)嵋毫黧w,其熱液化學(xué)成分的變化也很大(表1)。這種多變性是由熱液終端端元流體的時(shí)空變化所控制,并受到深海底部的熱液流體稀釋強(qiáng)度的影響[2,5,25,28];另外,海底深部傳導(dǎo)性熱交換、沉淀過程、火山活動(dòng)、潮汐作用以及微生物改造等也是影響化學(xué)成分多變性的重要因素[17]。總之,低溫?zé)嵋毫黧w中化學(xué)組分多變,富含豐富的還原性物質(zhì),正是這些還原性物質(zhì)所引起的氧化還原放能反應(yīng)為海底熱液生態(tài)系統(tǒng)的繁衍提供了充足的物質(zhì)基礎(chǔ)。
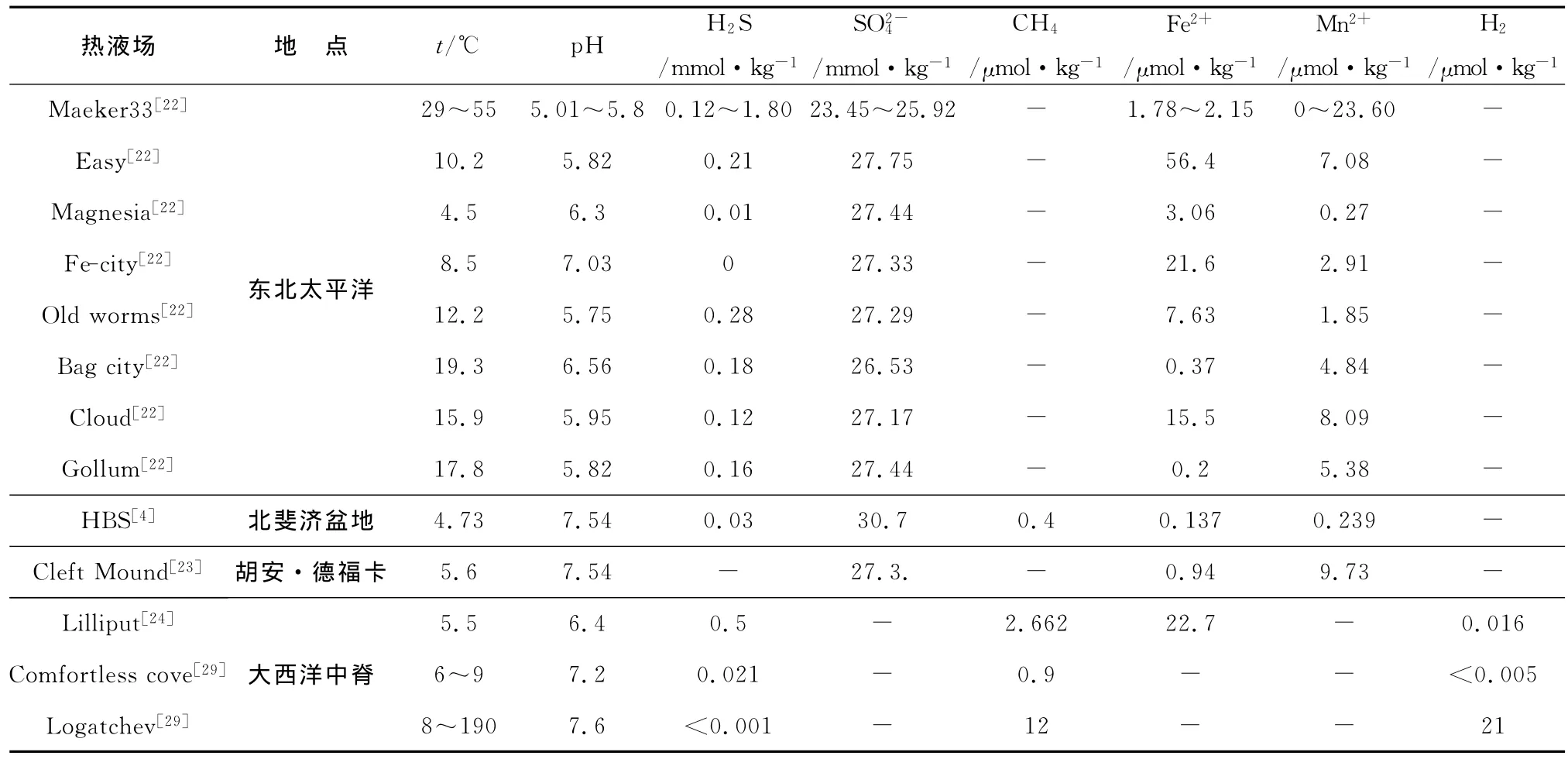
表1 熱液低溫彌散流的流體化學(xué)組成Table 1 Chemical compositions of the low-temperature hydrothermal diffuse flow
2 海底低溫?zé)嵋簭浬⒘鲄^(qū)微生物生態(tài)的研究進(jìn)展
目前,對(duì)現(xiàn)代海底低溫?zé)嵋簭浬⒘鲄^(qū)微生物學(xué)的研究手段主要為傳統(tǒng)的富集分離培養(yǎng)和非培養(yǎng)技術(shù)[30];特別是基于16SrRNA基因和特征性功能基因的系統(tǒng)發(fā)育分析等現(xiàn)代分子生物學(xué)技術(shù)的發(fā)展,加快了對(duì)現(xiàn)代熱液系統(tǒng)微生物研究的步伐。目前在大多數(shù)已發(fā)現(xiàn)的低溫?zé)嵋簠^(qū)域都有關(guān)于熱液微生物的研究報(bào)道,包括胡安·德福卡洋脊[13,15,31],大西洋中脊[24],有機(jī)質(zhì)豐富的 Guaymas盆地[32],沖繩海槽[33],馬里亞納擴(kuò)展盆地[34]和深海海山[22,35]等。研究結(jié)果表明,在這些低溫彌散流熱液場(chǎng)內(nèi)的微生物具有一些共同的生態(tài)學(xué)特征:微生物生物量大、種類豐富、覆蓋廣。其中已發(fā)現(xiàn)的微生物種類包括α,β,γ,ε,ζ和δ變形桿菌,酸桿菌門(Acidobacteria)、產(chǎn)水菌目(Aquificales)、擬桿菌門(Bacteroidetes)、壁厚菌門(Firmicutes)、浮霉?fàn)罹≒lanctomycetes)、各種Candidate Divisions細(xì)菌、嗜熱球菌(Thermococcus)、甲烷球菌(Methanococcus)和其他一些嗜熱和超嗜熱古菌等[15,31-32,34,36-39]。在這些豐富的微生物類型中,化能合成自養(yǎng)微生物是海底熱液系統(tǒng)中生命新陳代謝的初級(jí)能量制造者,它們的存在是熱液生物群落繁衍的基礎(chǔ)。這些化能合成反應(yīng)包括了硫氧化、鐵氧化、氫氧化、甲烷氧化和硫酸鹽還原等,其中硫氧化與鐵氧化反應(yīng)最為重要,與之相關(guān)的微生物在低溫?zé)嵋簣?chǎng)中的發(fā)現(xiàn)也最為頻繁(表2)。

表2 低溫?zé)嵋簭浬⒘鲄^(qū)的微生物生態(tài)研究成果Table 2Results from the studies of microbial ecology in the low-temperature hydrothermal diffuse flow areas
2.1 硫氧化微生物
與硫氧化相關(guān)的新陳代謝反應(yīng)是低溫?zé)嵋涵h(huán)境中微生物獲取能量的重要途徑。與周圍背景環(huán)境相比,低溫?zé)嵋簭浬⒘髦蠬2S的濃度相對(duì)周圍海水呈數(shù)量級(jí)倍數(shù)增加[22],這些含硫化合物的存在為化能合成自養(yǎng)微生物提供了新陳代謝反應(yīng)所需的電子供體[42]。目前在低溫?zé)嵋合到y(tǒng)中發(fā)現(xiàn)的硫氧化微生物主要屬于ε、γ和α變形桿菌。
ε變形桿菌的生理機(jī)能多樣,能在高溫條件下以硫元素的化學(xué)反應(yīng)進(jìn)行自養(yǎng)或異養(yǎng)活動(dòng)[43],其中的一些類群是典型的從硫或硫代硫酸鹽氧化反應(yīng)過程中獲取能量的微生物,如Sulfurovumlithotrophica,Sulfurimonas,Thiovulumspp.和弓形桿菌Arcobacterspp.等。ε變形桿菌在熱液環(huán)境中廣泛存在,包括流體、微生物菌席或與熱液大型生物共生[36,44-47]。Opatkiewicz等[43]在胡安·德福卡洋脊Axial海山上的低溫?zé)嵋簣?chǎng)中就發(fā)現(xiàn)了豐富的ε變形桿菌,并指出它們的分布與流體中氫、硫和鐵等元素的濃度有關(guān)。Rassa等[35]在夏威夷Loihi海山上的低溫?zé)嵋簣?chǎng)中不同溫度梯度的彌散流處放置了41個(gè)原位生長(zhǎng)微腔體(microbial growth chambers)。經(jīng)過短期(4~10d)和長(zhǎng)期(1~6a)的觀測(cè),發(fā)現(xiàn)在中間溫度(51℃)的彌散流處ε變形桿菌是微生物群落的主要組成之一,而在溫度較高處(71℃)其占據(jù)更主導(dǎo)的地位。此外,Perner等[24]在大西洋中脊最南部(9°S)的Lilliput低溫?zé)嵋簣?chǎng)中也發(fā)現(xiàn)了大量的ε變形桿菌,有長(zhǎng)桿、絲縷、短桿和球狀等多樣形態(tài)結(jié)構(gòu)。
除了ε變形桿菌外,γ變形桿菌中的Thiomicrospiraspp.也是熱液環(huán)境中常見的硫氧化菌。如在Lilliput低溫?zé)嵋簣?chǎng),γ變形桿菌中的Thiomicrospiraspp.與ε變形桿菌一樣占據(jù)優(yōu)勢(shì)地位[24]。Podgorsek等[40]在斐濟(jì)盆地北部的富H2S的低溫彌散流熱液場(chǎng)中也分離獲得大量α和γ變形桿菌中的自養(yǎng)或兼養(yǎng)硫氧化細(xì)菌。
2.2 鐵氧化微生物
鐵既可以作為化能自養(yǎng)的電子供體也可以作為厭氧呼吸的電子受體[48]。低溫?zé)嵋簭浬⒘黧w中富含的還原性鐵為鐵氧化的自養(yǎng)微生物提供了豐富的能量,因此在富鐵的海底熱液低溫彌散流區(qū)域內(nèi)發(fā)現(xiàn)了鐵氧化菌的廣泛分布。目前在熱液場(chǎng)中已經(jīng)發(fā)現(xiàn)的鐵氧化微生物包括α、β和γ變形桿菌,如赭色纖毛菌Leptothrixochracea,含鐵嘉氏鐵柄桿菌Galliionellaferruginea,Gallionellacapsiferriformans,Sideroxydans lithotrophicus等[49-51],以及最近發(fā)現(xiàn)的ζ變形桿菌[52]。
Mariprofundusferrooxydans是從Loihi海山上富鐵菌席中分離獲得(圖1a),它是1種嗜中性的化能自養(yǎng)鐵氧化菌,以二氧化碳為碳源,能從二價(jià)鐵轉(zhuǎn)變成三價(jià)鐵的氧化反應(yīng)中獲取新陳代謝的能量[52-53]。通過對(duì)純培養(yǎng)微生物M.ferrooxydans的分類鑒定結(jié)果進(jìn)行評(píng)估,人們將其劃歸為變形桿菌門下一個(gè)新的亞類-ζ變形桿菌。
ζ變形桿菌在低溫?zé)嵋毫黧w及其沉積物中的發(fā)現(xiàn)具有重要意義。因?yàn)閺?0世紀(jì)80年代開始,在現(xiàn)代和古代的熱液礦物中發(fā)現(xiàn)了大量的莖狀鐵氧化物[54],當(dāng)時(shí)科學(xué)家從形態(tài)學(xué)上推測(cè)這是1種生物成因的鐵氧化物,但卻缺乏有力的生物學(xué)證據(jù)。而最近的研究發(fā)現(xiàn),M.ferrooxydans在生長(zhǎng)過程中能夠產(chǎn)生結(jié)構(gòu)相似的鐵氧化物(圖1b)[53],當(dāng)其死亡后鐵氧化物并能在其表面保存下來(圖1c)[53,55]。因而,ζ變形桿菌的發(fā)現(xiàn)為莖狀鐵氧化物的生物成因推論提供了有力的支持。
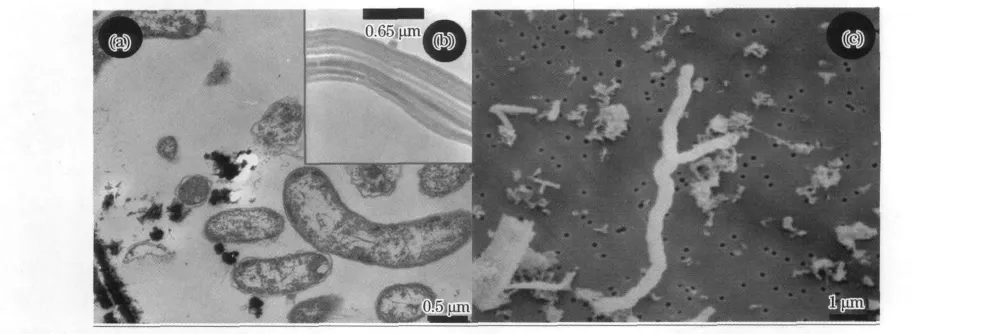
圖1 Mariprofundusferrooxydans的形態(tài)Fig.1 Morphology of Mariprofundusferrooxydans
人們最初認(rèn)為ζ變形桿菌在自然界中的分布比較少,而隨著進(jìn)一步調(diào)查后發(fā)現(xiàn)它們其實(shí)廣泛分布于一些富鐵的低溫?zé)嵋簣?chǎng)中。例如,在Tonga Arc海山上發(fā)現(xiàn)了一些富鐵低溫彌散流(30~70℃,Volcano 1),其流體形成的主要礦物是二峰水鐵礦(two-line ferrihydrite)。透射電鏡顯示,這些鐵氧化物的形態(tài)與M.ferrooxydans形成的構(gòu)型非常一致[56],隨后的分子生物學(xué)的研究結(jié)果也證實(shí)了在Volcano 1處分布了大量的ζ變形桿菌[41]。此外,Davis等[23]在胡安·德福卡洋脊Cleft段低溫彌散流場(chǎng)中所采集的沉積物柱也發(fā)現(xiàn)大量的ζ變形桿菌。而在馬里亞納盆地的低溫?zé)嵋簭浬⒘鲄^(qū)的微生物菌席中,熒光定量PCR的結(jié)果表明,它們更是占到了原核細(xì)胞總數(shù)的22%[34]。關(guān)于低溫彌散流中發(fā)現(xiàn)ζ變形桿菌的報(bào)道還有很多,如馬尼亞納島弧中的Eifuku海山和夏威夷Loihi海山[35]等。
雖然對(duì)ζ變形桿菌發(fā)現(xiàn)的報(bào)道越來越多,然而目前對(duì)它們的研究尚屬起步階段,上述研究也表明,M.ferrooxydans只是ζ變形桿菌中一個(gè)較小的分支,僅憑一株可培養(yǎng)的M.ferrooxydans還不能將ζ變形桿菌的所有功能研究清楚。因此,還需要開展大量的ζ變形桿菌的適應(yīng)性培養(yǎng)工作,深入探索它們的生理化學(xué)特征。
2.3 氫氧化微生物
在超基性基巖上發(fā)育的海底低溫?zé)嵋簭浬⒘黧w中通常富含H2,H2在氧化過程中能釋放大量的能量,這就為以H2的氧化反應(yīng)獲取能量的微生物提供了存在的基礎(chǔ)。微生物消耗或產(chǎn)生氫氣是由氫化酶所催化,氫化酶包括3種,分別為[NiFe]-氫化酶、[FeFe]-氫化酶和[Fe]-氫化酶,它們之間并沒有分子進(jìn)化上的聯(lián)系[29,57]。Perner等[29]對(duì)大西洋中脊不同基底上發(fā)育的低溫?zé)嵋簣?chǎng)進(jìn)行了對(duì)比,研究對(duì)象包括Comfortless Cove熱液場(chǎng)中的Clueless低溫彌散流噴口(玄武質(zhì)基底)和Logatchev熱液場(chǎng)中的Quest彌散流噴口(超基性巖基底)。結(jié)果表明,以玄武質(zhì)為基底的Clueless低溫?zé)嵋毫黧w中H2濃度很低,且氫化酶基因僅有2種;而以超基性巖為基底的Quest低溫?zé)嵋毫黧w中H2濃度非常高,相應(yīng)的氫化酶基因也非常豐富。這一研究結(jié)果同時(shí)表明在海底低溫?zé)嵋簣?chǎng)中影響氫氧化微生物分布的重要因素是水體中H2和O2的濃度的大小[29]。目前在低溫?zé)嵋簠^(qū)域發(fā)現(xiàn)的氫氧化微生物有產(chǎn)水菌目(Aquificales),Dehalococcoidales,Desulfurococcale和ε變形桿菌中的一些下屬菌種微生物,以及利用H2和CO2產(chǎn)甲烷的甲烷球菌目Methanococcales等[29,58-60]。
2.4 其他新陳代謝途徑的微生物
除硫氧化、鐵氧化和氫氧化等化能自養(yǎng)微生物的頻繁出現(xiàn)外,在低溫?zé)嵋簢娍谖⑸锵到y(tǒng)中,甲烷氧化菌、產(chǎn)甲烷古菌、氨氧化古菌和硫酸鹽還原菌也是不可忽略的組成部分,它們通過自養(yǎng)或異氧方式進(jìn)行生命活動(dòng)。前人利用甲烷氧化(pmoA)、氨氧化(amoA)和硫酸鹽還原(dsrAB)等功能基因已經(jīng)對(duì)這些微生物在熱液環(huán)境中的分布進(jìn)行了研究。Nercessian等[61]對(duì)東太平洋洋隆13°N和大西洋中脊Rainbow熱液場(chǎng)的低溫流體、沉積物進(jìn)行了分析,通過功能基因發(fā)現(xiàn)了大量的甲烷氧化、產(chǎn)甲烷與硫酸鹽還原微生物的存在,包括超嗜熱的Methanopyrales和甲烷暖球菌科(Methanocaldococcaceae)、嗜熱和喜溫的甲烷球菌科(Methanococcaceae),嗜熱的甲基熱菌屬(Methylothermus)和喜溫的I型甲烷氧化菌,和超嗜熱的古烷菌目(Archaeoglobales)、嗜熱的熱脫硫桿菌目(Thermodesulfobacteriales)和喜溫的脫硫葉菌科(Desulfobulbaceae)。
3 海底低溫?zé)嵋簭浬⒘黧w所揭示的深部生物圈
低溫?zé)嵋毫黧w研究的一個(gè)重要意義在于其環(huán)境是研究地球深部生物圈的窗口[62]。Gold[63]認(rèn)為嗜熱與超嗜熱微生物占據(jù)了地殼的部分區(qū)域,其生物量很可能超過地表生物的總和。因?yàn)楹5咨喜?00m以內(nèi)的洋殼中孔隙度較高,熱液流體與海水在其中能夠輕易運(yùn)移而循環(huán),這種循環(huán)能引起化學(xué)梯度的變化,其為一些極端微生物在洋殼深部中的生存提供了良好的物質(zhì)基礎(chǔ)和環(huán)境。在紐芬蘭島邊緣的ODP210鉆探結(jié)果顯示微生物存在的深度甚至可以延伸至1 600多m[64]。由于樣品采集的限制,直接導(dǎo)致對(duì)洋殼內(nèi)部的研究非常困難,所以,通過低溫?zé)嵋毫黧w的研究來探測(cè)洋殼深部生物圈就顯得彌足珍貴[13,15,31]。通過對(duì)流體中地球化學(xué)參數(shù)的分析,可以有效地了解微生物在深部生物圈中的生物地球化學(xué)作用,如O2,S2-,NO-3,SO2-4和H2的消耗,NH+4和CH4的產(chǎn)生都是微生物在熱液流體中作用的標(biāo)志[16-17,25,65-66]。例如,在東太平洋9°50′N和Suiyo海山的熱液場(chǎng)中,通過對(duì)低溫?zé)嵋毫黧w與高溫?zé)嵋毫黧w中的甲烷與二氧化碳同位素的分餾證明了深海底部存在著產(chǎn)甲烷與甲烷消耗的微生物活動(dòng)的存在[19,27]。通過培養(yǎng)和非培養(yǎng)手段對(duì)低溫?zé)嵋毫黧w中微生物進(jìn)行研究,能更直接反映深部微生物的分布狀態(tài)和新陳代謝方式。例如,Holden等[13]在胡安·德福卡洋脊CoAxial低溫?zé)釓浬⒘黧w(15~30℃)中分離出了一些最佳生長(zhǎng)溫度為55~60℃的嗜熱和超嗜熱微生物;在排除了這些微生物來自周圍高溫流體的微生物污染這個(gè)可能后,研究人員指出它們應(yīng)當(dāng)來源于環(huán)境溫度更適合其生存的洋殼深部。另外,Kato等[67]研究了馬里亞納南部熱液場(chǎng)中采用鉆孔所取得的低溫洋殼流體(2~69℃),表明在這些流體中存在大量的細(xì)菌和古菌,其中Thiomicrospira和ζ變形桿菌占優(yōu)勢(shì)地位,ζ變形桿菌的細(xì)胞數(shù)量占原核細(xì)胞總數(shù)的32%。這些對(duì)低溫?zé)嵋毫黧w的研究結(jié)果證明了洋殼深部生物圈的存在,其新陳代謝的能量主要來源于甲烷、鐵的氧化和硫的氧化與還原。
Huber等[15]通過對(duì)東北太平洋Axial海山的低溫?zé)嵋簣?chǎng)(Marker33)中流體微生物多樣性的長(zhǎng)期跟蹤,基于前人對(duì)該區(qū)域地質(zhì)和化學(xué)的報(bào)道,提出了洋殼深部生物圈的微生物種群與熱液化學(xué)過程的理想模式(圖2)[15]。根據(jù)熱液與海水兩端元的混合模式,將洋殼上部深部生物圈內(nèi)劃分成3個(gè)層位:1)上層,以海水為主,混入了少量的熱液。海水為這一層中的微生物提供了足夠的碳源、能量和電子受體,其優(yōu)勢(shì)群體為喜溫的硫、鐵或甲烷的氧化者,如ε,ζ,β和γ變形桿菌等;2)最下面的深部層為厭氧、溫度高于50℃的環(huán)境,以熱液流體為主,并混入少量的海水。這個(gè)區(qū)域?yàn)橐恍┫矞厥葻岬牧蜻€原菌和利用熱成因有機(jī)質(zhì)的嗜熱古菌提供了適合的生存環(huán)境,如脫硫桿菌屬(Desulfurobacterium)和熱球菌目(Thermococcales)[13,22,64];3)中間層是化學(xué)梯度變化最大的氧化還原層,熱液流體和海水在此能夠充分混合,提供了從無氧到有氧,中溫到高溫的各種微環(huán)境。該層中主要發(fā)育一些厭氧嗜溫的產(chǎn)甲烷生物,如甲烷球菌目(Methanococcales)或一些新發(fā)現(xiàn)的細(xì)菌,如Candidate Division ABY1和 WS6以及一些需氧或微需氧的硫、鐵與甲烷氧化細(xì)菌,如ε和γ變形桿菌[15]。

圖2 低溫彌散流微生物生態(tài)研究所啟示的深部生物圈分布圖Fig.2 Diagram of the deep biosphere indicated by the microbial community occurring in the low temperature diffuse flow area
4 結(jié) 語
海底熱液系統(tǒng)是現(xiàn)代海洋科學(xué)研究的熱點(diǎn),近年來,該系統(tǒng)中的低溫?zé)嵋簭浬⒘魇艿皆絹碓蕉嗟年P(guān)注。通過對(duì)低溫彌散流區(qū)域微生物學(xué)的研究,我們逐步了解低溫彌散流區(qū)域的微生物生態(tài)學(xué)特征及化能合成自養(yǎng)微生物,尤其是鐵氧化和硫氧化相關(guān)的化能自養(yǎng)微生物在低溫?zé)嵋簠^(qū)域的分布規(guī)律,充分認(rèn)識(shí)到這些自養(yǎng)微生物在熱液生態(tài)系統(tǒng)中的支柱作用,并肯定了地球化學(xué)因素對(duì)微生物生態(tài)分布的制約。對(duì)低溫?zé)嵋毫黧w中的微生物研究,也為我們得以窺探深部生物圈,進(jìn)一步揭示地殼深部微生物的新陳代謝機(jī)理,從而了解其生命演化與發(fā)展奠定了基礎(chǔ)。
然而,目前國內(nèi)外在這方面所開展的研究工作還有一定的局限性,包括樣品的采集、原位地球化學(xué)參數(shù)的分析以及生物學(xué)手段自身的缺陷,都會(huì)對(duì)當(dāng)前的研究結(jié)果造成影響。其局限性主要表現(xiàn)為:首先,由于DNA在常溫條件下容易降解,這就為樣品的保存和及時(shí)分析提出了嚴(yán)格的要求。但受到船載實(shí)驗(yàn)設(shè)備的限制,樣品在船上不能立即展開分析,只能采取室內(nèi)分析,而且從采集、存儲(chǔ)、運(yùn)輸和室內(nèi)分析這一過程往往需要花費(fèi)較長(zhǎng)的時(shí)間,這就在一定程度上導(dǎo)致了樣品中微生物量的失真和群落結(jié)構(gòu)的細(xì)微變化。其次,原位流體化學(xué)數(shù)據(jù)缺失嚴(yán)重。原位流體化學(xué)數(shù)據(jù)能夠有效反映原位沉積環(huán)境的信息,但是目前的采樣手段主要是電視抓斗和海底拖網(wǎng),這些采樣設(shè)備在起樣的過程中會(huì)導(dǎo)致背景海水與原位流體大量的混合,從而造成原位流體數(shù)據(jù)失真。因此,這就需要科學(xué)與技術(shù)的完美結(jié)合,進(jìn)一步完善海底熱液研究的技術(shù)手段,如我國正大力發(fā)展的載人深潛器和海底觀測(cè)網(wǎng)的建設(shè)。這些技術(shù)手段的實(shí)現(xiàn)將對(duì)海底低溫?zé)嵋簣?chǎng)原位數(shù)據(jù)的準(zhǔn)確測(cè)量和連續(xù)觀測(cè)提供有力的保障。另外,基因芯片的應(yīng)用可以全面而翔實(shí)地獲取原位環(huán)境中微生物新陳代謝途徑的信息,而針對(duì)低溫?zé)嵋海壳笆澜缟线€未展開類似的工作。這些新的采樣、測(cè)量和分析技術(shù)的運(yùn)用,將進(jìn)一步揭示低溫?zé)嵋簠^(qū)微生物與地球化學(xué)的相互耦合、生物礦化機(jī)制、微生物對(duì)洋殼的改造、深部生物圈的演化以及生命起源等重大科學(xué)問題的答案。
(References):
[1]HESSLER R R,KAHARL V A.The deep-sea hydrothermal vent community:an overview[M]∥HUMPHRIS S E,ZIERENBERG R A,MULLINEAUX L S,et al.Seafloor hydrothermal systems:physical,chemical,biological and geological interactions.Washington D C:American Geophysical Union,1995:72-84.
[2]VON DAMM K L.Temporal and compositional diversity in seafloor hydrothermal fluids[J].Reviews of Geophysics,1995,33(Suppl.1):1297-1306.
[3]LOWELL R P,RONA P A,VON HERZED R P.Seafloor hydrothermal systems[J].J.Geophys.Res.,1995,100(B1):327-352.
[4]KOSCHINSKY A,SEIFERT R,HALBACH P,et al.Geochemistry of diffuse low-temperature hydrothermal fluids in the North Fiji basin[J].Geochim.Cosmochim.Acta,2002,66(8):1409-1427.
[5]JOHNSON K S,CHILDRESS J J,HESSLER R R,et al.Chemical and biological interactions in the Rose Garden hydrothermal vent field,Galapagos spreading center[J].Deep-Sea Res.,1988,35(10-11):1723-1744.
[6]ELDERFIELD H,SCHULTZ A.Mid-ocean ridge hydrothermal fluxes and the chemical composition of the ocean[J].Ann.Rev.Earth Planet.Sci.,1996,24:191-224.
[7]SCHULTZ A,ELDERFIELD H.Controls on the physics and chemistry of seafloor hydrothermal circulation[M]∥CANN J R,ELDERFIELD H,LANGHTON A.Mid-ocean ridges:dynamics of processes associated with creation of new ocean crust.Cambridge:Cambridge University Press,1999:171-209.
[8]DE VILLIERS S,NELSON B K.Detection of low-temperature hydrothermal fluxes by seawater Mg and Ca anomalies[J].Science,1999,285(5248):721-723.
[9]RONA P A,TRIVETT D A.Discrete and diffuse heat transfer at ASHES vent field,Axial Volcano,Juan de Fuca Ridge[J].Earth Planet.Sci.Lett.,1992,109(1-2):57-71.
[10]ELDERFIELD H,MILLS R A,RUDNICKI M D.Geochemical and thermal fluxes,high-temperature venting and diffuse flow from mid-ocean ridge hydrothermal systems:the TAG hydrothermal field,mid-Atlantic ridge 26degrees N [J].Geol.Soc.London,Spec.Pub.,1993,76:295-307.
[11]BUTTERFIELD D A,MASSOTH G J.Geochemistry of north cleft segment vent fluids:temporal changes in chlorinity and their possible relation to recent volcanism [J].J.Geophys.Res.,1994,99(B3):4951-4968.
[12]BUTTERFIELD D A,JONASSON I R,MASSOTH G J,et al.Seafloor eruptions and evolution of hydrothermal fluid chemistry[M]∥CANN J R,ELDERFIELD H,LAUGHEON A.Mid-ocean ridges:dynamics of processes associated with creation of new ocean crust.Cambridge:Cambridge University Press,1999.
[13]HOLDEN J F,SUMMIT M,BAROSS J A.Thermophilic and hyperthermophilic microorganisms in 3-30℃hydrothermal fluids following a deep-sea volcanic eruption[J].FEMS Microbiol.Ecol.,1998,25(1):33-41.
[14]COOPER M J,ELDERFIELD H,SCHULTZ A.Diffuse hydrothermal fluids from Lucky Strike hydrothermal field:evidence for a shallow conductively heated system [J].J.Geophys.Res.,2000,105(B8):19369-19375.
[15]HUBER J A,BUTTERFIELD D A,BAROSS J A.Bacterial diversity in a subseafloor habitat following a deep-sea volcanic eruption[J].FEMS Microbiol.Ecol.,2003,43(3):393-409.
[16]BUTTERFIELD D A,ROE K K,LILLEY M D,et al.Mixing,reaction,and microbial activity in the subseafloor revealed by temporal and spatial variation in diffuse flow vents at Axial Volcano[M]∥WILCOCK W S D,DELONG E F,KELLEY D S,et al.The subseafloor biosphere at mid-ocean ridges.Washington D C:American Geophysical Union,2004,144:269-289.
[17]LILLEY M D.VON DAMM K L.Diffuse flow hydrothermal fluids from 9°50′N,East Pacific Rise:origin,evolution and biogeochemical controls[M]∥WILCOCK W S D,DELONG E F,KELLEY D S,et al.The Subseafloor Biosphere at mid-ocean ridges,Washington D C:American Geophysical Union,2004,144.
[18]RAVIZZA G,BLUSZTAJN J,VON DAMM K L,et al.Sr isotope variations in vent fluids from 9°46′-9°54′N East Pacific Rise;evidence of a non-zero-Mg fluid component[J].Geochimica et Cosmochimica Acta,2001,65(5):729-739.
[19]PROSKUROWSKI G,LILLEY M D,OLSON E J.Stable isotopic evidence in support of active microbial methane cycling in low-temperature diffuse flow vents at 9°50′N East Pacific Rise[J].Geochimica et Cosmochimica Acta,2008,72(8):2005-2023.
[20]HALBACH P,KOSCHINSKY A,SEIFERT R,et al.Diffuse hydrothermal fluid activity,biological communities,and mineral formation in the North Fiji Basin(SW Pacific):preliminary results of the R/V sonne cruise SO-134[J].InterRidge News,1999,8:38-47.
[21]LILLEY M D,OLSON E J,LAUGHLIN E M.Methane,hydrogen and carbon dioxide in vent fluids from the 9°N hydrothermal system[J].Eos.Trans.,1991,72:481.
[22]HUBER J A,BUTTERFIELD D A,BAROSS J A.Diversity and distribution of subseafloor Thermococcales populations in diffuse hydrothermal vents at an active deep-sea volcano in the northeast Pacific Ocean[J].J.Geophys.Res.,2006,111,G04016,doi:10.1029/2005JG000097.
[23]DAVIS R E,STAKES D S,WHEAT C G,et al.Bacterial variability within an Iron-Silica-Manganese-rich hydrothermal mound located Off-axis at the cleft segment,Juan de Fuca Ridge[J].Geomicrobiology Journal,2009,26(8):570-580.
[24]PERNER M,SEIFERT R,WEBER S,et al.Microbial CO2fixation and sulfur cycling associated with low-temperature emissions at the Lilliput hydrothermal field,southern Mid-Atlantic Ridge(9°S)[J].Environ.Microbiol.,2007,9(5):1186-1201.
[25]EDMOND J M,MEASURES C,MCDUFF R E,et al.Ridge crest hydrothermal activity and the balances of the major and minor elements in the ocean:The Galapagos data[J].Earth Planet.Sci.Lett.,1979,46(1):1-18.
[26]SHANK T M,F(xiàn)ORNARI D J,VON DAMM K L,et al.Temporal and spatial patterns of biological community development at nascent deep-sea hydrothermal vents(9°50′N,East Pacific Rise)[J].Deep Sea Res.:Part I,1998,45(1-3):465-515.
[27]TOKI T,TSUNOGAI U,ISHIBASHI J,et al.Methane enrichment in low-temperature hydrothermal fluids from the Suiyo Seamount in the Izu-Bonin Arc of the western Pacific Ocean[J].J.Geophys.Res.,2008,113,B08S13,doi:10.1029/2007JB005476.
[28]VON DAMM K L,OOSTING S E,KOZLOWSKI R,et al.Evolution of East Pacific Rise hydrothermal vent fluids following a volcanic eruption[J].Nature,1995,375:47-50.
[29]PERNER M,PETERSEN J M,ZIELINSKI F,et al.Geochemical constraints on the diversity and activity of H2-oxidizing microorganisms in diffuse hydrothermal fluids from a basalt-and an ultramafic-h(huán)osted vent[J].FEMS Microbiology Ecology,2010,74(1):55-71.
[30]AMANN R I,LUDWIG W,SCHLEIFER K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiol.Rev.,1995,59:143-169.
[31]HUBER J A,BUTTERFIELD D A,BAROSS J A.Temporal changes in Archaeal diversity and chemistry in a mid-ocean ridge subseafloor habitat[J].Appl.Environ.Microbiol.,2002,68(4):1585-1594.
[32]TESKE A,HINRICHS K-U,EDGCOMB V,et al.Microbial diversity of hydrothermal sediments in the Guaymas Basin:evidence for anaerobic methanotrophic communities[J].Appl.Environ.Microbiol.,2002,68(4):1994-2007.
[33]PERNER M,BACH W,HENTSCHER M,et al.Short-term microbial and physico-chemical variability in low temperature hydrothermal fluids near 5Son the Mid-Atlantic Ridge[J].Environ.Microbiol.,2009,11(10):2526-2541.
[34]KATO S,KOBAYASHI C,KAKEGAWA T,et al.Microbial communities in iron-silica-rich microbial mats at deep-sea hydrothermal fields of the southern Mariana Trough[J].Environ.Microbiol.,2009a,11(8):2094-2111.
[35]RASSA A C,MCALLISTER S M,SAFRAN S A,et al.Zeta-Proteobacteria dominates the colonization and formation of microbial mats in low-temperature hydrothermal vents at Loihi Seamount,Hawaii[J].Geomicrobiology Journal,2009,26(8):623-638.
[36]LPEZ-GARCíA P,DUPERRON S,PHILIPPOT P,et al.Bacterial diversity in hydrothermal sediment and epsilonproteobacterial dominance in experimental microcolonizers at the Mid-Atlantic Ridge[J].Environ.Microbiol.,2003,5(10):961-976.
[37]ALAIN K,OLAGNON M,DESBRUYERES D,et al.Phylogenetic characterization of the bacterial assemblage associated with mucous secretions of the hydrothermal vent polychaete Paralvinella palmiformis[J].FEMS Microbiol.Ecol.,2002,42(3):463-476.
[38]GOFFREDI S K,WAREN A,ORPHAN V J,et al.Novel forms of structural integration between microbes and a hydrothermal vent gastropod from the Indian Ocean[J].Appl.Environ.Microbiol.,2004,70(5):3082-3090.
[39]PAGE A,JUNIPER S K,OLAGNON M,et al.Microbial diversity associated with a Paralvinella sulfincola tube and the adjacent sub-stratum on an active deep-sea vent chimney[J].Geobiol.,2004,2(4):225-238.
[40]PODGORSEK L,PETRI R,IMHOFF J.Cultured and genetic diversity,and activities of sulfur-oxidizing bacteria in low-temperature hydrothermal fluids of the North Fiji basin[J].Mar.Ecol.Prog.Ser,2004,266:65-76.
[41]FORGET N L,MURDOCK S A,JUNIPER S K.Bacterial diversity in Fe-rich hydrothermal sediments at two South Tonga Arc submarine volcanoes[J].Geobiology,2010,8(5):417-432.
[42]LEVIN L A,MICHENER,R H.Isotopic evidence for chemosynthesis-based nutrition of macrobenthos:the lightness of being at Pacific methane seeps[J].Limnology and Oceanography,2002,47(5):1336-1345.
[43]OPATKIEWICZ A D,BUTTERFIELD D A,BAROSS J A.Individual hydrothermal vents at Axial Seamount harbor distinct subseafloor microbial communities[J].FEMS Microbiology Ecology,2009,70(3):413-424.
[44]MOYER C L,DOBBS F C,KARL D M.Phylogenetic diversity of the bacterial community from a microbial mat at an active,hydrothermal vent system,Loihi Seamount,Hawaii[J].Applied and Environmental Microbiology,1995,61(4):1555-1562.
[45]CORRE E,REYSENBACH A-L,PRIEUR D.ε-proteobacterial diversity from a deep-sea hydrothermal vent on the Mid-Atlantic Ridge[J].FEMS Microbiol.Lett.,2001,205(2):329-335.
[46]REY SENBACH A-L,LONGNECKER K,KIRSHTEIN J.Novel Bacterial and Archaeal lineages from an in situ growth chamber deployed at a Mid-Atlantic Ridge hydrothermal vent[J].Appl.Environ.Microbiol.,2000,66(9):3798-3806.
[47]REYSENBACH A-L.SHOCK E L.Merging genomes with geochemistry in hydrothermal ecosystems[J].Science,2002,296(5570):1077-1082.
[48]LOVLEY D R.Dissimilatory Fe(III)and Mn(IV)reduction[J].Microbiol.Rev.,1991,55(2):259-287.
[49]GHIORSE W C.Biology of iron-and manganese-depositing bacteria[J].Ann.Rev.Microbiol.,1984,38:515-550.
[50]EMERSON D.Microbial oxidation of Fe(II)and Mn(II)at circumneutral pH [M]∥LOVELY D R.Environmental microbe-metal interactions.Washington D C:ASM Press,2000:31-52.
[51]SOBOLEV D,RODEN E E.Suboxic deposition of ferric iron by bacteria in opposing gradients of Fe(II)and oxygen at circumneutral pH[J].Appl.Environ.Microbiol.,2001,67(3):1328-1334.
[52]EMERSON D,MOYER C L.Neutrophilic Fe-oxidizing bacteria are abundant at the Loihi Seamount hydrothermal vents and play a major role in Fe oxide deposition[J].Applied and Environmental Microbiology,2002,68(6):3085-3093.
[53]EMERSON D,RENTZ J A,LILBURN T G,et al.A novel lineage of Proteobacteria involved in formation of marine Fe-oxidizing microbial mat communities[J].PLoS ONE,2007,2(8):e667,doi:10.1371/journal.pone.0000667.
[54]JUNIPER S K,F(xiàn)OUQUET Y.Filamentous iron-silica deposits from modern and ancient hydrothermal sites[J].Canadian Mineralogist 1988,26(3):859-869.
[55]KENNEDY C B,SCOTT S D,F(xiàn)ERRIS F G.Characterization of Bacteriogenic Iron Oxide Deposits from Axial Volcano,Juan de Fuca Ridge,Northeast Pacific Ocean[J].Geomicrobiology Journal,2003,20(3):199-214.
[56]LANGLEY S,IGRIC P,TAKAHASHI Y,et al.Preliminary characterization and biological reduction of putative biogenic iron oxides(BIOS)from the Tonga-Kermadec Arc,Southwest Pacific Ocean[J].Geobiology,2009,7(1):35-49.
[57]VIGNAIS PM,BILLOUD B.Occurrence,classification,and biological function of hydrogenases:an overview[J].Chem.Rev.,2007,107(10):4206-4272.
[58]L?FFLER F E,TIEDJE J M,SANFORD R A.Fraction of electrons consumed in electron acceptor reduction and hydrogen thresholds as indicators of halorespiratory physiology[J].Appl.Environ.Microbiol.,1999,65(9):4049-4056.
[59]HUBER H,STETTER K O.Desulfurococcales[M]∥ DWORKIN M,F(xiàn)ALKOW S,ROSENBERG E,et al.The Prokaryotes.New York:Springer,2006:52-68.
[60]THAUER R K,KASTER A-K,SEEDORF H,et al.Methanogenic archaea:ecologically relevant differences in energy conservation[J].Nat.Rev.Microbiol.,2008,6:579-591.
[61]NERCESSIAN O,BIENVENU N,MOREIRA D,et al.Diversity of functional genes of methanogens,methanotrophs and sulfate reducers in deep-sea hydrothermal environments[J].Environ.Microbiol.,2005,7(1):118-132.
[62]SUMMIT M,BAROSS J A.A novel microbial habitat in the mid-ocean ridge subseafloor[J].Proc.Natl.Acad.Sci.USA,2001,98(5):2158-2163.
[63]GOLD T.The deep,hot biosphere[J].Proc.Natl.Acad.Sci.USA,1992,89(13):6045-6049.
[64]ROUSSEL E G,CAMBON BONAVITA M-A,QUERELLOU J.Extending the sub-sea-floor biosphere [J].Science,2008,320(5879):1046.
[65]JANNASCH H W,MOTTL M J.Geomicrobiology of deep-sea hydrothermal vents[J].Science,1985,229(4715):717-725.
[66]LILlEY M D,BAROSS J A,GORDON L I.Reduced gases and bacteria in hydrothermal fluids:the galapagos spreading center and 21°N East Pacific Rise,in Hydrothermal Processes at Seafloor Spreading Centers[M].New York:Springer,1984:411-449.
[67]KATO S,YANAGAWA K,SUNAMURA M,et al.Abundance of Zetaproteobacteria within crustal fluids in back-arc hydrothermal fields of the Southern Mariana Trough[J].Environmental Microbiology,2009b,11(12):3210-3222.
A Review of Microbial Ecology in Low-Temperature Diffuse Flow Area of Modern Submarine Hydrothermal System
LI Ji-wei1,2,ZHOU Huai-yang3,PENG Xiao-tong3,CHEN Zhi-qiang2,SUN Zhi-lei2,LI Jiang-tao3,CHEN Shun3,ZHANG Li-xue3
(1.FacultyofGeoscienesandEnvironmentalEngineering,SouthwestJiaotongUniversity,Chengdu 610031,China;2.GuangzhouInstituteofGeochemistry,ChineseAcademyofSciences,Guangzhou 510640,China;3.StateKeyLaboratoryofMarineGeology,TongjiUniversity,Shanghai 200092,China)
The development of microbial ecology in the areas where low-temperature hydrothermal diffuse flow is dominant has presently become one of the hot scientific topics on the study of submarine hydrothermal system.Many surveys have shown that a large number of chemolithautotrophic microorganisms are present in the low-temperature hydrothermal diffuse flow areas and they obtain energy for metabolism from the redox of elements such as sulfur and Fe(II)supplied by hydrothermal fluids.Their distributions are closely related to the physicochemical conditions of low-temperature hydrothermal fluids.These discoveries have greatly enriched our knowledge of microbial ecology in the low-temperature hydrothermal diffuse flow areas and enhanced our understandings about the relationship between the key geochemical processes and the microbial metabolism in the submarine hydrothermal system.In addition,the low-temperature hydrothermal fluid may be a window for studying the biosphere in the deep oceanic crust,through which the metabolism approach of the life within the oceanic crust could be learned and the interaction mechanisms between the microorganisms and the fluids and rocks within the oceanic crust might be understood.
low-temperature hydrothermal diffuse flow;microbial ecology;chemolithautotrophic microorganism;deep biosphere
February 11,2011
P738
A
1671-6647(2012)02-0295-10
2011-02-11
西南交通大學(xué)青年教師百人計(jì)劃資助項(xiàng)目——表生環(huán)境下黑色頁巖風(fēng)化體系中的微生物作用的機(jī)理研究(SWJTU12BR010)
李季偉(1983-),男,四川綿陽人,講師,博士,主要從事地微生物學(xué)方面研究.E-mail:lijiwei@163.com

