純化標簽不同融合端的選擇對蝎毒肽色譜行為的影響
惠長野,邵建華,郭妍,張希,楊學琴,王佃鵬
蝎尾腺分泌的蝎毒具有極大的醫學價值,蝎毒的主要活性成分是一類由 28 ~ 76 個氨基酸殘基組成的小分子多肽。按其分子的大小,可分為長鏈和短鏈兩大類。蝎毒素雖然空間結構簡單,生理活性卻具有多樣性,因而一直是研究的熱點[1-2]。本實驗以東亞鉗蝎抗癲癇肽(anti-epilepsy peptide,AEP,GI:37999913)為模型,在實現 rAEP 原核可溶表達的基礎上,結合肽鏈構象預測 His tag 在重組肽不同末端融合時的空間屏蔽效應,并構建相應的表達載體進行驗證。為類似活性多肽的重組表達提供借鑒,以滿足這類具有藥用潛質的多肽的開發需求。
1 材料與方法
1.1 材料
1.1.1 表達載體及試劑 大腸桿菌 BL21(DE3)為本室保存;非融合表達質粒 pTrx 為沈陽藥科大學生化教研室構建[3];Pyrobest DNA 聚合酶、限制性內切酶 Nco I、EcoR I 及 T4 DNA 連接酶為日本 TaKaRa 公司產品;引物均由上海生工生物工程公司合成;LB 培養基成分購自英國 Oxoid 公司;金屬離子螯合柱 HisTrap FF為瑞典 Amersham 公司產品。
1.1.2 實驗動物 昆明種小白鼠(SPF 級),雄性,體重 20 ~ 25 g,購自沈陽藥科大學實驗動物中心,合格證號:遼實合字 033 號。實驗前,以顆粒狀基礎飼料飼喂 1 周以適應環境。
1.2 方法
1.2.1 AEP 生物信息學分析 Genbank 中搜索AEP 成熟肽同源序列并進行比對分析,根據 PDB庫中收錄的同源序列空間結構,用 WHAT-IF 軟件對 AEP 進行建模。
1.2.2 pTrx-His-AEP 及 pTrx-AEP-His 表達載體的構建 以東亞鉗蝎尾腺 cDNA 庫為模板,根據Genbank 中 AEP 成熟肽序列設計引物見表 1。上游引物 P1 中,下劃線為 Nco I 酶切位點,6 個組氨酸編碼序列加粗顯示,下游引物 P2 帶有 EcoR I位點及終止密碼子,PCR 產物經 Nco I 及 EcoR I雙酶切,插入經過同樣雙酶切的 pTrx 中構建成純化標簽 N端融合的表達載體 pTrx-His-AEP,編碼重組肽為 Met-Gly-His6-AEP,重組質粒轉錄翻譯區見圖 1。純化標簽 C 端融合的表達載體 pTrx-AEPHis 構建方法同上,下游引物 P4 中引入 6 個組氨酸的編碼序列,編碼重組肽為 AEP-His6。
1.2.3 rAEP 的表達、純化 攜帶有重組質粒的BL21(DE3)接種至含卡那霉素 40 μg/ml 的 LB液體培養基中,37 ℃ 培養至 OD600= 0.6,加入終濃度為 0.4 mmol/L 的 IPTG 誘導培養 4 h 后,離心收集菌體,超聲破碎后的上清液上樣至用起始緩沖液平衡好的 HisTrap FF 柱。非變性條件下純化選用降低 pH 結合 NH4Cl 競爭洗脫,同時考察8 mol/L 尿素變性條件下的洗脫情況。

表 1 AEP 擴增用引物Table 1 Primers used in this study

圖 1 重組質粒克隆/表達區Figure 1 pTrx-AEP cloning/expression region
1.2.4 rAEP 生物活性測定 采用硫代氨基脲致小鼠神經興奮模型[4]。取體重 20 ~ 25 g 雄性昆明種小鼠 40 只,隨機分為 4 組,按 2.0 mg/kg皮下注射 rAEP,以等容生理鹽水為陰性對照、4.0 mg/kg 苯巴比妥鈉為陽性對照,于給藥 20 min后,腹腔注射硫代氨基脲 11.0 mg/kg,記錄 120 min內試驗動物奔跑型轉至強直型驚厥發作潛伏時間,以相對陰性對照組的驚厥發作潛伏時間延長率為活性指標。
2 結果
2.1 AEP 序列分析及同源建模
AEP 與蝎毒素中昆蟲抑制性神經毒素的同源性最高(圖 2)。Cys3 與 Cys6、Cys4 與 Cys7、Cys1 與 Cys8、Cys2 與 Cys5 配對成 4 個二硫鍵,在此基礎上形成一個保守的結構域(knottin fold),該結構對這類肽的生物活性和熱穩定性都十分重要[5]。
AEP 建模的平面截圖見圖 3。AEP 空間結構與大部分長鏈蝎神經毒素相似,由一段 α 螺旋和三段反向平行的 β 片層構成一個緊密的疏水核心,而 C 端為無規則卷曲,肽鏈相對比較延伸。

圖 2 AEP 與抑制性昆蟲毒素的序列比對分析Figure 2 Amino acid sequence comparison of AEP and depressant insect toxins
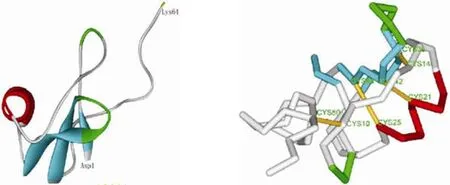
圖 3 AEP 的空間結構及二硫鍵配對(紅色:α 螺旋;藍色:β 片層;綠色:β 轉角;黃色:二硫鍵)Figure 3 Three-dimension structure and disulfide bonds of AEP (Red: helix; Blue: beta strand; Green: bend; Yellow: disulfide bond)
2.2 pTrx-His-AEP 及 pTrx-AEP-His 表達載體的構建
從空間結構可以看出,AEP 的 N 端依次為βαββ 形成了一個緊密結構(knottin fold),His tag融合于 N 端,容易被疏水核心所屏蔽。而 C 端肽鏈延伸出來,His tag 置于 C 端利于其與鎳離子結合。為此我們構建了 His tag 不同末端融合的表達載體,重組質粒經雙酶切后,在 250 bp 處出現目的條帶(圖 4A),測序分析顯示與預期相符。His tag體積小,并不影響 rAEP 的表達,不同末端融合的情況下,TrxA 和 rAEP 都得到高效可溶性表達,表達量相近(圖 4B)。
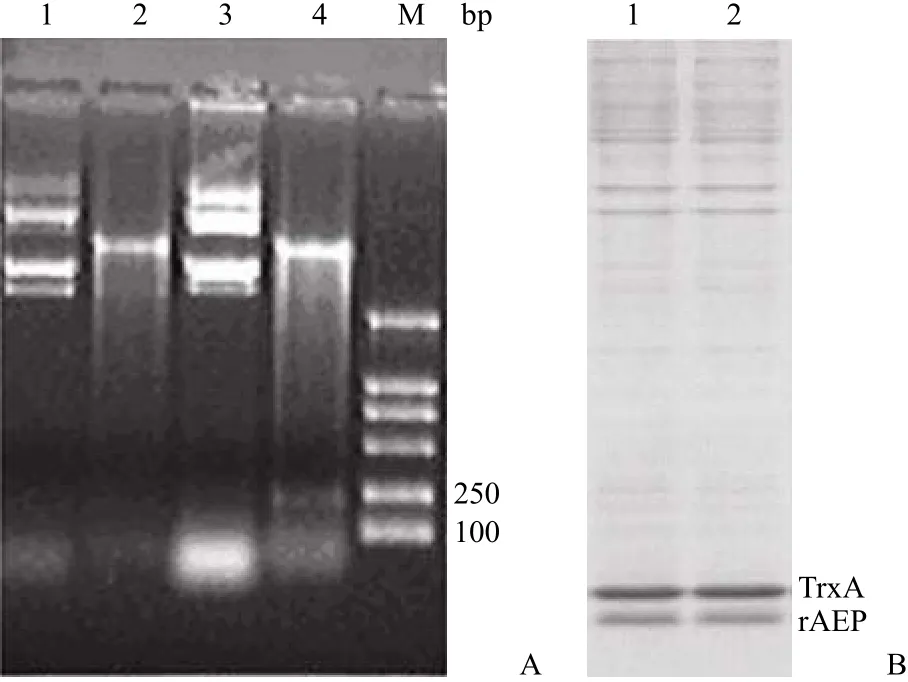
圖 4 重組質粒 pTrx-AEP 的構建Figure 4 Construction of recombinant plasmid pTrx-AEP
2.3 Met-Gly-His6-AEP 與 AEP-His6 純化結果對比
離心富集誘導后菌體,起始緩沖液(50 mmol/L Tris-HCl,pH 8.0)重懸,超聲破碎后,高速離心(17800 × g,30 min,4 ℃)取上清。上樣至起始緩沖液平衡好的 HisTrap FF,再平衡至基線穩定。改變 pH 洗脫,隨著 pH 的降低,His tag 與金屬離子螯合柱的結合能力降低,溶液洗脫能力增強。每次換用不同 pH 值溶液時,清洗至基線穩定,且流出液 pH 恒定。pH 6.0 ~ 7.0 采用 25 mmol/L PBS 作為緩沖體系,pH 4.0 ~ 5.0 采用 25 mmol/L NaAc-HAc 緩沖體系。變性條件下的洗脫,為在各溶液體系中引入 8 mol/L 尿素。
2.3.1 Met-Gly-His6-AEP 純化結果 非變性條件下,各 pH 值緩沖液洗脫組分電泳分析結果見圖 5A。降低 pH 減弱 rAEP 與 HisTrap FF 的結合力,rAEP 電泳條帶在 6.5 kD 附近,少有菌體蛋白干擾。可見 rAEP 在各洗脫峰中都存在,很難得到電泳純樣品。隨后洗脫液中引入了強變性劑8 mol/L 尿素,高濃度尿素的加入不破壞二硫鍵,但可以解除次級鍵對肽鏈構象的約束,使肽鏈得到充分延伸,利于 His tag 的暴露。實驗結果(圖 5B)也證實了這點,rAEP 與填料結合力增強,含有0.4 mol/L NH4Cl 的 pH 4.0 緩沖液洗脫峰達到了電泳純,但清洗除雜步驟還是伴隨有 rAEP 的損失,最終每升發酵液經純化后獲得純度大于 95%樣品約為 0.8 mg。
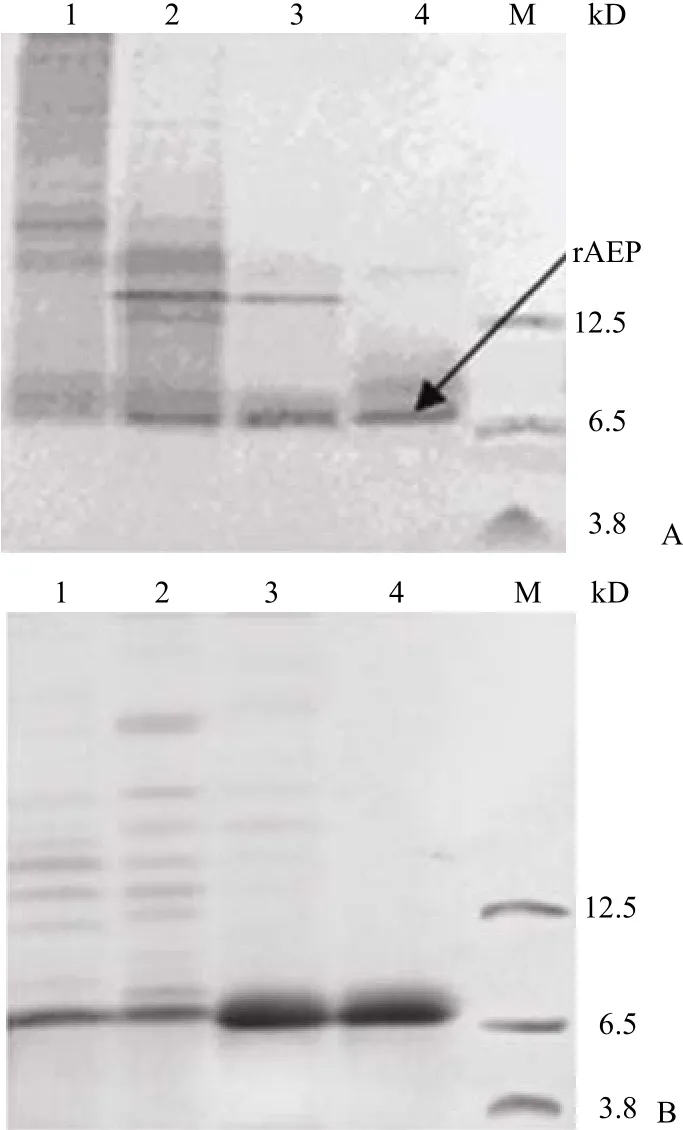
圖 5 Met-Gly-His6-AEP 純化過程中收集組份的 17.5%Tris-Tricine SDS-PAGE 分析Figure 5 17.5% Tris-Tricine SDS-PAGE for purification of Met-Gly-His6-AEP
2.3.2 AEP-His6純化結果 根據空間結構推測His tag C 端融合有利于其更好地暴露,實驗結果很好地證明了這點,非變性條件下圖 6A,rAEP 在pH 降為 4.0 時都沒被洗脫,隨后加入 0.2 mol/L NH4Cl 才被洗脫,但純度不高。圖 6B 為 8 mol/L尿素存在下的洗脫結果,變性條件下 His tag 暴露更加充分,利于用更苛刻的條件除雜質,0.4 mol/L NH4Cl 洗脫峰達到了電泳純。更重要的是洗滌步驟幾乎沒有 rAEP 的損失,每升發酵液經純化后獲得純度大于 95% 樣品量提高為 3.3 mg。
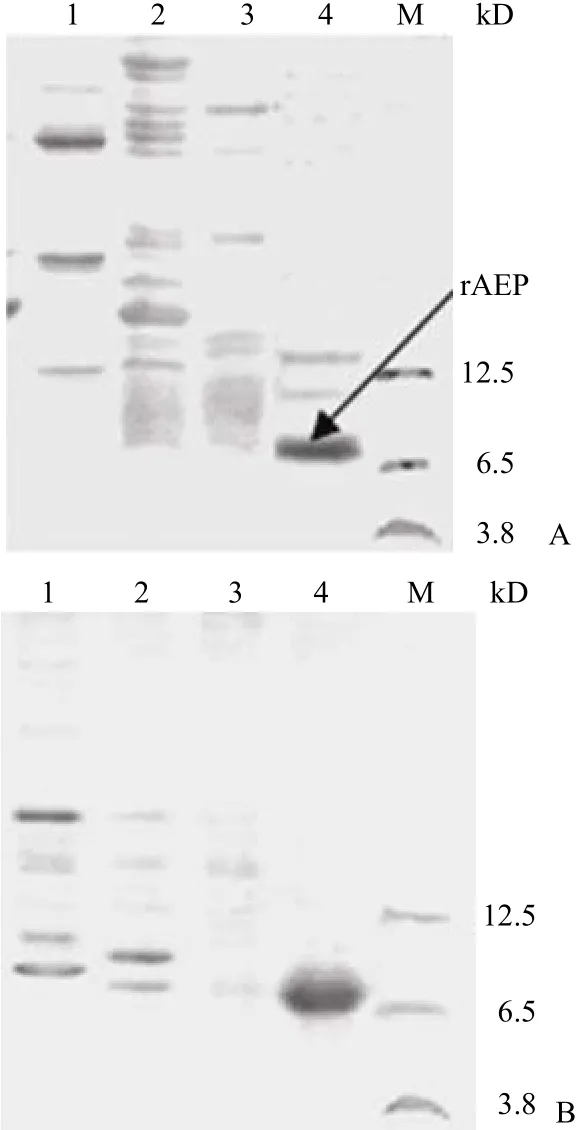
圖 6 AEP-His6 純化過程中收集組份的 17.5% Tris-Tricine SDS-PAGE 分析Figure 6 17.5% Tris-Tricine SDS-PAGE for purification of AEP-His6
2.4 Met-Gly-His6-AEP 與 AEP-His6 抗小鼠神經興奮活性
在硫代氨基脲致小鼠神經興奮模型中,兩者均表現出抗神經興奮作用(圖 7)。AEP-His6使小鼠驚厥大發作潛伏時間延長 47.7%,顯著高于 Met-Gly-His6-AEP 組(26.6%)及陽性對照藥苯巴比妥鈉組(28.4%)。推測與肽鏈 C 端延伸出 knottin fold 結構域,His tag 對活性中心構象影響小有關。
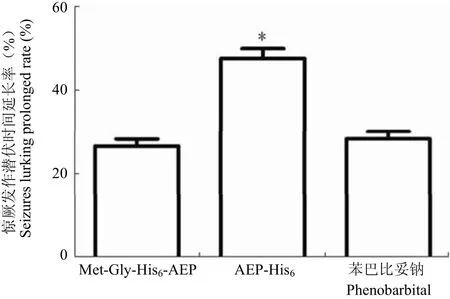
圖 7 rAEP 抗小鼠神經興奮活性[結果以驚厥發作潛伏時間延長率±s 表示,AEP-His6 組延長率顯著高于 Met-Gly-His6-AEP 及苯巴比妥鈉組(*P < 0.01)]Figure 7 Anti-neuroexcitatory activity of rAEP in mouse model. [The error bars represent the standard deviation of the mean, *P < 0.01 by unpaired t test, significantly different from phenobarbital group. There was no statistically significant difference between Met-Gly-His6-AEP and phenobarbital groups (P > 0.05)]
3 討論
AEP 與蝎昆蟲抑制性神經毒素高度同源,它們都作用于 Na+通道,是 Na+通道抑制劑。這類長鏈蝎毒素大多由一個螺旋(極少數是兩個螺旋)、兩段或三段反向平行的 β 折疊組成一個緊密的結構核心,二硫鍵對核心結構起著加固作用,親水殘基的側鏈暴露在溶液中,是分子具有不同特異性的結構基礎[5-6]。
在過量共表達硫氧還蛋白 TrxA 的情況下,營造胞質內氧化態勢利于二硫鍵的形成,AEP 這類富含二硫鍵的活性肽得到了可溶性表達[3,7]。蝎毒肽具有分子量小、結構簡單及生物活性強的特點,這些毒素分子正在成為新藥開發及設計的模板。肽鏈末端極短肽段的去除對生物活性影響都很顯著,額外加入的肽段對空間結構及活性中心結構域的形成影響顯著[8]。重組表達時不宜選擇過大的融合標簽,His tag 被廣泛用作小分子活性肽的親合標簽。結合分子構象,考慮 His tag 融合端的選擇對后序純化及生物活性的影響,對各類小分子活性肽的重組表達都具有借鑒意義。
[1] Rodríguez de la Vega RC, SchwartzZ EF, Possani LD. Mining on scorpion venom biodiversity. Toxicon, 2010, 56(7):1155-1161.
[2] Chippaux JP. Emerging options for the management of scorpion stings.Drug Des Devel Ther, 2012, 6:165-173.
[3] Shao JH, Hui CY, Cai QF, et al. The purification, gene clone and functional expression of scorpion anti-nociception peptide SAPIII.“Yiling Medicine Cup” 8th Nationol Youth Pharmacy Workers Academic Conference, 2006: 202-206. (in Chinese)
邵建華, 惠長野, 蔡啟峰, 等. 東亞鉗蝎鎮痛活性肽SAPIII的分離純化、基因克隆與功能表達//“以嶺醫藥杯”第八屆全國青年藥學工作者最新科研成果交流會論文集, 2006:202-206.
[4] Zhang JH, Hua ZC, Xu Z, et al. Expression of anti-neuroexcitation peptide (ANEP) of scorpion Buthus martensii Karsch in Escherichia coli. Prep Biochem Biotechnol, 2001, 31(1):49-57.
[5] Zhu J, Wang J, Cheng MS, et al. Dinucleotides docking to scorpion polypeptide toxins: a molecular modeling method for protein functional site recognition. Biochem Biophys Res Commun, 2009,378(2):157-161.
[6] Jung S, Dingley AJ, Augustin R, et al. Hydramacin-1, structure and antibacterial activity of a protein from the basal metazoan Hydra.J Biol Chem, 2009, 284(3):1896-1905.
[7] Stewart EJ, Aslund F, Beckwith J. Disulfide bond formation in the Escherichia coli cytoplasm: an in vivo role reversal for the thioredoxins. EMBO J, 1998, 17(19):5543-5550.
[8] Possani LD, Becerril B, Delepierre M, et al. Scorpion toxins specific for Na+-channels. Eur J Biochem, 1999, 264(2):287-300.

