RRM1蛋白表達與含吉西他濱方案一線治療晚期非小細胞肺癌療效關系的研究
梁劍苗 鄧燕明* 馮衛能 胡維維 陳澤程 唐溢聰 張 華 冼海兵 張順達
(1 廣東省佛山市第一人民醫院頭頸胸腫瘤內科,廣東 佛山 528000;2 廣東省佛山市第一人民醫院病理科,廣東 佛山 528000)
肺癌是目前最常見的惡性腫瘤之一,非小細胞肺癌(NSCLC)是肺癌的主要病理類型[1],吉西他濱聯合鉑類是晚期NSCLC一線治療的主要化療藥物之一,核苷酸還原酶1(RRM1)是吉西他濱的主要靶點之一。本研究回顧性分析44例使用含吉西他濱方案一線化療的晚期非小細胞肺癌的RRM1表達,探討RRM1表達與吉西他濱療效的相關性。
1 材料與方法
1.1 研究對象
收集我院2008年1月至2010年8月一線治療的晚期非小細胞肺癌患者,入組病例符合以下條件:①經組織學或細胞學確診為非小細胞肺癌;②PS評分0~1分;③至少有一個可測量病灶;④使用含吉西他濱方案化療;⑤至少化療2周期。
1.2 治療方案
吉西他濱(美國禮來公司,健擇)1000mg/m2,靜脈滴注,第1天;或聯合順鉑75mg/m2,靜脈滴注,第1天,或聯合卡鉑AUC=5,靜脈滴注,第1天。21d為1周期。
1.3 療效評價
每化療2周期進行療效評價,按照實體瘤療效評價標準(RECIST1.1版),分為完全緩解(CR)、部分緩解(PR)、穩定(SD)和進展(PD),客觀有效率(RR)為CR+PR,疾病控制率(DCR)為CR+PR+SD。無疾病進展時間(PFS)為治療開始至腫瘤復發或進展的時間;總生存時間(OS)為治療開始至死亡或末次隨訪的時間。末次隨訪時間為2011年12月。
1.4 RRM1表達的檢測
免疫組織化學采用Envision二步法,檢測系統試劑盒和RRM1抗體均購自Dako公司,RRM1蛋白表達陽性為細胞漿或(和)細胞核出現棕黃色顆粒為陽性。
1.5 統計學分析
所有資料采用SPSS17.0進行統計學分析,療效分析采用χ2檢驗,生存分析采用Kaplan-Meier法,P<0.05為有統計學意義。
2 結 果
2.1 臨床資料
共收集44例肺癌患者資料,其中Ⅲb期6例(13.6%),Ⅳ期38例(86.4%);男性23例(52.3%),女性21例(47.7%);中位年齡(57.5±11.5)歲(30~76歲);腺癌32例(72.7%),鱗癌12例(27.3%);使用吉西他濱聯合順鉑方案25例(56.8%),吉西他濱聯合卡鉑方案15例(34.1%),單藥吉西他濱4例(9.1%);中位周期數(4±1.14)周期(2~6周期)。
2.2 RRM1免疫組化結果
44例患者中,RRM1陽性(+)40.9.8%(18/44),RRM1陰性(-)59.1%(26/44)。
2.3 療效
該研究的44例患者中,PR 17例(38.6%),SD 16例(36.4%),PD 11例(25.0%);客觀有效率(RR)38.6%(17/44),疾病控制率(DCR)75.0%(33/44);中位無疾病進展時間(PFS)6.8個月(5.9~7.7個月),中位生存時間(OS)15.4個月(12.4~18.4個月)。
2.4 相關性分析
該研究中,RRM1陽性患者RR為27.8%(5/18),RRM1陰性患者RR為46.2%(12/26),差異無統計學意義(P=0.218);RRM1陽性患者DCR為55.6%(10/18),RRM1陰性患者RR為88.5%(23/26),差異有統計學意義(P=0.013);RRM1陽性患者PFS為5.5個月,RRM1陰性患者PFS為7.2個月,差異有統計學意義(P=0.01);RRM1陽性患者OS為15.3個月,RRM1陰性患者OS為18.8個月,差異無統計學意義(P=0.127)。見圖1。
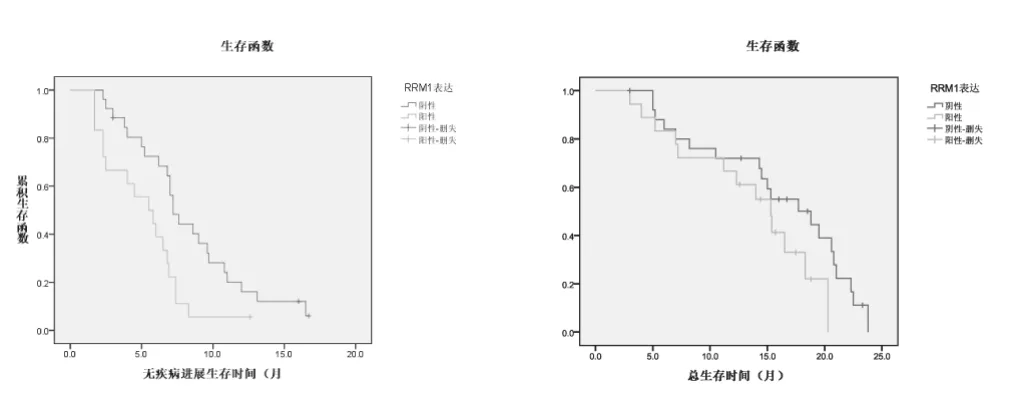
圖1 RRM1表達對PFS和OS的影響
3 討 論
吉西他濱是嘧啶類抗代謝藥物,為核苷酸還原酶(RR)抑制劑,在細胞內經過核苷激酶的作用轉化成具有活性的二磷酸核苷(dFdCDP)及三磷酸核苷(dFdCTP),從而抑制DNA合成[2,3]。核苷酸還原酶(ribonucleotide reductase,RR)是DNA合成通路中的限速酶,RRM1是RR的亞單位,是核苷酸結合位點,控制底物的特異性和整個酶的活性,同時也是吉西他濱的結合位點[4]。
多項研究顯示RRM1表達可能可預測吉西他濱化療的療效。Bergman等[5]2005年建立的第一個體內吉西他濱耐藥模型顯示吉西他濱耐藥細胞株的RRM1 mRNA水平明顯升高。Rosell等[6]采用實時PCR檢測100例晚期NSCLC患者病理標本RRM1的mRNA水平,發現RRM1低表達患者使用吉西他濱聯合順鉑方案緩解率較高,中位生存期較高表達患者明顯延長(P=0.009)。Lee JJ等[7]使用免疫組化方法檢測使用吉西他濱為基礎的方案化療的晚期非小細胞肺癌患者的RRM1表達水平,研究顯示RRM1陽性患者的總生存期較陰性患者縮短(P=0.022),疾病控制率也低于陰性組(P=0.053)。高志強等[8]使用免疫組化方法檢測吉西他濱聯合順鉑化療的晚期肺癌患者RRM1蛋白表達,研究顯示RRM1蛋白高表達組的化療有效率低于低表達組(P=0.005);RRM1高表達組的1年生存率低于低表達組(P=0.009);RRM1蛋白高表達組的疾病進展時間低于低表達組(P=0.042);但兩組的中位生存期無明顯差異(P=0.245)。由于RT-PCR在mRNA水平檢測RRM1表達,而免疫組化在蛋白水平檢測RRM1表達,因此mRNA與蛋白表達之間可能存在一些差異。Gong W等[9]對18項臨床研究進行Meta分析,亞組分析顯示免疫組化似乎乎比RT-PCR技術更好地預測晚期非小細胞肺癌患者使用含吉西他濱化療的客觀反應率。本研究也采用免疫組化方法檢測RRM1蛋白表達,顯示RRM1陰性患者疾病控制率高于陽性患者,無疾病進展時間延長,但有效率及總生存時間無統計學差異。
綜上所述,RRM1表達水平是吉西他濱治療非小細胞肺癌的敏感性的重要因素,然而仍需要大型的Ⅲ期隨機臨床試驗明確RRM1是否能作為晚期非小細胞肺癌吉西他濱方案敏感性及預后的預測指標。另外,使用何種檢測手段更能預測臨床療效,如何判斷RRM1表達水平高低等問題仍需進一步研究證實。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2]Rosell R,Cobo M,Isla D,et al.Pharmacogenomics and gemcitabine[J].Ann Oncol,2006,17(5):13-16.
[3]Ueno H,Kiyosawa K,Kaniwa N.Pharmacogenomics of gemcitabine:can genetic studies lead to tailor-made therapy?[J].Br J Cancer,2007,97(2):145-151.
[4]Smith BD,Karp JE.Ribonucleotide reductase: an old target with new potential[J].Leukemia Res,2003,27(12):1075-1076.
[5]Bergman AM,Eijk PP,Ruiz van Haperen VW,et al.In vivo induction of resistance to gemcitabine results in increased expression of ribonucleotide reductase subunit M1 as a major determinant[J].Cancer Res,2005,65(20):9510-9516.
[6]Rosell R,Danenberg KD,Alberola V,et al.Ribonucleotide reductase messenger RNA expression and survival in Gemcitabine /Cisp latintreated advanced non-small-cell lung cancer patients[J].Cli Cancer Res,2004,10(4):1318-1325.
[7]Lee JJ,Maeng CH,Baek SK,et al.The immunohistochemical overexpression of ribonucleotide reductase regulatory subunit M1(RRM1) protein is a predictor of shorter survival to gemcitabinebased chemotherapy in advanced non-small cell lung cancer(NSCLC)[J].Lung Cancer,2010,70(2):205-210.
[8]Gao Z,Han B,Shen J,et al.Relations between RRM1 protein expression levels and effects of gemcitabine and cisplatin chemotherapy in advanced non-small cell lung cancer patients[J].Chin J Lung Cancer,2011,14(4):340-344.
[9]Gong W,Zhang X,Wu J,et al.RRM1 expression and clinical outcome of gemcitabine-containing chemotherapy for advanced non-small-cell lung cancer: A meta-analysis[J].Lung Cancer,2012,75(3):374-380.

