不同方法建立的人大細胞肺癌裸鼠移植瘤模型的生物學特點
人肺癌裸鼠移植瘤模型是抗腫瘤藥研究的常用模型,更是抗血管生成類抗腫瘤藥的首選模型。保持腫瘤生物學特性的穩(wěn)定,盡可能地模擬癌癥患者臨床生理特征是評價一個裸鼠異種移植瘤模型成功和優(yōu)劣的關鍵[1]。目前國內(nèi)外已建立了多個傳代穩(wěn)定的肺癌裸鼠皮下移植瘤模型,應用于小細胞肺癌、肺腺癌等的研究[2]。但建立人大細胞肺癌移植瘤模型的詳細報道甚少,對該移植瘤模型的生物學特征的研究更是空白。NCI-H460細胞來自男性大細胞肺癌患者的胸腔積液,為美國典型培養(yǎng)物保藏中心(ATCC)收藏的人大細胞肺癌細胞株。本文參考三種常用的皮下移植瘤造模方法分別建立了人大細胞肺癌 NCI-H460裸鼠移植瘤模型,并比較了三種方法建立的腫瘤模型的生長規(guī)律和生物學特性,其中對移植瘤裸鼠免疫功能的研究尚屬首次。
1 材料和方法
1.1 實驗動物與瘤株
BALB/c-nu/nu裸鼠,SPF級,3~4周,雌性。購于上海必凱實驗動物有限公司[生產(chǎn)許可證:SCXK(滬)2008—0016]。飼養(yǎng)及無菌實驗操作均在浙江中醫(yī)藥大學動物實驗研究中心屏障系統(tǒng)內(nèi)進行[實驗室許可證:SYXK(浙)2008—0115]。人大細胞肺癌NCI-H 460細胞、人白血病 K562細胞:購于中科院上海細胞所。
1.2 主要儀器與試劑
Nikon eclipse 80i顯微鏡,Nikon公司;Forma 3111型細胞培養(yǎng)箱,Thermo公司;SW-CJ-2F超凈工作臺,蘇州凈化;BIO-RAD 680酶標儀;Axiovert 200熒光倒置顯微鏡,ZEISS;全自動生化分析儀,日本日立;丙氨酸氨基轉(zhuǎn)氨酶(ALT)、天冬氨酸氨基轉(zhuǎn)移酶(AST)、血糖(G1u)、尿素氮(BUN)、肌酐(CREA)試劑盒,由上海申能德賽技術診斷有限公司提供。
1.3 模型制備
1.3.1 細胞培養(yǎng)移植法造模[3]:取對數(shù)生長期NCI-H 460細胞消化后,調(diào)整至5×107/mL,每鼠頸背皮下接種0.2m L。細胞懸液放置于冰上,接種過程必須在細胞懸液制備后1h內(nèi)完成。
1.3.2 組織塊移植法造模[4]:取培養(yǎng)細胞初代移植瘤生長至1cm3的荷瘤裸鼠4只,采用脊髓離斷法處死動物,無菌剝離瘤體,除去包膜,用0.9%生理鹽水洗滌2次,取周圍魚肉樣新鮮組織剪成(0.5×0.5×0.5)mm大小瘤塊,用套管針接種于裸鼠頸背部皮下。接種標本在離體后5min之內(nèi)完成。
1.3.3 勻漿液移植法造模[5]:取培養(yǎng)細胞初代移植瘤生長至1cm3的荷瘤裸鼠4只,采用脊髓離斷法處死動物,無菌剝離瘤體,除去包膜,剪碎,加入生理鹽水,以200目銅網(wǎng)過濾,制備成單細胞懸液,臺盼藍拒染計數(shù)活細胞后調(diào)整細胞濃度至5×107/m L,接種于裸鼠頸背部皮下,每只接種0.2m L。
1.4 一般生物學特征觀察
1.4.1 移植瘤生長曲線:自接種日起每周測量1次腫瘤長徑(b)和短徑(a),按公式V=1/2×a×b2計算腫瘤體積,待腫瘤生長至100mm3后每3天測量1次,共觀察5周,繪制生長曲線圖,根據(jù)生長曲線計算各種方法的成瘤率、成瘤潛伏時間、腫瘤體積倍增時間。
1.4.2 組織形態(tài)觀察;于2周和5周后分別取荷瘤裸鼠,處死,剝離腫瘤組織,中性甲醛固定,石蠟包埋切片,HE染色,光鏡下觀察腫瘤組織形態(tài)。
1.5 外周血生化和白細胞分類檢測
3種方法建立的人大細胞肺癌裸鼠移植瘤模型作為3個實驗組,分別簡稱為勻漿液組、細胞培養(yǎng)組和埋塊組。另取10只正常 BALB/c-nu/nu裸鼠作為對照組。于造模后2周、4周和5周分別經(jīng)眼叢靜脈取血,全自動生化分析儀檢測其丙氨酸氨基轉(zhuǎn)氨酶(ALT)、天冬氨酸氨基轉(zhuǎn)移酶(AST)、血糖(G1u)、尿素氮(BUN)和肌酐(CREA)等生化指標;實驗結(jié)束取血,EDTA二鈉抗凝,血球分析儀檢測白細胞總數(shù)(WBC)并進行分類(NEUT%、LY%、MO%、HGB、PLT等)。
1.6 免疫功能檢測
于造模后2周和5周分別取荷瘤裸鼠和正常BALB/c-nu/nu裸鼠各5只,檢測其非特異性免疫功能。
1.6.1 腹腔巨噬細胞吞噬活性[6]:裸鼠腹腔內(nèi)注射5%雞紅細胞懸液0.5m L,30m in后頸椎脫臼處死,仰臥固定。常規(guī)消毒腹部皮膚,腹腔注入2m L生理鹽水,輕揉腹部1min。吸取腹腔液1m L,分滴于2張清潔載玻片上,將玻片置于濕盒內(nèi)蓋好,于37℃培養(yǎng)箱30min,其間輕晃動玻片2次。取出后在生理鹽水內(nèi)清洗載玻片2次,洗去未吸附的細胞。晾干,1:1丙酮-甲醇溶液固定,用姬姆薩染色液染色3m in,用蒸餾水漂洗,晾干后,用油鏡檢查。計數(shù)巨噬細胞吞噬雞紅細胞的吞噬百分率和吞噬指數(shù)。
1.6.2 NK細胞活性[7]:無菌取脾,常規(guī)制備脾細胞,調(diào)整效應細胞濃度至1×107個/m L,取傳代培養(yǎng)處于對數(shù)生長期的人白血病K562細胞,調(diào)整靶細胞濃度至1×105個/mL。采用LDH法檢測NK細胞活性。
2 結(jié)果
2.1 移植瘤生長規(guī)律
本實驗三種方法分別取10只裸鼠接種NCI-H 460細胞株。細胞培養(yǎng)移植法和勻漿液移植法成瘤率達100%,潛伏期為3~5d,腫瘤組織在短期內(nèi)呈膨脹性生長。觀察5周,腫瘤生長曲線符合Gompertzian曲線,18~20d腫瘤體積即達到1500
mm3,之后生長趨于穩(wěn)定,平臺期較長,如圖所示(圖 1)。腫瘤組織體積倍增時間(tumor doubling time,TD)分別為(6.1±0.4)d和(5.8±1.2)d。組織塊移植法成瘤率為80%,潛伏期為5~9 d。觀察5周,腫瘤生長Gompertzian曲線多處于對數(shù)生長期,觀察期結(jié)束瘤體積剛好達到1500mm3。TD為(4.7±0.7)d。腫瘤為可觸結(jié)節(jié)狀,質(zhì)略軟,隨著時間的延長,腫瘤體積逐漸增大,質(zhì)變硬,瘤體被覆不完整結(jié)締組織包膜,毛細血管清晰,細胞培養(yǎng)組和勻漿液組后期瘤塊頂部發(fā)黑,局部血管明顯擴張,有的瘤塊頂部可出現(xiàn)壞死。解剖后,見瘤體有完整的包膜,呈結(jié)節(jié)狀生長,中央多為豆腐渣樣壞死。三種造模方法在腫瘤形成過程中均未觀察到腫瘤自然消退者。
2.2 組織形態(tài)學
肉眼觀察見3種方法組的腫瘤均位于皮下,球形或橢圓形,少數(shù)呈分葉狀,勻漿液組和細胞培養(yǎng)組的瘤塊大小較為均勻,而組織塊移植法由于接種的組織塊大小很難均一,所以形成的腫瘤大小有一定的差異。HE染色結(jié)果(圖2,見彩插6)顯示典型的上皮癌特征,移植瘤細胞多為圓形或橢圓形,體積較大,密集成團分布或呈巢狀排列,胞漿豐富、深染,核分裂相多,或可見2~3個核仁。各組無明顯差別。
2.3 生化指標
全自動生化分析儀檢測生化指標結(jié)果見圖3。接種2周后,與正常對照組比較,三組荷瘤小鼠血液中ALT變化不明顯,AST升高,其中埋塊組差異有顯著性(P<0.05);BUN有降低趨勢,細胞培養(yǎng)組差異有顯著性(P<0.01)。荷瘤小鼠血糖均顯著降低(P<0.05;P<0.01)。三種方法組之間進行單因素方差分析比較,勻漿液組荷瘤小鼠血液中GLU顯著低于埋塊組(P<0.01)。接種4周后,與正常對照組比較,勻漿液組和細胞培養(yǎng)組荷瘤小鼠肝功能指標ALT、AST均顯著升高(P<0.05;P<0.01),腎功能指標 BUN、CREA顯著降低(P<0.01)。三種方法組之間進行單因素方差分析比較,埋塊組ALT、AST顯著低于另兩個荷瘤組(P<0.05;P<0.01),BUN、CREA高于另兩組但是無統(tǒng)計學差異(P>0.05)。5周后,三組荷瘤小鼠ALT、AST均高于正常對照組,BUN、CREA顯著低于正常小鼠(P<0.05;P<0.01)。
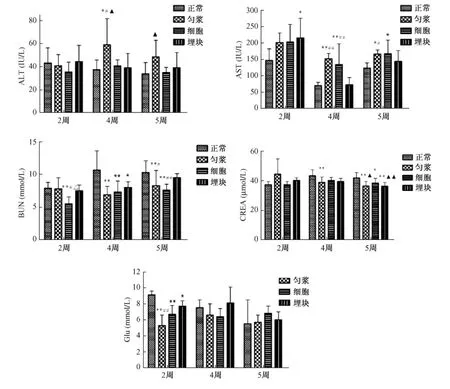
圖3 荷瘤小鼠和正常小鼠血液生化指標的比較。Fig.3 Blood biochemistry of the tumor-bearing mice and normal mice.注:*P<0.05;**P<0.01與正常對照組比;△P<0.05與勻漿液組比;▲P<0.05;▲▲P<0.01與細胞培養(yǎng)組比;#P<0.05;##P<0.01與埋塊組比。Note:*P<0.05;**P<0.01,vs.the control group;△P<0.05,vs.the homogenate group;▲P<0.05,▲▲P<0.01,vs.the cultured cell group;#P<0.05,##P<0.01,vs.the tissue transplantation group.
2.4 血液中白細胞分類的變化
從表1可見,與正常對照組比較,勻漿液組和細胞培養(yǎng)組的荷瘤小鼠血液中WBC、NEUT%、PLT均呈現(xiàn)顯著性升高(P<0.05;P<0.01);埋塊組荷瘤小鼠WBC、PLT呈升高趨勢,但無顯著性差異(P>0.05)。三種方法組荷瘤小鼠血液中 LYM%、MN%、HGB則呈降低趨勢,其中勻漿液組和細胞培養(yǎng)組差異有統(tǒng)計學意義(P<0.05;P<0.01)。三種方法組間進行單因素方差分析比較,勻漿液組和細胞培養(yǎng)組差異未見顯著性,埋塊組除PLT與細胞培養(yǎng)組差異未見顯著性外,其余指標與其他兩組差異均呈現(xiàn)顯著性(P<0.05;P<0.01)。
2.5 非特異性免疫功能
2.5.1 腹腔巨噬細胞吞噬活性:結(jié)果顯示,接種2周時,裸鼠腹腔巨噬細胞吞噬百分率和吞噬指數(shù)均以勻漿液組>埋塊組>細胞培養(yǎng)組>正常對照組,勻漿液組與對照組、細胞培養(yǎng)組比較差異均有顯著性(P<0.05;P<0.01)。隨著裸鼠周齡增長,其免疫功能有所恢復,接種5周后,正常組裸鼠腹腔巨噬細胞吞噬活性升高,三個荷瘤組吞噬百分率和吞噬指數(shù)均顯著低于正常組(P<0.05;P<0.01),以埋塊組<細胞培養(yǎng)組<勻漿液組 <正常對照組,勻漿液組與另外兩個荷瘤組差異有顯著性(P<0.05;P<0.01)(表2)。
表1 三種方法荷瘤小鼠和正常小鼠血液中白細胞分類的比較(n=10,±s)Tab.1 Leukocyte differential count of the tumor-bearing mice in the mice of the three tumor groups and normal group(n=10,±s)

表1 三種方法荷瘤小鼠和正常小鼠血液中白細胞分類的比較(n=10,±s)Tab.1 Leukocyte differential count of the tumor-bearing mice in the mice of the three tumor groups and normal group(n=10,±s)
注:*P<0.05,**P<0.0,與正常對照組比;▲P<0.05;▲▲P<0.01,與埋塊組比;Note:*P<0.05,**P<0.01,vs.the control group;▲P<0.05,▲▲P<0.01,vs.the tissue transplantation group.
組別Groups WBC(×103/) NEUT(%) LYM(%) MN(%) HGB(g/L)PLT正常對照組Normal control 2.8±1.0 57.3±8.9 33.3±8.8 1.6±0.5 163.2±6.4 1200.0±120.5勻漿液組 Homogenate group 15.6±6.2**▲▲ 79.2±2.7**▲▲ 11.1±1.5**▲▲ 0.7±0.2*▲ 126.8±8.2**▲▲ 1910.4±281.8**▲細胞培養(yǎng)組 Cell group 11.9±9.4*▲ 75.1±13.1*▲▲ 17.0±9.1**▲▲ 0.7±0.3*▲ 137.2±8.7**▲▲ 1739.3±439.7*埋塊組Tissue transplantation group 5.0±2.7 55.3±12.8 32.9±11.5 1.3±0.9 154.0±11.4 1385.2±414.3
表2 三種方法荷瘤小鼠和正常小鼠腹腔巨噬細胞吞噬活性的比較(n=5,±s)Tab.2 Comparison of the phagocytosis activity index of the tumor-bearing mice in the three groups and normal mice(n=5,±s)
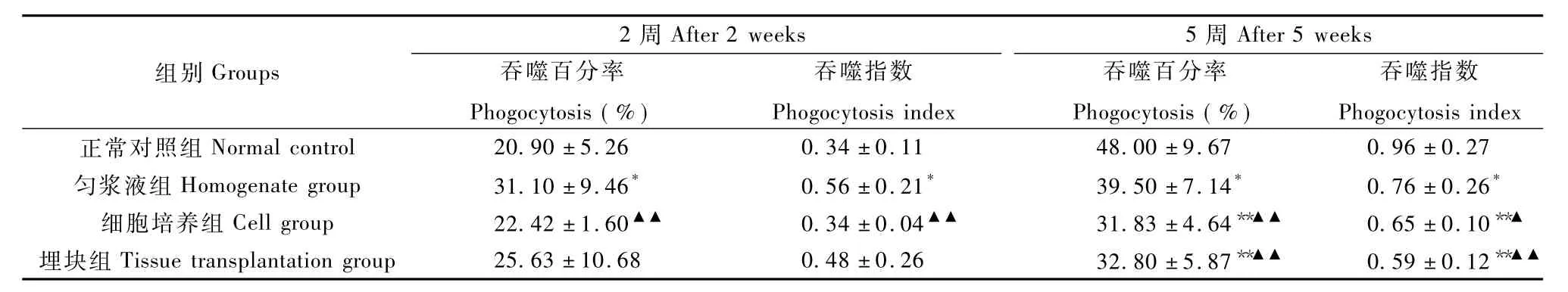
表2 三種方法荷瘤小鼠和正常小鼠腹腔巨噬細胞吞噬活性的比較(n=5,±s)Tab.2 Comparison of the phagocytosis activity index of the tumor-bearing mice in the three groups and normal mice(n=5,±s)
注:*P<0.05,**P<0.01,與正常對照組比;▲P<0.05,▲▲P<0.01,與勻漿液組比。Noto:*P<0.05,**P<0.01,vs.the control group;▲P<0.05,▲▲P<0.01,vs.the homogenate group.
組別Groups 2周After 2weeks 5周After 5weeks吞噬百分率Phogocytosis(%)吞噬指數(shù)Phogocytosis index吞噬百分率Phogocytosis(%)吞噬指數(shù)Phogocytosis index正常對照組Normal control 20.90±5.26 0.34±0.11 48.00±9.67 0.96±0.27勻漿液組Homogenate group 31.10±9.46* 0.56±0.21* 39.50±7.14* 0.76±0.26*細胞培養(yǎng)組Cell group 22.42±1.60▲▲ 0.34±0.04▲▲ 31.83±4.64**▲▲ 0.65±0.10**▲埋塊組Tissue transplantation group 25.63±10.68 0.48±0.26 32.80±5.87**▲▲ 0.59±0.12**▲▲
2.5.2 NK活性:結(jié)果顯示,接種2周時,未接種裸鼠NK活性較低,荷瘤裸鼠NK活性顯著高于正常小鼠(P<0.05;P<0.01),勻漿液組NK活性最高,與細胞培養(yǎng)組差異有顯著性(P<0.01)。5周后隨著裸鼠周齡增長,其NK活性逐漸增強,正常組裸鼠NK活性升高幅度最大,三組荷瘤裸鼠NK活性低于正常組,其中細胞培養(yǎng)組和埋塊組差異具有顯著性(P<0.05;P<0.01);埋塊組顯著低于另外兩組荷瘤組(P<0.05;P<0.01)(表3)。
表3 三種方法荷瘤小鼠和正常小鼠NK活性的比較(n=5,±s,%)Tab.3 Comparison of the NK cell activity of tumor-bearing m ice in the three groups and normal mice(n=5,±s,%)
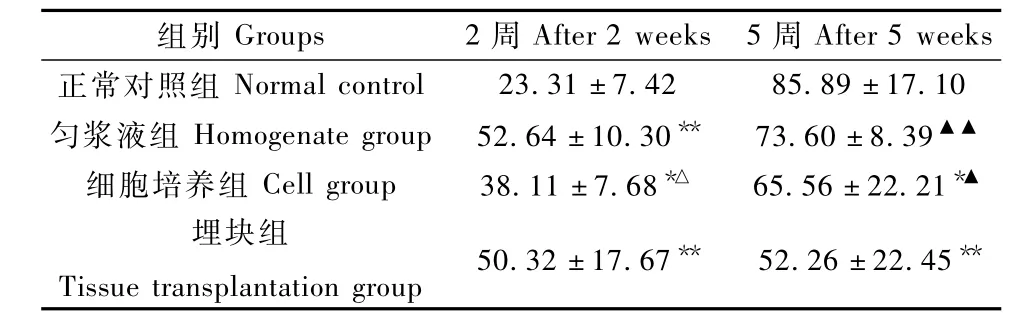
表3 三種方法荷瘤小鼠和正常小鼠NK活性的比較(n=5,±s,%)Tab.3 Comparison of the NK cell activity of tumor-bearing m ice in the three groups and normal mice(n=5,±s,%)
注:*P<0.05,**P<0.01,與正常對照組比;△P<0.05,與勻漿液組比;▲P<0.05;▲▲P<0.01,與埋塊組比。Note:*P<0.05,**P<0.01,vs.the control group;△P<0.05,vs.the homogenate group;▲P<0.05,▲▲P<0.01,vs.the tissue group.
組別Groups 2周A fter 2weeks 5周After 5weeks正常對照組Normal control 23.31±7.42 85.89±17.10勻漿液組 Homogenate group 52.64±10.30** 73.60±8.39▲▲細胞培養(yǎng)組 Cell group 38.11±7.68*△ 65.56±22.21*▲埋塊組Tissue transplantation group 50.32±17.67** 52.26±22.45**
3 討論
人體腫瘤的裸鼠異種移植模型對抗癌藥的反應與臨床反映基本平行,比體外敏感性實驗有更高的可靠性,是抗腫瘤藥物臨床前藥效學的主要評價依據(jù)。潛伏期短、移植瘤成活率高、生長均勻、組織學和原始腫瘤基本符合、染色體核型和生化指標穩(wěn)定的移植瘤模型在腫瘤研究和實驗動物領域都至關重要[8]。故本文先以三種皮下移植方法成功建立了人大細胞肺癌移植瘤,HE染色結(jié)果顯示移植瘤組織形態(tài)呈現(xiàn)典型的上皮癌細胞特征,與大細胞肺癌臨床病理檢查結(jié)果相符。細胞培養(yǎng)和勻漿液移植法由于接種細胞數(shù)可控,腫瘤大小均勻,生長曲線基本符合 Gompertzian曲線,由于接種量較大,接種后腫瘤組織在短期內(nèi)呈膨脹性生長,平臺期較長,多處于 Gompertzian曲線上段,腫瘤的生長指數(shù)(grow th fraction,GF)值較低,較好地模擬了多數(shù)臨床可檢腫瘤的生長特征,但是已知抗腫瘤藥的一大作用機制是干擾DNA合成及其功能,因此,GF值低、增殖較慢的腫瘤對這些藥物就不敏感,不適于抗腫瘤藥物的篩選[9]。尤其是目前廣泛應用于抗腫瘤研究的中草藥,具有起效慢,療效緩,療程長的特點。本文采用的組織塊移植法通過將組織塊體積由常用的1~2mm3縮小為0.5mm3,使腫瘤生長Gompertzian曲線多處于對數(shù)生長期,腫瘤的分裂指數(shù)升高,可以增加其對藥物的敏感,使其更有利于抗腫瘤中藥的藥效學研究。該方法由于接種的組織塊無法保證均一,所以對成瘤率和均勻性造成了影響。
當前大量的研究集中于人腫瘤裸鼠移植瘤模型的構建以及瘤組織生物學特性的研究,對荷瘤機體生理狀態(tài)和免疫功能的研究甚少,缺乏對腫瘤的整體認識。血液中白細胞計數(shù)、分類以及生化指標檢測是目前臨床上判斷人體健康狀況或疾病的最常用的診療手段之一。在許多異常情況下(包括炎癥、損傷等)都會出現(xiàn)血液中白細胞計數(shù)、分類以及生化指標的改變。我們的研究發(fā)現(xiàn),荷瘤裸鼠的ALT、AST顯著高于正常裸鼠,說明伴隨著腫瘤生長,荷瘤裸鼠的肝功能下降,肝損傷明顯,剖檢指標升高最明顯的勻漿液組裸鼠發(fā)現(xiàn)肝臟有轉(zhuǎn)移結(jié)節(jié)。提示大細胞肺癌在生長后期發(fā)生了肝轉(zhuǎn)移[10]。荷瘤裸鼠BUN、CREA顯著降低,這與徐彩菊等[11]研究結(jié)果一致。臨床上BUN降低與肝功能衰竭有關,CREA的降低主要受貧血、營養(yǎng)狀況的影響。本實驗的3種方法中,埋塊組的BUN顯著高于另兩個荷瘤組,推測與其肝轉(zhuǎn)移程度遠遠小于其他兩組有關。此外,接種2周后,荷瘤裸鼠的Glu顯著低于正常裸鼠,勻漿液組的Glu降得最低,這可能與腫瘤在此階段膨脹性生長過度利用葡萄糖有關[12]。白細胞分類檢測結(jié)果顯示,荷瘤小鼠血液中白細胞計數(shù)升高,說明腫瘤與炎癥存在著密不可分的聯(lián)系;血小板數(shù)升高,血紅蛋白含量下降,提示惡性腫瘤的血液高凝和貧血狀態(tài);淋巴細胞和單核細胞的百分比下降提示腫瘤患者細胞免疫功能低下,與張奉梅等[13]研究結(jié)果一致。
眾所周知,裸鼠由于無胸腺,T細胞免疫功能缺陷,使得動物模型不能確切反映人類免疫系統(tǒng)的特點,嚴重阻礙了腫瘤免疫學的發(fā)展。事實上,成年裸鼠(6~8周齡)較普通鼠有較高水平的天然殺傷(NK)細胞活性,但幼鼠(3~4周齡)的NK細胞活性低下[14]。NK細胞是非特異性細胞免疫系統(tǒng)的主要成員,其細胞毒作用可以通過Fas/FasL途徑介導的細胞凋亡來實現(xiàn)。腫瘤發(fā)展與NK細胞水平下降及FasL表達水平降低有關。同時NK細胞與T細胞存在高度的同源性,能間接反應特異性細胞免疫系統(tǒng)[15]。我們在實驗中發(fā)現(xiàn),荷瘤裸鼠的腹腔巨噬細胞吞噬活性及NK細胞活性均表現(xiàn)為先升高,后降低。這與“腫瘤免疫監(jiān)視理論”一致[16]。該理論認為,一旦腫瘤發(fā)生即產(chǎn)生針對外源性組織相容性復合體(MHC)抗原的免疫應答。免疫系統(tǒng)能持續(xù)地監(jiān)視體內(nèi)存在的異常細胞,識別并摧毀他們。表現(xiàn)為腫瘤發(fā)生的早期機體免疫功能升高,隨著腫瘤的生長,免疫功能下降。勻漿液組在接種的初期非特異性免疫功能增強明顯,可能與其接種的死細胞比例高產(chǎn)生較強的免疫應答有關。
本實驗采用的三種方法,細胞培養(yǎng)和勻漿液移植法接種數(shù)量可控,腫瘤生長均勻,適合建立不同實驗需求的移植瘤模型。但是勻漿液移植法由于在制備勻漿懸液的過程中死細胞較多,接種后產(chǎn)生的炎癥應答較強,動物狀態(tài)差,容易繼發(fā)感染,不推薦使用。組織塊移植法在改良后非常適于建立中藥抗腫瘤篩選的動物模型。裸鼠的生理生化狀態(tài)和免疫功能與腫瘤的生長有密切的關系。提示從整體角度出發(fā),選擇能更好地模擬臨床腫瘤的發(fā)生發(fā)展的動物模型對開展抗腫瘤藥作用機制的研究具有重要意義。
[1]王興旺,胥彬.抗腫瘤藥物篩選模型和方法研究的新結(jié)果[M].見:鄭樹主編.中國癌癥研究進展③.北京:軍事醫(yī)學出版社.1998:110-113.
[2]林蕓秀,呂聯(lián)煌,林錦娟,等.人小細胞肺癌NCI-H446細胞裸鼠異種移植瘤模型的建立[J].實驗動物科學與管理,2004,3:1-3.
[3]饒子亮,劉盛來,黃小瓊,等.亞砷酸對裸鼠宮頸癌移植瘤模型的干預研究[J].中國比較醫(yī)學雜志,2009;,9:22-25.
[4]張勝本,黃顯凱,饒本強.SW-480裸鼠移植瘤模型的建立及其生物學特性 [J].第三軍醫(yī)大學學報,2000,22:109 -111.
[5]張寶來,徐明麗,高明堂,等.提高人肺腺癌裸鼠皮下移植瘤成瘤率的方法學研究[J].中國臨床藥理學與治療學,2007,12:1052-1057.
[6]沈曉瓏,沈文率,劉少杰,等.扶正抗癌湯對荷瘤裸鼠非特異性細胞免疫系統(tǒng)的作用[J].山西醫(yī)科大學學報,2005,36:448-450.
[7]劉安軍,車偉,張旭,等.軟骨多糖對荷瘤小鼠免疫功能影響的初步研究[J].中國比較醫(yī)學雜志,2008,18:48-51.
[8]韓銳,主編.抗腫瘤藥物研究與實驗技術[M].北京:北京醫(yī)科大學中國協(xié)和醫(yī)科大學聯(lián)合出版社.1997:
[9]甄永蘇.惡性腫瘤治療的病理藥理學基礎與新藥研發(fā)[M].見:甄永蘇主編.抗腫瘤藥物研究與開發(fā).北京:化學工業(yè)出版社.2004:7-15.
[10]Howard RB,Mullen JB,Pagura ME,et al.Characterization of a highly metastatic,orthotopic lung cancer model in the nude rat[J].Clin Exp Metastasis.1999,17:157-162.
[11]徐彩菊,姚亞萍,孟佳,等.S180荷瘤小鼠血液中指標的變化[J].中國衛(wèi)生檢驗雜志.,2007,17:2033-2035.
[12]李建鵬,朱圖志,鞏克亭,等.順鉑為基礎的聯(lián)合化療對非小細胞肺癌患者血糖影響的臨床觀察[J].中華腫瘤防治雜志,2009,16(23):1878-1880.
[13]張奉梅,龔繼勇,龔繼梅,等.加味當歸補血湯對荷瘤小鼠血液流變學及免疫功能的影響[J].時珍國醫(yī)國藥,2010, 21(9):2247-2248.
[14]周雪瑞,黃選東.免疫缺陷動物裸鼠[J].生物學教學.2007,32(3):2-4.
[15]Velthuis J H,de Bont HJ,Medema JP,et al.Interleukin-2activated NK cells do not use the CD95L-and TRAIL-pathways in the rapid induction of apoptosis of rat colon carcinoma CC531s cells[J].Immunobiology,2003,207(2):115-127.
[16]李帥,王小平.腫瘤細胞疫苗研究進展[J].現(xiàn)代腫瘤醫(yī)學.2010,18:618-620.

