Cramp過表達對小鼠骨髓造血干細胞功能的影響
石桂英,陳顯達,陳陟陽,馬小茗,鞠振宇
(中國醫學科學院,北京協和醫學院,醫學實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021)
端粒(telomere)是真核細胞染色體末端的特殊核蛋白復合體,其包括一段非編碼的TTAGGG重復序列和與之相連的端粒結合蛋白(telomere binding protein)[1]。端粒是一種保護性結構,不具有編碼蛋白質的功能,但在維持染色體末端穩定及避免染色體被核酶降解等方面起重要作用。在人類衰老及慢性病中都伴有端粒的縮短[2-5],端粒縮短被認為是細胞衰老的生物學標志。端粒酶(telomerase)是一種核糖核蛋白 DNA聚合酶,它是一種自身攜帶RNA組分為復制模板的罕見的逆轉錄酶,其主要功能是合成端粒,以維持端粒長度的穩定性[1]。端粒酶變異會導致端粒縮短,從而影響組織的穩態維持,使人[6]和小鼠[7,8]的壽命縮短。端粒酶基因敲除小鼠沒有端粒酶基因,隨著傳代次數的增加,端粒逐漸縮短,第三代端粒酶基因敲除小鼠即為短端粒小鼠,其衰老具有端粒依賴性[8]。Jiang等以第四代端粒酶基因敲除小鼠為模型,研究發現在端粒損傷老齡小鼠中,有4種蛋白高表達,是端粒功能缺陷及DNA損傷引起的衰老和疾病相關的生物標記物,Cramp蛋白為其中之一[9]。
小鼠Cramp蛋白是由Gallo等[10]首先分離鑒定的,該類蛋白與之前在人、豬、牛、兔、羊等動物中發現的抗菌肽前體,具有高度保守的區域即 cathelin,因此,將這一大類抗菌肽命名為 cathelicidins。目前已知其主要功能是抗菌活性,此外,還具有抑制組織損傷、促進創傷修復、結合內毒素、誘導血管生成等多種生物學功能。炎性衰老是目前國際衰老理論的研究熱點[11-13],Cramp蛋白作為一種炎癥因子,在老齡短端粒模型小鼠中高表達,而正常老齡野生型小鼠中其表達量未見明顯升高[9],該蛋白在衰老中的作用值得深入研究。本研究中,我們應用12月齡 Cramp過表達轉基因小鼠和同齡野生型小鼠進行了初步研究,以了解該基因在衰老過程中對不同組織器官的影響,為深入研究Cramp在衰老中的作用和機制提供基礎。
1 材料和方法
1.1 Cramp高表達轉基因小鼠
該小鼠由本所構建并繁育[SCXK(京)2009-0007]。動物飼養在SPF動物房內,脫頸椎處死后,取組織進行流式分析、分選。
1.2 PCR方法鑒定Cramp轉基因小鼠的基因型
用2周齡小鼠尾尖提取基因組DNA,PCR鑒定基因型。反應條件:94℃預變性3 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,35個循環;72℃延伸10 min。轉基因陽性小鼠的 PCR鑒定引物:上游引物為5'GGCTGTGGCGGTCACTATC 3',下 游 引 物 為 5'TCACCACCCCCTGTTCCTT 3',產物長度271 bp,引物由上海生物工程技術有限公司合成,PCR試劑購自寶生物工程有限公司。
1.3 流式分析
小鼠脫頸椎處死后,取脾臟、胸腺,置于冰上預冷的染色緩沖液(含1%BSA的PBS)中,脾臟縱剖成2份,1份用10%中性福爾馬林溶液固定,1份用載玻片研磨成細胞懸液;胸腺用載玻片研磨成細胞懸液,將細胞懸液用50μm尼龍濾膜過濾后收集到15 m L離心管中,用 PBS定容至10 m L,混勻后,取10μL細胞液,稀釋10倍后計數細胞數。細胞懸液離心,1000 rpm,10 m in,將細胞濃度調整為1×108細胞/mL。分別取106細胞標記熒光抗體(BD公司)。
骨髓及脾臟細胞的分析中用 B220-FITC、CD115-PE、CD4-Pcrcp-cy5.5、CD8-Pcrcp-cy5.5、Gr1-PE-Cy7、CD11c-APC、CD11b-APC-Cy7,分別標記 B淋巴細胞、T淋巴細胞和粒細胞;CD71-PE、Ter119-APC,標記不同發育階段的紅細胞比例;IgD-FITC、CD43-PE、B220-PE-Cy7、IgM-APC,標記不同發育階段的B淋巴細胞;CD34-FITC、Flt3-PE、IL7R-Pcrcpcy5.5、Sca1-PE-Cy7、cKit-APC、Ter-119-Bio、Gr-1-Bio、Mac-1-Bio、B220-Bio、IL-7R-Bio、CD4-Bio、CD8-Bio、Bio-APC-Cy7,標記骨髓造血干細胞。上述抗體加入細胞懸液,冰上避光,30 min;加1 m L染色緩沖液,離心,2600 rpm,5 m in,棄上清,加200μL染色緩沖液重懸細胞,用50μm尼龍濾膜過濾,冰上避光備用。
胸腺細胞用 CD8-FITC、CD4-APC,CD3-PerCPCy5.5分別標記 CD8+、CD4+、CD3+細胞,冰上避光,30 min;加200μL染色緩沖液,離心,2600 rpm,5 min,棄上清,加200μL染色緩沖液重懸細胞,用50 μm尼龍濾膜過濾,冰上避光備用。
1.4 統計分析方法
組間資料分析采用Student t檢驗。
2 結果
2.1 Cramp過表達對造血系統的影響
為了解Cramp過表達對造血系統的影響,我們分析了Cramp+轉基因小鼠和野生對照小鼠的骨髓、胸腺、脾臟等組織的細胞組成情況。結果顯示Cramp過表達對小鼠骨髓、脾臟的B220+淋巴細胞、CD11b+Gr1+細胞的比例沒有影響,骨髓中造血干細胞(c-kit+、sca1+、lin-,KSL)沒有影響,對胸腺各類T淋巴細胞的比例也沒有明顯影響(圖1)。
2.2 Cramp過表達對骨髓造血干細胞克隆形成能力的影響
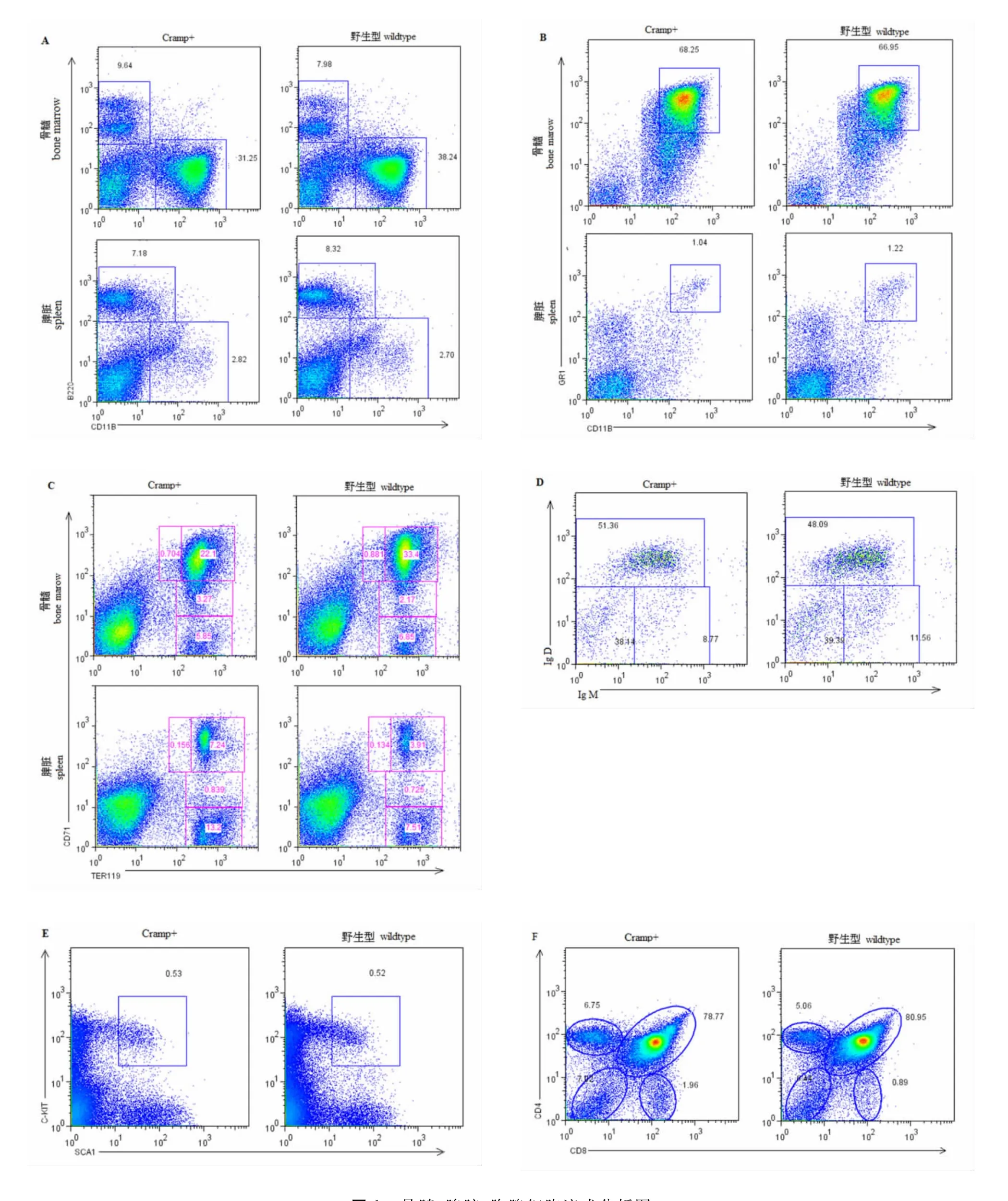
圖1 骨髓、脾臟、胸腺細胞流式分析圖Fig.1 Analysis of bonemarrow,spleen and thymus
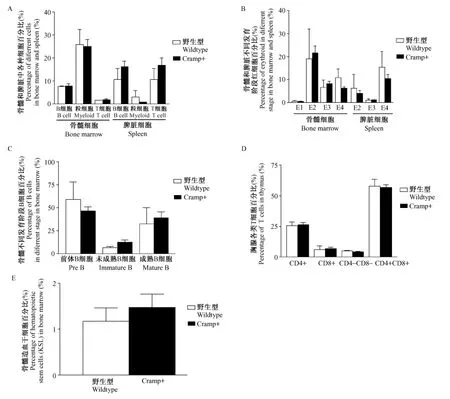
圖2 骨髓、脾臟、胸腺中各種細胞所占比例Fig.2 Percentages of different cells in bone marrow,spleen and thymus
為了進一步研究 Cramp過表達對骨髓造血干細胞分化能力的影響,我們分選出單個骨髓造血干細胞(ckit+、sca1+、lin-)進行體外培養,結果顯示Cramp過表達對骨髓造血干細胞克隆形成能力無明顯影響。
3 討論
已有研究發現Cramp蛋白是端粒損傷引起的衰老的生物標記物[9],為研究Cramp對骨髓造血干細胞的影響,我們構建了CMV-Cramp過表達轉基因小鼠[14]。本實驗中,我們應用流式細胞術,分析了脾臟、胸腺、骨髓等組織器官中各類細胞的比例,結果發現在正常生理狀態下,與同齡野生型小鼠相比,Cramp過表達小鼠脾臟、骨髓中B細胞、粒細胞及紅細胞的比例沒有顯著差異,這說明Cramp過表達對骨髓造血干細胞的發育分化沒有顯著影響;對胸腺細胞的分析發現,Cramp過表達小鼠各類T細胞的比例與野生型相比沒有顯著差異,可見,Cramp過表達對T細胞的發育沒有顯著影響;同時分選骨髓造血干細胞,并進行體外單克隆形成實驗,發現Cramp過表達對骨髓造血干細胞的數量及自我更新能力沒有顯著影響。
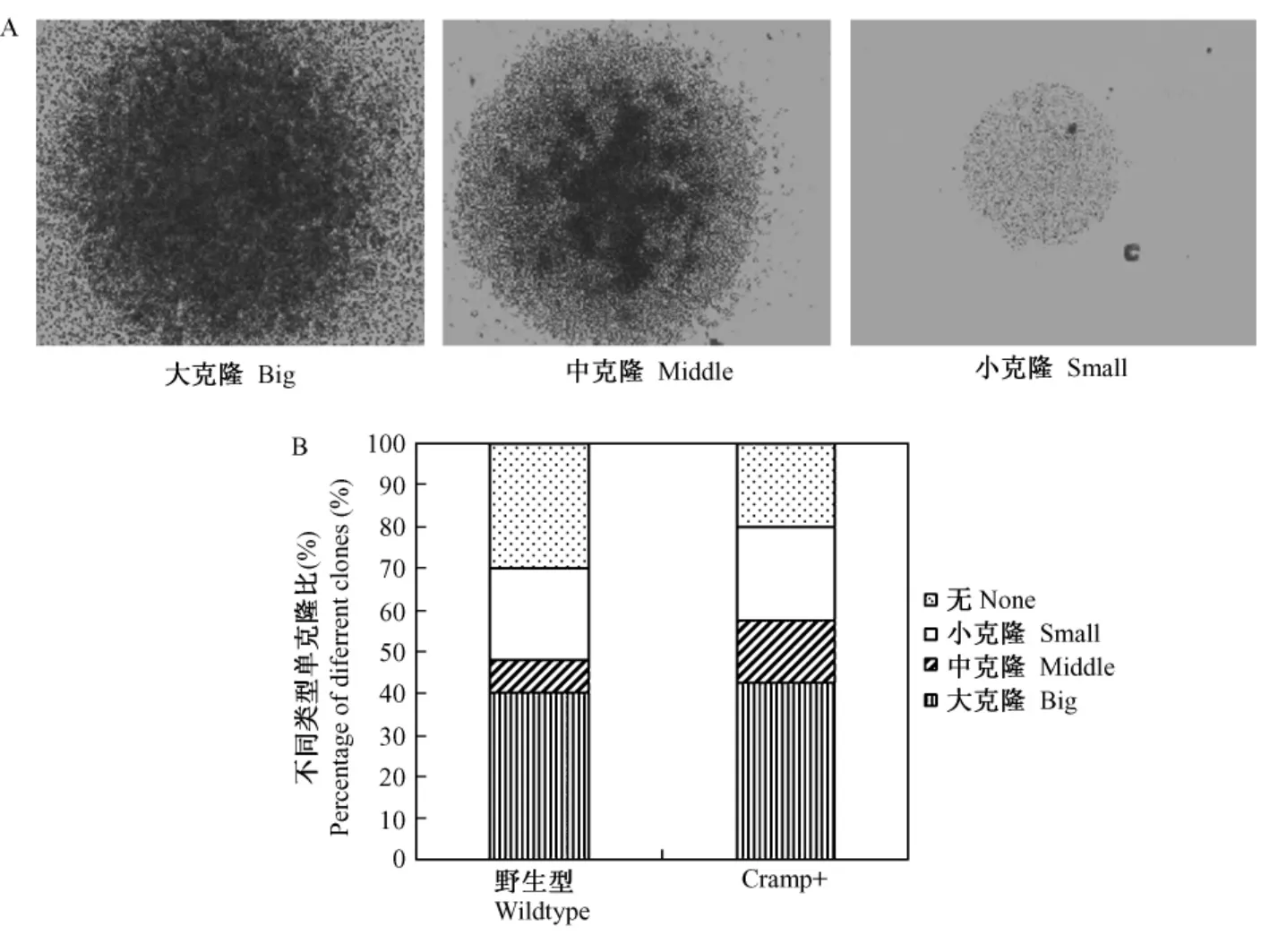
圖3 骨髓造血干細胞克隆形成能力Fig.3 Colony Form ing potential of HSCs
通過本研究,未發現Cramp過表達對小鼠造血系統有明顯影響,這可能有以下原因:一方面,本研究中,Cramp過表達轉基因小鼠尚未完全導入C57BL/6J背景,這種雜合背景可能會影響Cramp過表達的表型;另一方面,本研究中,未分離Cramp過表達轉基因小鼠的骨髓,進行競爭性骨髓移植及連續移植實驗,競爭性骨髓移植是評價造血干細胞造血重建能力和長期自我更新能力的標準實驗。因此,Cramp過表達對骨髓造血干細胞的影響,還需在C57BL/6J純合背景下,通過競爭性骨髓移植及連續移植實驗進行驗證。
[1]Harley CB,Villeponteau B.Telomeres and telomerase in aging and cancer[J].Current opinion in genetics& development,1995,5:249-255.
[2]Harley CB,Futcher AB,Greider CW.Telomeres shorten during ageing of human fibroblasts[J].Nature,1990,345:458-460.
[3]Keller G,Brassat U,Braig M,Heim D,Wege H,Brummendorf TH.Telomeres and telomerase in chronic myeloid leukaemia: impact for pathogenesis,disease progression and targeted therapy[J].Hematological oncology,2009,27:123-129.
[4]Lechel A,Holstege H,Begus Y,et al.Telomerase deletion lim its progression of p53-mutant hepatocellular carcinoma with short telomeres in chronic liver disease[J].Gastroenterology,2007,132:1465-1475.
[5]Savale L,Chaouat A,Bastuji-Garin S,et al.Shortened telomeres in circulating leukocytes of patients with chronic obstructive pulmonary disease[J]. American journal of respiratory and critical caremedicine,2009,179:566-571.
[6]Mitchell JR,Wood E,Collins K.A telomerase component is defective in the human disease dyskeratosis congenita[J].Nature,1999,402:551-555.
[7]Hao LY,Armanios M,Strong MA,et al.Short telomeres,even in the presence of telomerase,limit tissue renewal capacity[J].Cell,2005,123:1121-1131.
[8]Rudolph KL,Chang S,Lee HW,et al.Longevity,stress response,and cancer in aging telomerase-deficient mice[J].Cell,1999,96:701-712.
[9]Jiang H,Schiffer E,Song Z,et al.Proteins induced by telomere dysfunction and DNA damage represent biomarkers of human aging and disease[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105:11299 -11304.
[10]Gallo RL,Kim KJ,Bernfield M,et al.Identification of CRAMP,a cathelin-related antimicrobial peptide expressed in the embryonic and adultmouse[J].JBiol Chem,1997,272:13088 -13093.
[11]Franceschi C.Inflammaging as a major characteristic of old people:can it be prevented or cured?[J]Nutrition reviews,2007,65:S173-176.
[12]Goto M.Inflammaging(inflammation+aging):A driving force for human aging based on an evolutionarily antagonistic pleiotropy theory?[J].Bioscience trends,2008,2:218-230.
[13]Navarrete-Reyes AP,Montana-Alvarez M.Inflammaging.Aging inflammatory origin[J].Revista de investigacion clinica;organo del Hospital de Enfermedades de la Nutricion,2009,61:327 -336.
[14]石桂英,全雄志,陳顯達,等.Cramp轉基因小鼠的構建及鑒定[J].中國比較醫學雜志,2010,20(9):12-15.

