過表達(dá)Baff轉(zhuǎn)基因斑馬魚的構(gòu)建
張 力,謝 英,劉樹鋒
(河北醫(yī)科大學(xué)河北省實驗動物重點實驗室,石家莊 050017)
斑馬魚具有繁殖能力強(qiáng)、體外受精和發(fā)育、胚胎透明、性成熟周期短、個體小易養(yǎng)殖,可針對治療藥物進(jìn)行高通量篩選等諸多特點,使其成為后基因組時代生命科學(xué)研究中重要的模式脊椎動物之一[1,2]。B細(xì)胞活化因子(B cell activating factor,baff)是1999年發(fā)現(xiàn)的腫瘤壞死因子超家族新成員,在B細(xì)胞發(fā)育、功能調(diào)節(jié)和自身免疫病發(fā)病機(jī)制中的作用受到關(guān)注[1]。研究發(fā)現(xiàn),系統(tǒng)性紅斑狼瘡(system ic lupus erythematosus,SLE)患者血清中Baff水平與IgG及抗dsDNA自身抗體水平均顯著升高[4]。NZB、(NZB/NZW)F1、MRL/lpr等經(jīng)典SLE模型同樣表現(xiàn)出高滴度Baff的發(fā)病特征[2]。有文獻(xiàn)報道,過表達(dá)baff的轉(zhuǎn)基因小鼠可導(dǎo)致SLE樣疾病,而拮抗Baff可延緩狼瘡易感小鼠的疾病進(jìn)展[3]。近年來,Baff拮抗劑的篩選成為SLE靶向藥物篩選的研究熱點之一。
本研究旨在通過分別構(gòu)建baff過表達(dá)重組質(zhì)粒pEGFP-C1-baff、pEGFP-N1-baff、p IRES2-EGFP-baff,通過胚胎顯微注射獲得過表達(dá)Baff蛋白的轉(zhuǎn)基因斑馬魚,為SLE轉(zhuǎn)基因斑馬魚疾病模型的建立與高通量藥物篩選研究提供良好基礎(chǔ)。
1 材料和方法
1.1 材料
1.1.1 實驗動物
性成熟Tuebingen品系斑馬魚引自北京大學(xué)生命科學(xué)研究院,全自動化控溫控光水處理、循環(huán)的斑馬魚專用養(yǎng)殖系統(tǒng)日常維護(hù)成魚,水溫28℃,pH 7.5,14∶10 h晝夜時間交替,以孵化的豐年蟲(artemia)喂養(yǎng)。
1.1.2 試劑
質(zhì)粒測序工作由上海生工測序公司完成; DM2000marker(北京康為世紀(jì)公司);凝膠回收試劑盒、DNA連接試劑盒、各種限制性內(nèi)切酶(TaKaRa公司),Trizol(Invitrogen),Phusion聚合酶(NEB),反轉(zhuǎn)錄試劑盒(Fermentas Co.),humanβ-actin一抗與GFP抗體(SantaCruz Co.),質(zhì)粒大小提試劑盒(北京天根生化公司),大腸桿菌Trans1-T1 Phage Resistant Chem ically competent cells(全式金公司),pEGFP-C1、pEGFP-N1、p IRES2-EGFP購自Clontech公司。
1.2 基因克隆與表達(dá)載體構(gòu)建
Trizol法提取成年斑馬魚脾臟RNA,反轉(zhuǎn)錄為cDNA。根據(jù)Zf baff序列(GenBank:NM_ 001113590)設(shè)計克隆引物,并通過RT-PCR法克隆807 bp蛋白編碼序列。引物序列見表1,下劃線部分為引入酶切位點序列。PCR反應(yīng)條件:98℃30 s,98℃10 s,59.5℃30 s,72℃30 s,72℃5 m in終延伸,循環(huán)數(shù)33。
PCR產(chǎn)物經(jīng)酶切并回收長度807 bp片段,酶切后回收保存。p IRES2-EGFP質(zhì)粒經(jīng)BglⅡ與EcoRⅠ內(nèi)切酶消化回收5.1 kb大片段,pEGFP-C1質(zhì)粒經(jīng)BglⅡ與EcoRⅠ內(nèi)切酶消化回收4.7 kb片段回收pEGFP-N1質(zhì)粒經(jīng)BglⅡ與PstⅠ酶切回收4.7 kb大片段,PCR產(chǎn)物與載體通過T4 DNA Ligase 16℃連接過夜,連接產(chǎn)物經(jīng)轉(zhuǎn)化DH5α感受態(tài)后,挑取單克隆菌落,LB培養(yǎng)基震蕩培養(yǎng)12 h后,通過質(zhì)粒提取試劑盒提取質(zhì)粒,后經(jīng)BglⅡ與EcoRⅠ內(nèi)切酶消化鑒定,送測序公司測序。
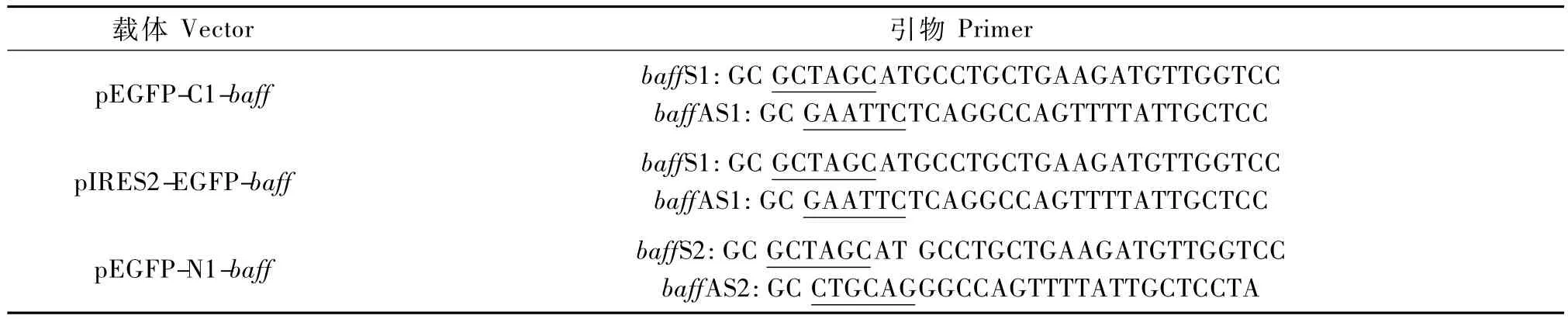
表1 載體構(gòu)建引物序列Tab.1 Primer designated for plam id construction
1.3 細(xì)胞的培養(yǎng)轉(zhuǎn)染與熒光觀察
將HEK293細(xì)胞傳至24孔板,傳代后24 h細(xì)胞匯合度達(dá)90%時進(jìn)行脂質(zhì)體轉(zhuǎn)染。轉(zhuǎn)染方法按照Invitrogen lipofectamin 2000嚴(yán)格操作,每孔質(zhì)粒量為0.8μg,脂質(zhì)體量2μL。轉(zhuǎn)染后48 h,在450~490 nm藍(lán)光激發(fā)下觀察GFP表達(dá)情況。
1.4 蛋白的提取與Westernblot
分別提取瞬時轉(zhuǎn)染有pEGFP-C1-baff,pEGFPN1-baff及p IRES2-EGFP-baff質(zhì)粒HEK293細(xì)胞總蛋白,方法如下:使用含PMSF和蛋白酶抑制劑的1xSDS裂解液冰上裂解細(xì)胞,煮沸10 min,裂解液冰上超聲3 sX15次。離心后吸取上清,-20℃保存。所得蛋白進(jìn)行SDS-PAGE凝膠電泳,將蛋白轉(zhuǎn)移到0.45μm孔徑硝酸纖維素膜上,置于5%脫脂奶粉封閉液中,室溫孵育1 h,加入TBS稀釋的兔抗GFP多克隆抗體(1∶1000)(ab290,abcam,美國),4℃孵育過夜,用TBST洗膜三次,每次10 min。然后加入1∶10000 KPL-Odyssey遠(yuǎn)紅外抗兔二抗,TBST洗膜3次,每次5 m in,棄去二抗,室溫孵育1 h。采用βactin(ab1801,abcam,美國)作為內(nèi)參,將膜置于Odyssey機(jī)器中掃描成像。
1.5 斑馬魚胚胎注射
斑馬魚受精卵的獲取:受精前將雌雄親魚分開飼喂1d后按1∶1~2比例放入產(chǎn)卵池中進(jìn)行產(chǎn)卵交配。分選和洗凈的卵移到有瓊脂糖的表面皿中,注射外源 D NA濃度為0.25μg/μL,DNA體積約2 nL。受精卵的動物極注射完畢后,緩慢抽出注射針,將受精卵放入裝有無菌水的培養(yǎng)皿中,使其恢復(fù)發(fā)育;25~28℃培養(yǎng)胚胎,分別在1~11 d后,熒光顯微鏡下觀察篩選具有綠色熒光蛋白表達(dá)的胚胎。
2 結(jié)果與分析
2.1 pEGFP-C1-baff、pEGFP-N1-baff、pIRES2-EGFP-baff表達(dá)載體的鑒定
pEGFP-C1-baff、pEGFP-N1-baff兩種表達(dá)載體均表達(dá)GFP-Baff融合蛋白,Baff分別融合于GFP蛋白的C端與N端。p IRES2-EGFP-baff分別獨立表達(dá)GFP和Baff蛋白。3種載體各自經(jīng)BglII與EcoRI,BglII與PstI,BglII與EcoRI酶切后均有807 bp左右條帶,結(jié)果表明3種載體的構(gòu)建正確,與測序結(jié)果一致。
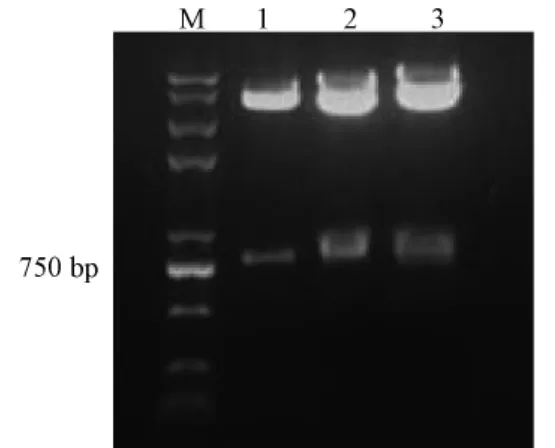
圖1 pEGFP-C1-baff、pEGFP-N1-baff、p IRES2-EGFP-baff質(zhì)粒酶切鑒定注,Note:M:DNA marker;1-3:pEGFP-C1-baff,pEGFP-N1-baff,p IRES2-EGFP-baff重組質(zhì)粒分別經(jīng)BglII and EcoRI,BglII and PstI,BglII and EcoRI酶切鑒定結(jié)果Fig.1 Identification of recombinants by enzyme digestion
2.2 重組載體的體外細(xì)胞驗證
為進(jìn)一步確定融合蛋白的正確表達(dá),將p IRES2-EGFP-baff、pEGFP-C1-baff、pEGFP-N1-baff質(zhì)粒轉(zhuǎn)染HEK293細(xì)胞,轉(zhuǎn)染后48 h觀察其熒光表達(dá)情況。體外細(xì)胞轉(zhuǎn)染結(jié)果表明(彩插4圖2),p IRES2-EGFP-baff、pEGFP-C1-baff、pEGFP-N1-baff 3種重組質(zhì)粒均可成功表達(dá)綠色熒光蛋白。
2.3 免疫印跡驗證融合蛋白表達(dá)
為驗證GFP-Baff融合蛋白的表達(dá),HEK293細(xì)胞經(jīng)pEGFP-C1、pEGFP-C1-baff、pEGFP-N1-baff質(zhì)粒轉(zhuǎn)染后進(jìn)行免疫印跡實驗,結(jié)果發(fā)現(xiàn)轉(zhuǎn)染pEGFPC1空載體的細(xì)胞僅表達(dá)位于26 KDa的GFP蛋白,轉(zhuǎn)染有pEGFP-C1-baff和pEGFP-N1-baff質(zhì)粒的細(xì)胞均表達(dá)有分子量57 KDa的EGFP-Baff融合蛋白,說明了Baff蛋白完整表達(dá)。

圖3 pEGFP-C1,pEGFP-C1-baff,pEGFP-N1-baff質(zhì)粒轉(zhuǎn)染HEK293細(xì)胞蛋白表達(dá)情況注:C:pEGFP-C1空載體轉(zhuǎn)染HEK293細(xì)胞蛋白表達(dá);CB:pEGFP-C1-baff轉(zhuǎn)染后蛋白表達(dá);NB:pEGFP-N1-baff質(zhì)粒轉(zhuǎn)染后蛋白表達(dá)Fig.3 GFP expression in HEK293 cells transfected withpEGFP-C1,pEGFP-C1-baff,pEGFP-N1-baff Note:Lane C:HEK293 transfected by pEGFP-C1 empty vector; CB:HEK293 transfected by pEGFP-C1-baff;NB:HEK293 transfected by pEGFP-N1-baff
2.4 斑馬魚轉(zhuǎn)基因表達(dá)載體的表達(dá)分析
pEGFP-C1-baff、pEGFP-N1-baff、p IRES2-EGFP-baff表達(dá)質(zhì)粒純化后顯微注射到斑馬魚單細(xì)胞期胚胎,24~48 h后,在熒光顯微鏡下可以觀察到綠色熒光蛋白在斑馬魚胚胎早期已成功表達(dá)(彩插4圖4),與pEGFP-C1-baff和pEGFP-N1-baff注射后GFP陽性胚胎相比,p IRES2-GFP-baff質(zhì)粒注射的GFP陽性胚胎表達(dá)強(qiáng)度較弱且表達(dá)時間相對緩慢。
3 討論
魚類是最早發(fā)生獲得性免疫的脊椎動物,這使得對斑馬魚免疫系統(tǒng)的研究成分為了人們了解非特異性免疫系統(tǒng)和獲得性免疫系統(tǒng)相互關(guān)系的重要模式動物[2,7]。Baff主要表達(dá)于T細(xì)胞和單核細(xì)胞,巨噬細(xì)胞、樹突細(xì)胞等抗原呈遞細(xì)胞[4],Baff屬于Ⅱ型跨膜蛋白,胞外部分可被水解酶剪切為具有特定生物功能的可溶片段進(jìn)入血液[9-11]。有研究表明,過表達(dá)baff蛋白的轉(zhuǎn)基因小鼠存在B細(xì)胞異常激活和多種致病性自身抗體的分泌,腎臟中抗原與自身抗體復(fù)合物的出現(xiàn)[6,12-14]。Baff拮抗劑在動物模型中可有效清除B細(xì)胞,延緩腎病出現(xiàn)并延長生存,抗Baff單克隆抗體的臨床研究也初步顯示出療效[15]。因此,構(gòu)建Baff過表達(dá)斑馬魚,利用其作為SLE模型可以為高通量篩選SLE治療藥物提供一種易于獲得的條件。
斑馬魚baff基因蛋白編碼區(qū)域由807 bp堿基組成,其中包括跨膜蛋白組成部分以及胞外功能區(qū)域。我們首先分離提取斑馬魚Baff高表達(dá)的脾臟組織RNA,RT-PCR克隆了編碼完整Baff蛋白的全長序列,為了避免融合蛋白的胞外部分剪切造成功能上的影響同時便于對外源轉(zhuǎn)入baff基因表達(dá)情況進(jìn)行跟蹤,本實驗分別構(gòu)建了Baff融合于EGFP N端和C端的融合蛋白重組質(zhì)粒,同時為了確保Baff行使正常的蛋白功能我們進(jìn)一步構(gòu)建了Baff與GFP共同獨立表達(dá)的p IRES2-EGFP-baff質(zhì)粒。通過體外細(xì)胞轉(zhuǎn)染實驗與免疫印跡實驗驗證了蛋白的正確表達(dá),并通過斑馬魚卵胞質(zhì)注射獲得了轉(zhuǎn)基因陽性幼魚。
為建立并篩選表達(dá)完整功能Baff蛋白且具GFP熒光篩選功能的純合子,未來的研究工作需要在純化轉(zhuǎn)基因品系的同時開展對SLE相關(guān)疾病指標(biāo)的檢測,例如抗dsDNA自身抗體表達(dá)水平,血清IgM表達(dá)水平以及腎臟、肝臟等器官病理變化等,進(jìn)一步探討其作為人類SLE疾病模型意義。
[1]A llen,J.P.and M.N.Neely.Trolling for the idealmodel host:zebrafish take the bait.Future Microbiol,2010.5(4):563-9.
[2]Langenau,D.M.and L.I.Zon.The zebrafish:a new model of T-cell and thymic development.Nat Rev Immunol,2005.5(4):307-17.
[3]Rolink,A.G.and F.Melchers.baffled B cells survive and thrive:roles of baff in B-cell development.Curr Opin Immunol,2002.14(2):266-75.
[4]Enzler T,Bonizzi G,Silverman GJ,et al.Alternative and classical NF-kappa B signaling retain autoreactive B cells in the splenic marginal zone and result in lupus-like disease.Immunity,2006.25(3):403-15.
[5]Marston,B.and R.J.Looney.Connective tissue diseases:Translating the effectsof baff in SLE.Nat Rev Rheumatol,2010.6(9):503-4.
[6]StohlW,Jacob N,Guo S,et al.Constitutive overexpression of baff in autoimmune-resistant mice drives only some aspects of system ic lupus erythematosus-like autoimmunity.Arthritis Rheum,2010.62(8):2432-42.
[7]Levraud JP,Colucci-Guyon E,Redd MJ,et al.In vivo analysis of zebrafish innate immunity.Methods Mol Biol,2008.415:337 -63.
[8]Ota M,Duong BH,Torkamani A,et al.Regulation of the B cell receptor repertoire and self-reactivity by baff.J Immunol,2010.185(7):4128-36.
[9]Bossen C,Cachero TG,Tardivel A,et al.TACI,unlike baff-R,is solely activated by oligomeric baff and APRIL to support survival of activated B cells and plasmablasts.Blood,2008.111(3):1004-12.
[10]Gross JA,Johnston J,Mudri S,et al.TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune disease.Nature,2000.404(6781):995-9.
[11]Gavin AL,Duong B,Skog P,et al.deltabaff,a splice isoform of baff,opposes full-length baff activity in vivo in transgenic mouse models.J Immunol,2005.175(1):319-28.
[12]Groom J,Kalled SL,Cutler AH,et al.Association of baff/BLyS overexpression and altered Bcell differentiation with Sjogren's syndrome.JClin Invest,2002.109(1):59-68.
[13]Stohl W,Xu D,Kim KS,et al.baff overexpression and accelerated glomerular disease in mice with an incomplete genetic predisposition to systemic lupus erythematosus.Arthritis Rheum,2005.52(7):2080-91.
[14]Thorn M,Lewis RH,Mumbey-Wafula A,et al.baff overexpression promotes anti-dsDNA B-cell maturation and antibody secretion.Cell Immunol,2010.261(1):9-22.
[15]Hsu H,Khare SD,Lee F,et al.A novel modality of BAFF-specific inhibitor AMG623 peptibody reduces B-cell number and improves outcomes in murinemodels of autoimmune disease.Clin Exp Rheumatol,2012.30(2):197-201

